| 水合物法高炉煤气脱除二氧化碳的热力学模型研究 |
b. 北京科技大学,化学与生物工程学院,北京 100083
b. School of Chemistry and Biological Engineering, University of Science and Technology Beijing, Beijing 100083, China
高炉煤气是钢铁企业的重要副产品之一,其主要成分为20 %~28 %的CO、1.5 %~3 %的H2、16 %~22 %的CO2及55 %~58 %的N2[1].高炉每生产一吨生铁,可以产生1 400~2 500 m3的高炉煤气,发生量巨大,能产生的能源价值也十分可观.然而高占比的不可燃成分(CO2及N2)使得高炉煤气的发热值很低,给高炉煤气的二次利用造成了较大的困难,也给冶金工业的节能减排带来巨大考验[2].因此,脱除高炉煤气中的不可燃成分,提高煤气的品质,将大大拓宽高炉煤气的利用领域[3-4].
由于二氧化碳的反应活性较氮气高,且根据国家二氧化碳减排的计划要求,因此,脱除二氧化碳是高炉煤气提质最主流、也是最有效的方法[5].目前脱除二氧化碳的主要方法有物理吸附法、化学吸收法、膜分离法、变压吸附法及水合物分离法等.由于原料(主要为水)经济易得,设备工艺简单,反应条件温和等特点,水合物分离法越来越成为研究二氧化碳捕集与封存(CCS)的学者关注的热点.
水合物是一种非化学当量的晶体结构化合物,其中水分子在氢键的作用下形成固定结构的主体晶格,而气体分子作为客体分子被包裹在这些晶格中而稳定存在.不同分子量的气体分子在不同的条件下会形成不同结构的水合物,主要分为Ⅰ型、Ⅱ型和H型3种不同的类型结构[6].当在水中添加热力学促进剂后,促进剂大分子占据水合物晶体的大笼,气体小分子占据体积较小的小笼,此时形成半笼型水合物,能大大降低水合物的生成压力.正四丁基溴化铵(以下均简称TBAB)因其环保特性及不挥发的特性,受到了研究者的关注.目前,水合物法在电厂烟气(主要成分为CO2、N2)处理方面较为成熟[7].然而高炉煤气成分的水合物热力学相平衡研究却几乎没有.文中基于Chen-Guo热力学模型[8-9],对高炉煤气成分(取V(CO2):V(CO):V(N2):V(H2)=0.200:0.238:0.527:0.035)的TBAB半笼型水合物的相平衡条件进行模拟计算.采用文献中含CO2、CO、N2和H2成分的水合物相平衡数据对模型进行验证分析,然后对高炉煤气组成的TBAB半笼型水合物的生成温度及压力进行预测,并采用恒温压力探索法[10],测得相关实验数据进行验证.
1 模型计算 1.1 理论基础及假设对于水合物的形成过程,Chen和Guo[8]提出了两步法生成机理:
第1步:水分子和气体、TBAB等客体分子通过准化学反应过程形成化学计量的基本水合物;准化学反应即水分子以氢键形式形成笼状结构,客体分子进入体积较大的大笼,大笼之间以体积较小的空笼相互连接,其过程可以用如下反应式表示:
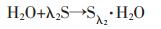
|
(1) |
式(1)中,S表示TBAB及气体分子,λ2表示基本水合物中每个水分子携带的S的数量.
第2步:溶解在水中的小气体分子进入第1步中生成的空的连接笼中,形成稳定的非化学计量的半笼型水合物.
TBAB半笼型水合物相行为十分复杂,为简化计算,基于以上的两步法形成机理,对高炉煤气+TBAB水合物形成结构作如下假设:
1) 大笼以及连接笼都只能被最多一个客体分子占据;
2) TBAB和CO2、CO、N2均可以与水形成基本水合物,而H2由于其分子尺寸过小,不足以支撑基本水合物晶体结构,无法形成基本水合物;
3) TBAB大分子不能进入连接笼,而CO2、CO、N2及H2气体分子均可以占据连接笼;
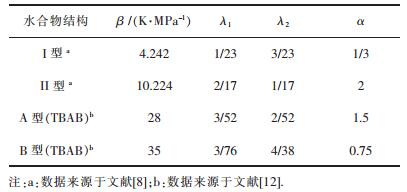
4) TBAB溶液的浓度不同,TBAB形成的半笼型水合物晶体结构也不同[11].当TBAB质量浓度低于18 %时,形成B型水合物;当TBAB质量浓度高于18 %时,形成A型水合物;对于气体水合物,当有热力学促进剂存在时,形成Ⅱ型水合物结构.
1.2 模型推导及参数选择基于Chen-Guo热力学模型,在平衡条件下,气相和水合物相中的气体的逸度相等,对于TBAB水合物,TBAB在液相与在水合物相中的逸度也相等,因此:
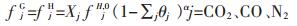
|
(2) |
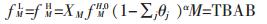
|
(3) |
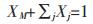
|
(4) |
式(2)、式(3)、式(4)中:上标G、H、L分别表示气相、水合物相及液相;下标M代表TBAB,j代表气体;X为组分基本水合物在混合基本水合物中所占比例;fH, 0表示连接笼未被占据时客体分子在水合物相的逸度;α=λ1/λ2,λ1表示基本水合物中每个水分子携带的连接笼的数量;θ则是被气体分子占据的连接笼占连接笼总量的比例,可通过下式计算:
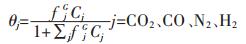
|
(5) |
式(5)中,C为Langmuir吸附常数,可以表示为温度的函数,可由Antoine公式进行估算:
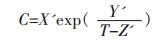
|
(6) |
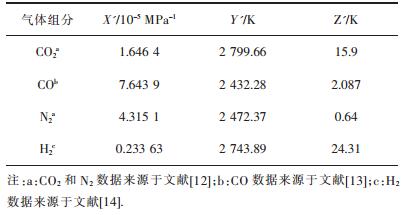
X'、Y'、Z'为Antoine参数,其取值列于表 1.
| 表 1 计算气体Langmuir常数的Antoine参数 Table 1 The Antoine parameter for calculating the Langmuir constant of gas |
 |
| 点击放大 |
式(2)、式(3)中的fH, 0可表示为温度T、压力P以及水的活度aw3个因素的函数:
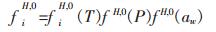
|
(7) |
其中,
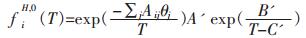
|
(8) |
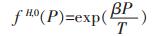
|
(9) |
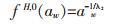
|
(10) |
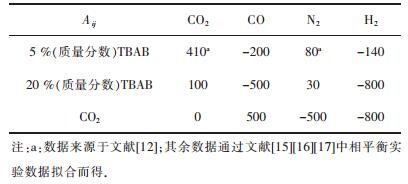
β为结构参数,可以认为是一个常数. β与λ1、λ2的值均列于表 2. Aij为客体分子间的二元交互作用参数,其中Aij=Aji,Aii=0.文中只考虑TBAB与各气体组分、CO2与剩余气体组分之间的二元交互作用参数,其取值列于表 3,未考虑的Aij值均设为0.
| 表 2 β、λ1、λ2、α的取值 Table 2 The value of β、λ1、λ2、α |
 |
| 点击放大 |
| 表 3 二元相互作用参数Aij Table 3 The binary cross interaction parameter Aij |
 |
| 点击放大 |
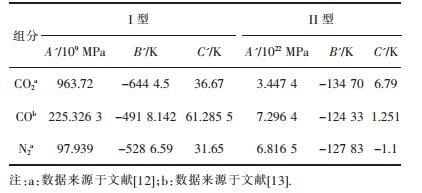
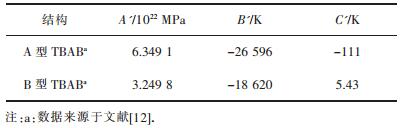
各成分的A'、B'、C'由纯气体水合物相平衡数据拟合或直接从文献中取值.具体取值列于表 4、表 5.
| 表 4 计算不同气体的fiH, 0(T)的Antoine参数 Table 4 The Antoine parameter for calculating fiH, 0(T) of different gases |
 |
| 点击放大 |
| 表 5 计算TBAB的fiH, 0(T)的Antoine参数 Table 5 The Antoine parameter for calculating fiH, 0(T) of TBAB |
 |
| 点击放大 |
式(10)中水的活度aw可由下式计算:
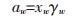
|
(11) |
xw为水在TBAB溶液中真实的摩尔分数,γw为水在TBAB溶液中的活度系数,γw由NTRL模型计算而得[18-19],xw通过下式计算:
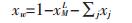
|
(12) |
其中,气体分子溶解在水中的摩尔分数xj为:
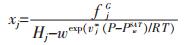
|
(13) |
式(13)中,vj∞为在无限稀释条件下气体在溶液中的偏摩尔体积;Hj-w为气体在水中的Henry常数,由下式计算[20]:
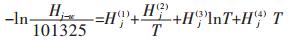
|
(14) |
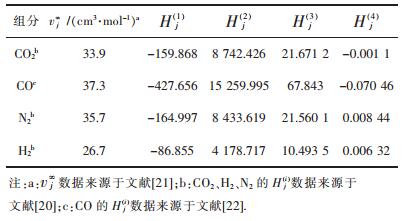
vj∞、Hj(1)、Hj(2)、Hj(3)、Hj(4)的取值皆列于表 6.
| 表 6 vj∞及Hj(1)、Hj(2)、Hj(3)、Hj(4)的取值 Table 6 The value of vj∞ and Hj(1)、Hj(2)、Hj(3)、Hj(4) |
 |
| 点击放大 |
式(2)中,气相中气体组元的逸度fjG通过P-T状态方程[23]计算,式(3)中TBAB在液相中的逸度则用下式计算:
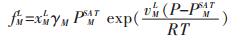
|
(15) |
式(15)中,xML为TBAB在溶液中的摩尔分数,γM为TBAB的活度系数,PMSAT为TBAB的饱和蒸气压,vML则为TBAB在溶液中的摩尔体积. PMSAT可由下述的关联式[24]进行估算:
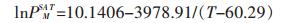
|
(16) |
式(16)中,温度T的单位为K,饱和蒸气压PMSAT的单位为10-1 MPa.
TBAB的活度系数γM由以下的关联式进行计算:
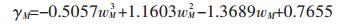
|
(17) |
式(17)中,wM为TBAB的质量分数. TBAB在溶液中的摩尔体积vML为:
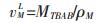
|
(18) |
式(18)中,MTBAB为TBAB的摩尔质量;ρM为TBAB溶液的密度,可通过以下的经验公式估算[25]:
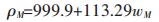
|
(19) |
计算步骤如下:
1) 输入温度T,TBAB质量分数及混合气体的组成;
2) 给生成压力设定一个初始值P0;
3) 通过P-T状态方程计算混合气体在气相中的逸度;
4) 通过式(15)计算TBAB在液相中的逸度fML;
5) 通过式(6)计算气体组分的Langmuir常数C,然后通过式(5)计算气体组分在连接笼的占有率θ;
6) 通过式(11)计算水的活度aw;
7) 分别通过式(8)、式(9)、式(10)计算fiH, 0(T)、fH, 0(P)、fH, 0(aw),然后通过式(7)计算fiH, 0;
8) 通过式(2)、式(3)分别计算组分i所形成的基本水合物在混合基本水合物中所占的比例Xi;
9) 计算判别式|∑iXi -1|≤10-4是否成立,若不成立,则调整压力P的值,重复步骤3)~8),直到|∑iXi -1|满足精度要求.
计算流程如图 1所示.
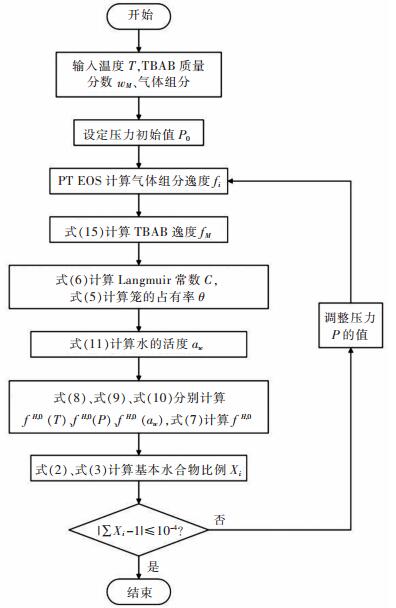 |
| 图 1 计算流程 Fig. 1 Flow chart of calculation |
2 计算结果与讨论 2.1 TBAB+CO2、TBAB+N2、TBAB+CO2+N2体系水合物生成压力计算结果
将上述计算过程应用于TBAB+CO2、TBAB+N2、TBAB+CO2+N2体系的水合物的形成压力的计算,其计算结果如图 2所示(图 2中气体组成用体积分数表示,下同).根据式(20)计算文献中的实验值与计算值之间的平均相对误差(AARD):
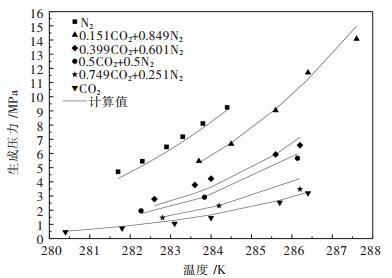 |
| 图 2 TBAB+CO2、TBAB+N2、TBAB+CO2+N2体系水合物形成压力计算结果与实验值 Fig. 2 Experimental values and calculation results of hydrate formation pressure on TBAB+CO2, TBAB+N2, TBAB+CO2+N2 system |
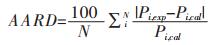
|
(20) |
式(20)中,N表示数据点个数.
TBAB质量分数为5 %时,TBAB+CO2、TBAB+N2体系[15]的AARD分别为12.18 %和5.41 %.不同气体组成的TBAB+CO2+N2体系[26-27]的AARD分别为2.96 %、11.03 %、5.23 %、8.52 %,计算值与实验值符合程度良好,说明该模型在一定程度上可以预测TBAB+CO2+N2体系水合物的形成压力.
2.2 TBAB+CO2+CO体系水合物生成压力计算结果将上述计算过程应用于计算TBAB+CO2+CO体系的水合物的形成压力,其计算结果如图 3所示. TBAB质量分数分别为5 %和20 %时,TBAB+CO2+CO体系的AARD分别为16.79 %和9.82 %,计算值与实验值存在一定偏差,即该模型对于含CO体系的计算存在较大的误差.
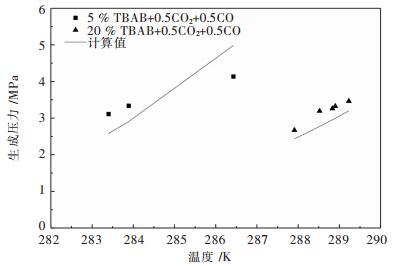 |
| 图 3 TBAB+CO2+CO体系水合物形成压力计算结果与实验值 Fig. 3 Experimental values and calculation results of hydrate formation pressure on TBAB+CO2 +CO system |
2.3 TBAB+H2、TBAB+CO2+H2、TBAB+CO2+CO+H2体系水合物生成压力计算结果
将上述计算过程应用于计算TBAB+含H2体系的水合物的形成压力,其计算结果如图 4所示. TBAB+H2体系[15]的AARD为15.14 %;不同TBAB质量分数的TBAB+CO2+H2体系[17]的AARD分别为9.15 %、7.02 %和10.22 %. TBAB质量分数为20 %时,TBAB+CO2+CO+H2体系[17]的AARD为14.72 %.
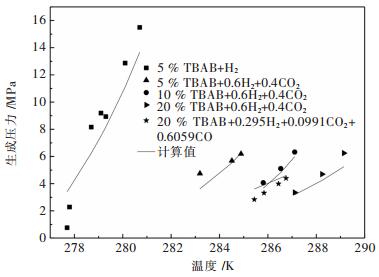 |
| 图 4 TBAB+含H2体系水合物形成压力计算结果与实验值 Fig. 4 Experimental values and calculation results of hydrate formation pressure on TBAB system containing H2 |
2.4 CO2+CO+N2+H2体系水合物生成压力计算结果
将上述计算过程应用于计算CO2+CO+N2+H2体系的水合物的形成压力,其计算结果如图 5所示.不同组成的CO2+CO+N2+H2在纯水体系的AARD分别为11.67 %和7.53 %[28-29].对TBAB+高炉煤气体系的水合物生成压力进行计算预测,并用压力探索法测得实验值进行比较验证,AARD为16.6 %.
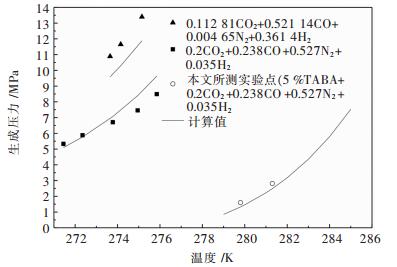 |
| 图 5 CO2+CO+N2+H2体系水合物形成压力计算结果与实验值 Fig. 5 Experimental values and calculation results of hydrate formation pressure on CO2+CO+N2+H2 |
2.5 误差来源分析
对模型计算产生的误差进行分析,误差主要来源于以下几个方面:
1) 目前研究发现,对于TBAB溶液体系,其水合物相行为十分复杂,具有至少5种不同的水合物结构,其对应的水合水分子数分别为24、26、32、36、38[30].然而在计算中只考虑了2种比较普遍的水合物结构(A型:含26水/每个晶格结构;B型:含38水/每个晶格结构),且为方便计算,在计算过程中假设在一个TBAB浓度下仅存在一种水合物结构,不考虑2种或2种以上半笼型结构同时存在的情况.
2) 由于实验方法的不同,得到的一些水合物生成数据也会存在一些差异.
3) 由于目前尚未有TBAB+CO体系的水合物相关研究,CO在TBAB溶液中的部分模型参数是由TBAB+N2的实验数据拟合而得的.
3 结论基于Chen-Guo热力学模型,对高炉煤气+TBAB体系的水合物生成压力进行模型计算,并对模型参数进行选择与优化,研究结论如下:
1) 对含CO2、CO、N2、H2不同气体组成的混合气在TBAB溶液中的水合物生成压力进行计算,并与文献中的实验值进行比较,平均相对误差在3 %~16 %左右,数据符合情况较好.
2) 对不同浓度组成的CO2+CO+N2+H2+水体系的水合物生成压力的计算结果比较,平均相对误差在7.5 %~11.7 %左右,数据符合情况良好.
3) 对高炉煤气组成在TBAB溶液中的水合物生成压力进行计算预测,并用压力探索法进行实验验证,平均相对误差为16.6 %.结果表明该模型可以在一定程度上对高炉煤气组成在TBAB溶液中的水合物相平衡预测计算,但计算精度仍有待提高.
| [1] |
王筱留.
钢铁冶金学, 炼铁部分[M]. 北京: 冶金工业出版社, 2013.
|
| [2] |
苍大强. 国内外冶金工业源头节能减排的新方法、新技术[J].
有色金属科学与工程, 2015, 6(6): 1–6.
|
| [3] |
李长乐, 薛庆国, 董择上, 等. 氧气高炉喷吹气化炉重整煤气工艺的火用分析[J].
有色金属科学与工程, 2018, 8(2): 6–12.
|
| [4] |
杜开平, 赵世强, 吴胜利. 熔融气化炉风口回旋区冶炼特征的数值模拟研究[J].
有色金属科学与工程, 2017, 8(2): 8–13.
|
| [5] |
蓝荣宗, 王静松, 韩毅华, 等. 高还原势气氛下烧结矿低温还原粉化试验研究[J].
有色金属科学与工程, 2012, 3(1): 5–9.
|
| [6] |
SLOAN E D. Fundamental principles and applications of natural gas hydrates[J].
Nature, 2003, 426(6964): 353. DOI: 10.1038/nature02135. |
| [7] |
李小森, 鲁涛, 陈朝阳, 等. 水合物法分离烟气(CO2/N2)中CO2的实验研究[J].
现代化工, 2009, 29(10): 37–40.
DOI: 10.3321/j.issn:0253-4320.2009.10.009.
|
| [8] |
CHEN G J, GUO T M. A new approach to gas hydrate modelling[J].
Chemical Engineering Journal, 1998, 71(2): 145–151. DOI: 10.1016/S1385-8947(98)00126-0. |
| [9] |
CHEN G J, GUO T M. Thermodynamic modeling of hydrate formation based on new concepts[J].
Fluid Phase Equilibria, 1996, 122(1/2): 43–65. |
| [10] |
赵光华. CO2-N2-TBAB-H2O体系水合物生成实验和模型研究[J].
石油化工高等学校学报, 2016, 29(6): 11–17.
DOI: 10.3969/j.issn.1006-396X.2016.06.003.
|
| [11] |
HASHIMOTO S, SUGAHARA T, MORITOKI M, et al. Thermodynamic stability of hydrogen + tetra- n -butyl ammonium bromide mixed gas hydrate in nonstoichiometric aqueous solutions[J].
Chemical Engineering Science, 2008, 63(4): 1092–1097. DOI: 10.1016/j.ces.2007.11.001. |
| [12] |
LIAO Z, GUO X, ZHAO Y, et al. Experimental and modeling study on phase equilibria of semiclathrate hydrates of tetra-n-butyl ammonium bromide + CH4, CO2, N2, or Gas Mixtures[J].
Industrial & Engineering Chemistry Research, 2013, 52(51): 18440–18446. |
| [13] |
SUN Q, GUO X, LIU A, et al. Formation conditions and thermodynamic model predictions of carbon monoxide hydrates[J].
Fluid Phase Equilibria, 2011, 307(1): 95–99. DOI: 10.1016/j.fluid.2011.04.016. |
| [14] |
WANG Y, ZHANG J, GUO X, et al. Experiments and modeling for recovery of hydrogen and ethylene from fluid catalytic cracking (FCC) dry gas utilizing hydrate formation[J].
Fuel, 2017, 209: 473–489. DOI: 10.1016/j.fuel.2017.07.108. |
| [15] |
MOHAMMADI A H, ESLAMIMANESH A, BELANDRIA V, et al. Phase equilibria of semiclathrate hydrates of CO2, N2, CH4, or H2 + tetra-n-butylammonium bromide aqueous solution[J].
Journal of Chemical & Engineering Data, 2011, 56(10): 3855–3865. |
| [16] |
KIM S M, JU D L, LEE H J, et al. Gas hydrate formation method to capture the carbon dioxide for pre-combustion process in IGCC plant[J].
International Journal of Hydrogen Energy, 2011, 36(1): 1115–1121. DOI: 10.1016/j.ijhydene.2010.09.062. |
| [17] |
WANG S, DANNER M, KUCHLING T, et al. Measurement of the three-phase (vapour+liquid+solid) equilibrium conditions of semi-clathrates formed from mixtures of CO2, CO and H2[J].
Journal of Chemical Thermodynamics, 2013, 56(3): 149–152. |
| [18] |
BELVÉZE L S, BRENNECKE J F, STADTHERR M A. Modeling of activity coefficients of aqueous solutions of quaternary ammonium salts with the electrolyte-NRTL equation[J].
Industrial & Engineering Chemistry Research, 2004, 43(3): 815–825. |
| [19] |
CHEN C C, EVANS L. A local composition model for excess Gibbs energy of electrolyte systems[J].
Aiche Journal, 1986, 32(3): 444–454. DOI: 10.1002/(ISSN)1547-5905. |
| [20] |
KLAUDA J B, SANDLER S I. Phase behavior of clathrate hydrates: a model for single and multiple gas component hydrates[J].
Chemical Engineering Science, 2003, 58(1): 27–41. |
| [21] |
MOORE J C, BATTINO R, RETTICH T R, et al. Partial molar volumbes of gases at infinite dilution in water at 298.15 K[J].
Journal of Chemical & Engineering Data, 1982, 27(1): 22–24. |
| [22] |
RETTICH T R, BATTINO R, WILHELM E. Solubility of gases in liquids. 15. high-Precision determination of henry coefficients for carbon monoxide in liquid water at 278 to 323K[J].
Berichte der Bunsenge sells chaftfür physicali sche Chemie, 1982, 86(12): 1128–1132. |
| [23] |
PATEL N C, TEJA A S. A new cubic equation of state for fluids and fluid mixtures[J].
Chemical Engineering Science, 1982, 37(3): 463–473. DOI: 10.1016/0009-2509(82)80099-7. |
| [24] |
LIAO Z X, GUO X Q, LI Q, et al. Experimental and modeling study on the phase equilibria for hydrates of gas mixtures in TBAB solution[J].
Chemical Engineering Science, 2015, 137: 656–664. DOI: 10.1016/j.ces.2015.07.019. |
| [25] |
DUC N H, CHAUVY F, HERRI J M. CO2 capture by hydrate crystallization-A potential solution for gas emission of steelmaking industry[J].
Energy Conversion & Management, 2007, 48(4): 1313–1322. |
| [26] |
MOHAMMADI A H, ESLAMIMANESH A, BELANDRIA V, et al. Phase equilibrium measurements for semi-clathrate hydrates of the (CO2+N2+tetra-n-butylammonium bromide) aqueous solution system[J].
Journal of Chemical Thermodynamics, 2012, 46(5): 57–61. |
| [27] |
MEYSEL P, OELLRICH L, BISHNOI P R, et al. Experimental investigation of incipient equilibrium conditions for the formation of semi-clathrate hydrates from quaternary mixtures of (CO2+N2+TBAB+H2O)[J].
Journal of Chemical Thermodynamics, 2011, 43(10): 1475–1479. DOI: 10.1016/j.jct.2011.04.021. |
| [28] |
孙强, 刘爱贤, 郭绪强. 水合物法分离合成气实验研究[J].
高校化学工程学报, 2010, 24(5): 739–744.
DOI: 10.3969/j.issn.1003-9015.2010.05.003.
|
| [29] |
KWAK G H, SA J H, KIM S H, et al. Effects of promoter on the formation of gas hydrate from blast furnace gas[J].
Korean Chemical Engineering Research, 2015, 53(1): 103–110. DOI: 10.9713/kcer.2015.53.1.103. |
| [30] |
LI D L, DU J W, FAN S S, et al. Clathrate dissociation conditions for methane+tetra-n-butyl ammonium bromide (TBAB)+Water[J].
Journal of Chemical & Engineering Data, 2007, 52(5): 1916–1918. |
 2018, Vol. 9
2018, Vol. 9


