| 嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌联合浸出高锡多金属硫化矿 |
1b. 中南大学,生物冶金教育部重点实验室,长沙 410083;
2. 中国有色矿业集团有限公司,北京 100029
1b. Key Laboratory of Biometallurgy, Ministry of Education, Central South University, Changsha 410083, China;
2. China Nonferrous Metal Mining(Group) Co., Ltd., Beijing 100029, China
锡是一种具有银白色金属光泽的重要金属,具备熔点低、耐腐蚀、抗疲劳、无毒性、性质稳定且可塑性良好等优点[1-3].随着一带一路战略的开展和中国经济的迅猛发展,发展战略性新兴材料成为当下研究热点,锡的战略价值与日俱增.在高新技术领域,锡被应用于军工、高精医疗器械材料、IT行业、核发电、汽车新材料制造和航空航天等方面[1-5]:例如Chen等[6]利用锡铂合金合成超薄纳米片,构建超导体效果较好;Ya等[7]通过利用铜锌锡合金构建薄膜太阳能电池,发现其性能良好,有望投入使用.
随着锡矿资源的开发利用,全球锡矿资源储量锐减.据美国地质调查局调查结果,2014年世界锡矿石产量为2.96亿t,中国锡矿石产量为1.25亿t,占世界总锡矿石产量的42 %[8].国外锡矿主要分布于东南亚、南美中部、澳洲、俄罗斯、非洲中南部及濒临大西洋地区的西欧[6-7].而中国锡矿主要分布在云南、湖南、内蒙、广东、新疆及广西等地区,锡资源储量占全球第一,新增锡矿资源量为264万t,占全球锡已知锡矿资源的32 %[7, 9, 10].经过统计,全球锡资源储量仅能保障15年[8],全球锡精矿的产量正逐年下降,世界总体锡矿资源储量处于下降状态,且发现新锡矿储量的速度远远低于开发消耗速度,所以提高锡矿选锡产率和回收率势在必行.
锡石在成矿过程中与硫化矿致密共生,相互镶嵌包裹,硫化矿的存在严重影响了锡石的回收率,故选锡过程中需优先脱硫.目前,对锡矿进行脱硫的方法是物理化学法,通过使用药剂对矿物改性进行浮选、重选和磁选等,主要工艺流程分为浮选——重选、磁选除铁——脱泥——浮选——重选相结合、重选——浮选——重选、浮选——重选——浮选及浮选——磁选——重选联合流程等[5-22].
但在选锡过程中,由于硫化矿和锡石对浮选药剂的选择性相似,硫化矿会随着锡石浮选上浮,浮选硫化矿时,大量的锡石也会随着硫化矿上浮.如果采用其他选矿方式,会严重影响锡精矿品位,同时也会加大浮选药剂的消耗[5, 8-32].目前已发掘的极大部分锡矿中,硫化矿所占比例极高,浮选锡石用到的捕收剂水杨羟肟酸在遇到金属硫化矿时同样会发生强烈作用,从而导致锡石浮选的选择性大大降低,降低锡石品位和回收率的同时也增加了药耗.此外,传统的脱硫工艺还存在以下几种问题:一是锡精矿品位仍旧偏低.这是因为锡矿在成矿过程中与一些脉石矿物、多金属硫化矿等致密共生,在选锡过程中脱硫除铁效果差;二是回收锡石过程中回收率较低.锡精矿在重选工艺中,锡精矿的物理性质造成自然沉降过程中损失严重,造成回收率降低.三是锡矿在磨矿过程中极易粉碎,过泥化严重,大量矿石的存在,在浮选过程中,矿泥中会夹带部分锡石,从而造成锡石的损失.四是脱硫率不高,脱硫后尾矿中仍存在过量的硫化矿,严重影响锡精矿回收率和品位.五是含锌硫的锡矿多金属硫化矿在浮选过程中需要用到氰化钠等剧毒试剂,对环境和安全造成极大隐患,与当下环保理念相悖.因此,寻找绿色环保高效的锡矿脱硫方法变得至关重要.
生物冶金技术在国内外广泛推广应用,例如2000年纽蒙特矿业公司在美国内达华州采用生物堆浸浸出黄金,提高黄金回收率的同时保护了当地环境.应用于生物冶金的菌种种类繁多,其中嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans, A. ferrooxidans)是生物冶金的模式菌种;嗜酸氧化硫硫杆菌(Acidithiobacillus thiooxidans, A. thiooxidans)是硫养菌,在硫化矿物的浸出过程中起重要作用,二者是目前应用最为广泛的生物冶金的菌种[33].嗜酸氧化亚铁硫杆菌是一种嗜温微生物,它能够通过氧化亚铁离子形成高铁离子,嗜酸氧化硫硫杆菌在酸性条件下是一种强化剂可以催化氧化硫化矿物[33-37].嗜酸氧化硫硫杆菌能够快速氧化元素硫,也能够快速氧化还原硫化物但不能利用亚铁离子,因此嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌联合浸出能够有效地提高硫化矿的浸出效率.以黄铁矿为例,硫化矿物浸出机理化学反应方程式如下[34]:
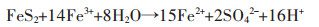
|
(1) |
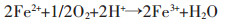
|
(2) |
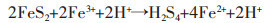
|
(3) |
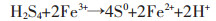
|
(4) |
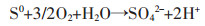
|
(5) |
虽然生物冶金方法被用来浸出黄铁矿、黄铜矿等矿物[33-35],但是国内外尚未有报道利用微生物通过浸出高锡硫化矿的研究.因此,文中以高锡多金属硫化矿为研究对象,采用嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌联合浸出高锡多金属硫化矿,以期找到绿色高效脱硫方法.
1 实验材料和方法 1.1 矿物实验所用高锡多金属硫化矿是从缅甸某矿山公司采集并破碎磨矿,粒径不超过75 μm,X射线衍射(XRD)及X射线荧光光谱分析(XRF)分析结果如下,黄铁矿(FeS2,44.76 %), 锡石(6.66 %), 石英(15.32 %), 电气石(8.17 %), 云母(8.20 %), 石膏(3.22 %), 其他矿物(13.74 %). XRF分析各元素组成如下,S(17.52 %), Fe(16.29 %), Sn(3.66 %), O (35.1 %), Si (22.71 %), 其它元素(10.72 %).
1.2 菌种、培养方法及理化参数测定实验所用菌种嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌来自中南大学生物冶金教育部重点实验室,分离自德兴铜矿酸性矿坑水.采用改良后的9K培养基[34],其成分为:(NH4)2SO4 3.0 g/L, Na2SO4 2.1 g/L, MgSO4·7H2O 0.5 g/L, K2HPO4 0.05 g/L, KCl 0.1 g/L, Ca(NO3)2 0.01 g/L.初始pH值为2.00,温度为30 ℃,摇床转速为170 r/min,培养时间28 d.在开展浸出实验前对菌种进行驯化实验,分别驯化嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌2种纯菌(高锡硫化矿矿浆浓度为10 %),等比混合后驯化培养混合菌(矿浆密度为10 %).氧化还原电位和pH值采用PHS-3C型pH计测量,氧化还原电位测量采用Ag/AgCl电极作为参比.细菌计数采用血球板计数法,溶液中铁离子浓度采用邻菲罗啉分光光度计进行测定.
1.3 生物浸出实验开展4组(A1、A2、A3和A4)纯菌混合菌浸出对比实验,A1为嗜酸氧化亚铁硫杆菌, A2为嗜酸氧化硫硫杆菌,A3为嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌,A4为无菌对照组.接种量均为10 %,矿浆密度为10 %.
1.4 混合菌浸矿过程菌种含量动态变化分析 1.4.1 基因组DNA提取分别于浸出第6天、12天、18天、24天收取20 mL浸出液,10 000 g离心10 min,收集菌体,采用pH值为2.0的酸化水洗涤2次后离心提取基因组DNA,采用细菌基因组DNA提取试剂盒(天根生化科技有限公司)提取基因组DNA,具体步骤详见试剂盒说明书.使用分光光度计(NannoDrop ND-1000)检测DNA浓度,用琼脂糖凝胶电泳检测DNA的完整性.提取的DNA保存于-80 ℃备用.
1.4.2 实时定量PCR不同浸矿时期群落演替变化采用qRT-PCR进行测定,通过qRT-PCR对2种菌拷贝数换算菌体密度.分别根据Blanca等[38]报道的针对嗜酸氧化亚铁硫杆菌设计的16SrRNA基因片段的特异性引物序列,与Francisco等[39]报道针对嗜酸氧化硫硫杆菌的16SrRNA基因片段的特异性引物序列设计用于qRT-PCR的引物,具体序列及片段长度见表 1.
| 表 1 嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌的16SrRNA基因特异性引物 Table 1 Specific primers 16SrRNAgene for A.ferrooxidans and A.thiooxidans |
 |
| 点击放大 |
实时定量PCR反应体系为25 μL,其中包括ddH2O 10.5 μL,SYBR Green Real-time PCR Master Mix 12.5 μL,正反向引物各0.5 μL和模板DNA 1 μL.实时定量PCR所用仪器为iCycler iQ Real-time PCR Detection System(Bio-Rad Laboratories Inc., Hercules, USA), 同时设计了阴性对照组实验,实时定量PCR程序设定为:
预变性 95 ℃ 3 min;
解链 95 ℃ 15 s;
退火 55 ℃ 30 s;
延伸 72 ℃ 30 s;
共循环40次.
在循环结束后绘制PCR产物的溶解度曲线,反应温度从55 ℃逐渐上升到95 ℃,根据熔解曲线的峰值和走势来分析PCR扩增产物的特异性情况.
2 结果与讨论 2.1 纯菌和混合菌对锡矿脱硫的比较研究 2.1.1 纯菌和混合菌对锡矿脱硫的生长曲线变化如图 1所示,混合菌菌体密度在对数期及稳定期比嗜酸氧化亚铁硫杆菌纯菌菌体密度高,且到达稳定期的时间比混合菌到达稳定期的时间延迟2天,延滞期缩短1天.造成这种现象的原因是由于嗜酸氧化硫硫杆菌在产酸方面起重要作用[40],导致混合菌延滞期pH低于嗜酸氧化亚铁硫杆菌纯培养pH(见图 3),从而有效地避免了细菌在延滞期pH升高现象,较低的pH有利于细菌生长,缩短浸矿周期.其次是因为氧化亚铁硫杆菌生长最适pH值为2.0左右,浸矿至中后期,pH逐渐下降,不利于嗜酸氧化亚铁硫杆菌的生长,且此时溶液中Fe3+浓度增加,形成黄钾铁矾沉淀,故氧化亚铁硫杆菌纯菌在对数期及稳定期菌体密度低于混合菌.混合菌中嗜酸氧化硫硫杆菌菌体密度逐渐增加(见图 4),减少矿物表面钝化层的形成,有利于嗜酸氧化亚铁硫杆菌与能源物质接触,促进其生长,从而导致混合菌浸出过程中总菌体密度高于纯菌浸出[40-46].
 |
| 图 1 嗜酸氧化亚铁硫杆菌、嗜酸氧化硫硫杆菌纯菌和混合菌对锡矿脱硫生长曲线变化 Fig. 1 Growth curves of biodesulfurization tin ore by pure cultures and mixed cultureof A.ferrooxidans and A.thiooxidans |
 |
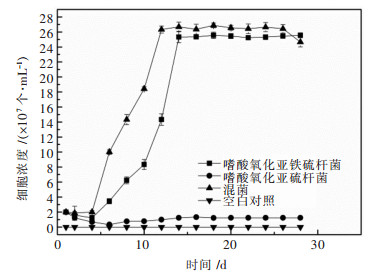
| 图 3 嗜酸氧化亚铁硫杆菌、嗜酸氧化硫硫杆菌纯菌和混合菌对锡矿脱硫过程中pH及电位的变化 Fig. 3 Variation of the pH value and Eh(mV vs Ag/AgCl) during biodesulfurization of A.ferrooxidans、A.thiooxidans pure culture and mixed culture |
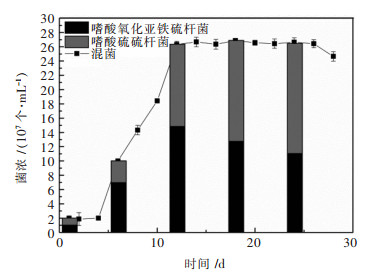 |
| 图 4 嗜酸氧化硫硫杆菌和嗜酸氧化亚铁硫杆菌混合菌对锡矿脱硫过程中嗜酸氧化亚铁硫杆菌、嗜酸氧化硫硫杆菌动态变化 Fig. 4 Variation of 16SrDNA copies of A.ferrooxidans and A.thiooxidans in the real-time PCR assay, the DNA used in the assay was extracted from the free cells in the solution at the 6th, 12th, 18th, 24th day during biodesulfurization tin ore by A.ferrooxidans and A.thiooxidans |
2.1.2 纯菌和混合菌对锡矿脱硫的总铁浓度及脱硫率对比
如图 2所示,混合菌浸出速率和脱硫率优于纯菌浸出,在前6天,混合菌浸出总铁离子浓度与嗜酸氧化亚铁硫杆菌纯菌浸出总铁离子浓度相当. 6天后,混合菌浸出铁离子浓度明显高于单菌.混合菌浸出在第18天达到浸出铁离子浓度的最大值15.89 g/L,脱硫率为97 %左右,而嗜酸氧化亚铁硫杆菌纯菌浸出则在第22天达到浸出铁离子浓度的最大值15.75 g/L,脱硫率为96 %左右.混合菌浸出优于纯菌浸出的原因是嗜酸氧化硫硫杆菌为硫养菌,嗜酸氧化亚铁硫杆菌为铁养兼性硫养菌,嗜酸氧化亚铁硫杆菌既能够利用亚铁离子又能够利用硫单质,而嗜酸氧化硫硫杆菌能够利用硫代硫酸盐及中间产物硫单质,两者混合浸出,能够有效地提高铁离子的浸出效率和速率,从而减少锡矿中硫的含量.此外,文献[36-40]报道嗜酸氧化硫硫杆菌具备极强的产酸能力,有效地较少了矿物表面钝化层的形成,有利于嗜酸氧化亚铁硫杆菌的生长.纯菌和混合菌浸出过程中,铁离子浓度在达到最大值后开始下降,与溶液中铁离子形成黄钾铁矾沉淀有关,溶液中铁离子浓度过高,pH升高(见图 3),形成了大量的黄钾铁矾沉淀,从而铁离子浓度下降[42].
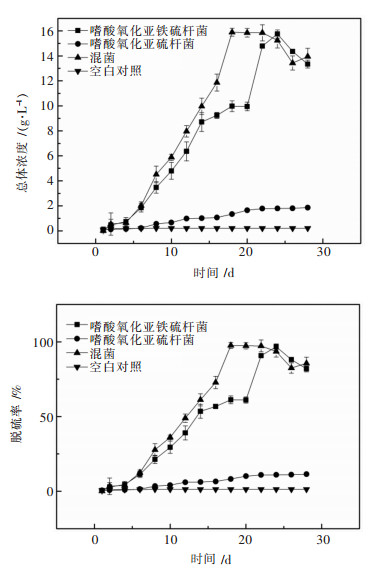 |
| 图 2 嗜酸氧化亚铁硫杆菌、嗜酸氧化硫硫杆菌纯菌和混合菌对锡矿脱硫总铁离子及脱硫率对比 Fig. 2 Variation of the total iron and percent of desulfurizaiotn in the desulfurization tin ore by pure cultures and mixed culture A.ferrooxidans and A.thiooxidans |
2.1.3 纯菌和混合菌对锡矿脱硫过程中pH及电位的变化
如图 3所示,混合菌浸出高锡多金属硫化矿在前5天,pH先上升后缓慢下降,对数期之后迅速下降.此后到22天左右pH开始上升,纯菌和混合菌浸出高锡多金属硫化矿过程中氧化还原电位一直呈上升趋势,两者相差不大,但总体混合菌的ORP要略高于嗜酸氧化亚铁硫杆菌纯培养的ORP.嗜酸氧化硫硫杆菌纯培养浸出过程中pH略低于对照组,氧化还原电位略高于对照组.浸出过程前5天,pH升高的原因是由于此时是细菌生长的延滞期,菌数量较少,产酸少于酸耗. 5天过后pH下降的原因是细菌达到生长的对数期和稳定期,菌体密度迅速升高,细菌利用锡矿中的黄铁矿,氧化产生更多的Fe3+及H+,酸耗小于产酸量,pH下降.混合菌浸出的pH低于纯菌浸出pH的原因是嗜酸氧化硫硫杆菌在生物浸出实验产酸的过程中起到重要作用[37, 42].混合菌浸出在14天左右的pH下降速率高于嗜酸氧化亚铁硫杆菌纯培养,造成这种现象的原因是嗜酸氧化硫硫杆菌大量繁殖,菌体密度迅速上升(见图 4),而嗜酸氧化硫硫杆菌具备极强的产酸能力,从而产生了大量的H+,导致溶液pH迅速下降,下降速率超过嗜酸氧化亚铁硫杆菌纯培养.纯菌和混合菌浸出分别自24天和22天起,pH开始升高.造成这种现象的原因可能是,矿渣中黄铁矿完全浸出(见图 6可知,浸渣里不含黄铁矿),浸矿末期生成了大量的黄钾铁矾,细菌因缺乏能源物质开始衰亡从而导致溶液中pH的快速上升[42].
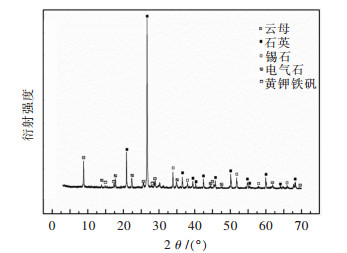 |
| 图 6 浸出矿渣XRD结果 Fig. 6 XRD pattern of tin ore after bioleaching |
2.2 锡矿脱硫过程中嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌动态变化研究
从图 4中可以看出,嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌联合浸出高锡多金属硫化矿过程中,浸矿初期(第6天)嗜酸氧化亚铁硫杆菌是优势菌种,所占比例为69.4 %,到对数期和稳定期,嗜酸氧化硫硫杆菌快速增长,逐渐成为优势菌群,在第18天所占比例达到52.6 %,总量超过嗜酸氧化亚铁硫杆菌,在第24天所占比例达到58.3 %,此时浸矿周期已经结束.同时为图 1、图 2和图 3对数期到稳定期嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌联合浸出菌体密度、总铁浓度等优于嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌单菌浸出的原因提供了证据.
造成上述现象的原因是浸矿到了中后期溶液中存在大量的铁离子,伴随着氧化还原电位(ORP)升高形成了黄钾铁矾,附着在矿物表面,嗜酸氧化亚铁硫杆菌与黄铁矿被隔断,可利用能源物质减少,不利于自身生长.嗜酸氧化硫硫杆菌此时起到的作用是,利用中间硫单质为能源大量繁殖并产生大量的酸,通过生成黄钾铁矾逆反应消除矿物表面的铁离子沉淀钝化层.此外胞外分泌的EPS与矿物之间形成了细胞层,附着在矿物表面,从而促进黄铁矿的溶解,故嗜酸氧化硫硫杆菌菌体密度迅速增加[36, 42-46].同时嗜酸氧化硫硫杆菌的产酸能力导致pH值进一步下降,且pH低于纯菌浸出,见图 3.
2.3 锡矿脱硫过程中矿渣形态及其成分研究如图 5所示,图 5(a)为嗜酸氧化亚铁硫杆菌与嗜酸氧化硫硫杆菌联合浸出矿渣,图 5(b)为嗜酸氧化硫硫杆菌浸出矿渣,图 5(c)为嗜酸氧化亚铁硫杆菌浸出矿渣,图 5(d)为对照组,图 5(a)相较于其他3组相比较为细碎,且疏松多孔,孔裂隙发育和扩展明显,矿石晶格破坏严重,晶簇间形成大小不一的溶蚀坑,可能是因为硫化矿在浸出过程中与锡矿分离,浸矿菌不断附着矿物表面向矿物内部侵蚀,而锡多金属硫化矿中硫化矿与锡矿相互包裹镶嵌,硫化矿被浸出后,锡矿呈小颗粒状析出. 图 5(b)和图 5(d)矿物表面相对致密,晶格规整,图 5(c)晶格破坏相对严重,但相较于图 5(b)来看,表面没有太多的稀松多孔的沉淀,矿石颗粒较大.
 |
| 图 5 嗜酸氧化亚铁硫杆菌、嗜酸氧化硫硫杆菌纯培养和混合培养浸渣SEM图片对比 Fig. 5 Comparison of SEM images of the tin ore bioleached by pure cuture and mixed culture A. ferrooxidans and A.thiooxidans |
图 6所示为XRD浸出矿渣分析结果,由图 6可知,矿物a组中黄铁矿被全部浸出,黄钾铁矾的含量为5.94 %,锡石含量为9.26 %,其他矿物种类与未浸出前矿物种类一致. c组黄铁矿同样被全部浸出,黄钾铁矾的含量为6.35 %,a组黄钾铁矾含量低于c组的原因是嗜酸氧化硫硫杆菌的产酸能力极强,相对较低的pH减少了黄钾铁矾的形成[38]. b、d两组未形成黄钾铁矾,黄铁矿含硫量近似于原矿.而通过XRF可知,a组硫含量为1.71 %, 铁含量为2.298 %. c组硫含量为2.31 %,铁含量为3.262 %.硫元素来自矿渣中的黄钾铁矾,与实验所测结果一致. XRF元素含量见表 2.
| 表 2 嗜酸氧化亚铁硫杆菌、嗜酸氧化硫硫杆菌纯培养和混合浸出矿渣XRF分析结果/% Table 2 XRF analysis of tin ore after bioleaching by pure cutures and mixed culture of A. ferrooxidans and A.thiooxidans /% |
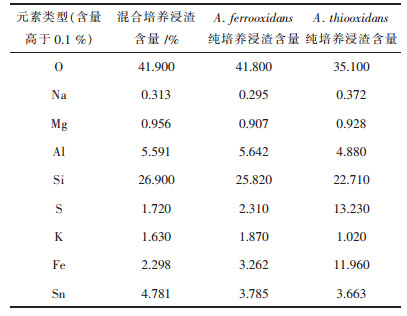 |
| 点击放大 |
3 结论
1) 嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌联合浸出高锡多金属硫化矿优于纯菌浸出,18天内对锡矿的硫脱除率达到97 %.
2) 嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌混合浸矿初期,嗜酸氧化亚铁硫杆菌是优势菌种,所占比例达69.4 %,到浸矿中后期,嗜酸氧化硫硫杆菌含量逐渐增加成为优势菌种,所占比例达58.3 %.
3) 细菌对锡矿脱硫浸出周期较短,更易达到国家标准(硫砷含量 < 4 %),且不会造成锡的损失,故具备应用可行性.
| [1] |
杨金林, 周文涛. 锡石选矿研究概述[J].
现代矿业, 2016, 565(5): 3–5.
|
| [2] |
窦永平. 组合捕收剂浮选细粒锡石作用机理及应用探索[J].
地质·勘察·测绘, 2014(6): 110–111.
|
| [3] |
周清波, 王长福, 阳华玲, 等. 锡矿选矿研究进展[J].
矿冶工程, 2015, 35: 1–5.
|
| [4] |
刘杰, 韩跃新, 朱一民, 等. 细粒锡石选矿技术研究进展及展望[J].
金属矿山, 2014, 460(10): 6–11.
|
| [5] |
张福良, 殷腾飞, 周楠. 全球锡矿资源开发利用现状及思考[J].
现代矿业, 2014, 538(2): 1–5.
|
| [6] |
CHEN Q, YANG Y, CAO Z, et al. Excavated cubic platinum-tin alloy nanocrystals constructed from ultrathin nanosheets with enhanced electrocatalytic activity[J].
Angewandte Chemie, 2016, 128(31): 9167–9171. DOI: 10.1002/ange.201602592. |
| [7] |
JADHAV Y A, THAKUR P R, HARAM S K. Voltammetry investigation on copper zinc tin sulphide/selenide (CZTSxSe1-x) alloy nanocrystals: Estimation of composition dependent band edge parameters[J].
Solar Energy Materials & Solar Cells, 2016, 155: 273–279. |
| [8] |
张建斌, 丁建华, 南格利. 中国锡矿资源特征及主要远景区潜力分析[J].
中国地质, 2015, 42(4): 839–852.
|
| [9] |
张晋禄. 提高八梅铅锌锡多金属矿锡选别指标的研究[D]. 昆明: 昆明理工大学, 2016.
|
| [10] |
熊上暤. 某难选锡石—硫化矿型锡矿石的选矿[J].
有色金属科学与工程, 1992(1): 15–18.
|
| [11] |
肖骏, 陈代雄, 杨建文, 等. 某铜锌锡矿浮选流程的优化及对锡重选的影响[J].
有色金属科学与工程, 2016, 7(1): 89–95.
|
| [12] |
吴浩, 黄万抚, 金磊, 等. 江西某钨矿重选尾矿中硫化矿的回收试验研究[J].
有色金属科学与工程, 2016, 7(6): 100–104.
|
| [13] |
张富. 中国锡工业发展思路[J].
中国有色金属, 2013, 13: 38–39.
|
| [14] |
吕中海. 四川大顶山微细粒矽卡岩型铁锡矿选矿工艺研究[D]. 赣州: 江西理工大学, 2009.
|
| [15] |
吴开兴, 张恋, 陈陵康, 等. 赣南新安子钨锡矿床流体包裹体地球化学研究[J].
有色金属科学与工程, 2013(5): 70–78.
|
| [16] |
涂玉国. 含锡多金属硫化矿生产工艺及选锡工艺研究[D]. 昆明: 昆明理工大学, 2011.
|
| [17] |
张晋禄. 提高八梅铅锌锡多金属矿锡选别指标的研究[D]. 昆明: 昆明理工大学, 2016.
|
| [18] |
张慧. 组合捕收剂浮选细粒锡石作用机理及应用研究[D]. 长沙: 中南大学, 2010.
|
| [19] |
周宋. 梁河锡矿选矿实验分析及工艺流程确定[J].
有色金属设计, 1997, 24(2): 50–53.
|
| [20] |
李平. 细粒浸染多金属斑岩型锡矿选矿工艺试验研究[J].
有色金属科学与工程, 2008, 22(4): 12–15.
|
| [21] |
李宏建, 李新冬. 国内外锡选矿进展[J].
中国矿山工程, 2006, 35(5): 10–13.
|
| [22] |
何东, 兰希熊. 都龙难选多金属矿中锡石回收工艺流程的研究[J].
有色金属(选矿部分), 2015(1): 36–40.
|
| [23] |
徐阳宝. 锡石多金属硫化矿选矿工艺及机理研究[D]. 长沙: 中南大学, 2011.
|
| [24] |
柯丽芳. 新型锡石辅助捕收剂BYSN及其作用机理[D]. 长沙: 中南大学, 2012.
|
| [25] |
张建斌. 中国锡矿资源特征及主要远景区潜力分析[J].
中国地质, 2015, 42(4): 839–844.
|
| [26] |
杨金林, 周文涛, 马少建. 锡石多金属硫化矿磨矿试验研究[J].
有色金属(选矿部分), 2017(1): 60–64.
|
| [27] |
李伟. 云南某低品位钨锡矿选矿试验研究[J].
中国矿业, 2014, 23(6): 135–139.
|
| [28] |
孙仲元, 叶煜波. 栗木锡矿选炼厂钨锡细泥高梯度磁选的研究[J].
有色金属科学与工程, 1987(2): 28–36.
|
| [29] |
孙玉秀. 云南某锡石-硫化矿选矿试验研究[D]. 昆明: 昆明理工大学, 2009.
|
| [30] |
熊上暤. 某脉锡矿石的选矿研究[J].
有色金属科学与工程, 1993(3): 121–124.
|
| [31] |
彭伟, 童雄, 张自江. 锡石浮选药剂的现状与发展[J].
价值工程, 2017, 36(8): 234–237.
|
| [32] |
蒋素芳. 国外某高硫锡矿石选矿工艺研究[J].
矿冶工程, 2015, 35(3): 6–9.
|
| [33] |
VERA M, SCHIPPERS A, SAND W. Progress in bioleaching: fundamentals and mechanisms of bacterial metal sulfide oxidation—part A[J].
Applied Microbiology & Biotechnology, 2013, 97(17): 7529–7541. |
| [34] |
BRIERLEY C L, RIERLEY J A. Progress in bioleaching: part B: applications of microbial processes by the minerals industries[J].
Applied Microbiology and Biotechnology, 2013, 97(17): 7543–7552. DOI: 10.1007/s00253-013-5095-3. |
| [35] |
DEVECI H, AlKCIL A, ALP I. Bioleaching of complex zinc sulphides using mesophilic and thermophilic bacteria: comparative importance of pH and iron[J].
Hydrometallurgy, 2004, 73(3/4): 293–303. |
| [36] |
RUNLAN Y, CHUNWEI H, AJUAN L, et al. Extracellular DNA enhances the adsorption of Sulfobacillus thermosulfidooxidans strain ST on chalcopyrite surface[J].
Hydrometallurgy, 2018, 176: 97–103. DOI: 10.1016/j.hydromet.2018.01.018. |
| [37] |
XIA M C, BAO P, LIU A J, et al. Isolation and identification of Penicillium chrysogenum strain Y5 and its copper extraction characterization from waste printed circuit boards[J].
Journal of Bioscience and Bioengineering, 2018. DOI: 10.1016/j.jbiosc.2018.02.001. |
| [38] |
ESCOBAR B, BUSTOS K, MORALES G, et al. Rapid and specific detection of acidithiobacillus ferrooxidans and leptospirillum ferrooxidans by PCR[J].
Hydrometallurgy, 2008, 92(3/4): 102–106. |
| [39] |
REMONSELLEZ F, GSALLEGUILLOS F, MORENO‐PAZ M, et al. Dynamic of active microorganisms inhabiting a bioleaching industrial heap of low‐grade copper sulfide ore monitored by real- time PCR and oligonucleotide prokaryotic acidophile microarray[J].
Microbial biotechnology, 2009, 2(6): 613–624. DOI: 10.1111/mbt.2009.2.issue-6. |
| [40] |
FALCO L, POGLIANI C, CURUTCHET G, et al. A comparison of bioleaching of covellite using pure cultures of acidithiobacillus ferrooxidans and acidithiobacillus thiooxidans or a mixed culture of leptospirillum ferrooxidans and acidithiobacillus thiooxidans[J].
Hydrometallurgy, 2003, 71(1): 31–36. |
| [41] |
WATLING H R, COLLINSON D M, FJASTAD S, et al. Column bioleaching of a polymetallic ore: Effects of pH and temperature on metal extraction and microbial community structure[J].
Minerals Engineering, 2014, 58(4): 90–99. |
| [42] |
CHANGBIN W, WEIMIN Z, HONGBO Z, 等. Bioleaching of chalcopyrite by mixed culture of moderately thermophilic microorganisms[J].
中南大学学报:英文版, 2007, 14(4): 474–478.
|
| [43] |
LIN Z, QIU G Z, YUEHUA H, 等. Bioleaching of pyrite by A[J].
中国有色金属学报:英文版, 2008, 18(6): 1415–1420.
|
| [44] |
HARNEIT K, GOKSEL A, KPCK D, et al. Adhesion to metal sulfide surfaces by cells of acidithiobacillus ferrooxidans, acidithiobacillus thiooxidans and leptospirillum ferrooxidans[J].
Hydrometallurgy, 2006, 83(1/2/3/4): 245–254. |
| [45] |
RODRIGUEZ A G, NAVARRO H R. Interfacial insights of pyrite colonized by acidithiobacillus thiooxidans cells under acidic conditions[J].
Hydrometallurgy, 2010, 103(1): 35–44. |
| [46] |
PlUMB J J, MUDDLE R, FRANZMANN P D. Effect of pH on rates of iron and sulfur oxidation by bioleaching organisms[J].
Minerals Engineering, 2008, 21(1): 76–82. DOI: 10.1016/j.mineng.2007.08.018. |
 2018, Vol. 9
2018, Vol. 9


