| 基于SECM研究5083铝镁合金在不同pH NaCl溶液中的腐蚀行为 |
2. 中国科学院过程工程研究所,北京 100090
2. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100090, China
5083型铝镁合金作为一种新型轻质的合金结构材料,其具有低密度、耐蚀性好、抗压性强和易加工等优良性能,被广泛应用于船舶、舰艇、机械制造、航空、航天和汽车等领域[1, 2].然而在海洋环境中铝镁合金容易发生腐蚀,如:点腐蚀、鼓泡、剥层腐蚀等,这会导致船舶结构裂纹扩展速率加快,缩短船舶的疲劳寿命.因此,研究5083铝镁合金在复杂海洋环境中的腐蚀行为,尤其是能原位实时观测5083铝镁合金表面电化学的变化,显得尤为必要和具有深远的意义[3].
近年来,国内外研究学者对铝镁合金的腐蚀问题开展了广泛的研究.例如:张艾艾等[4]通过电化学测试研究了5A06铝镁合金的海水腐蚀电化学特性,赵月红等[5]研究了不同加工及表面处理状态下铝镁合金的深海腐蚀行为,穆振军等[6]研究了45#钢和铝镁合金在淡海水和海水交替环境下的腐蚀行为,但是大都基于传统的电化学方法,主要考察整个样品的宏观变化,不能很好的反映局部的腐蚀以及材料与环境的作用机理与过程,从而限制了对许多复杂腐蚀体系的深入研究.微区扫描电化学显微镜(SECM)是一种新的实时原位监测电化学技术,可对复杂腐蚀体系进行原位实时观测,这为深入研究局部腐蚀过程提供了一个崭新的平台.因此,王新印等[7]运用SECM的产生、收集和反馈模式研究了纯Mg在NaCl和NaSO4溶液中腐蚀过程的微区(点、线、面)析氢行为和活性点的演变过程;Michael V Mirkin等[8]采用SECM和SEM研究了铝镁合金海水腐蚀电化学特性,认为增大NaCl浓度、降低pH值和阳极极化均有利于纯Mg表面活性点的产生;周亚茹等[9]在开路条件下用SECM研究了氯离子浓度对Ni-P合金涂层失效过程影响的SECM实验和COMSOL模拟研究.目前,针对用SECM原位实时分析铝镁合金腐蚀过程中的极化行为和交流阻抗行为等方面的报道比较少[10, 11],因此,本文采用微区电化学显微镜(SECM)原位技术,基于在不同的pH NaCl溶液下,实时测试5083铝镁合金在腐蚀过程中的极化行为和交流阻抗行为,以研究模拟海洋环境下pH对铝镁合金腐蚀的影响.
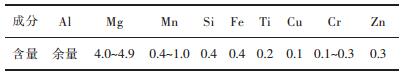
1 实验实验材料为5083铝镁合金,其化学成分的含量(质量分数wt %)见表 1
| 表 1 5083铝镁合金的化学成分/(质量分数, %) Table 1 Chemical composition of 5083 aluminum magnesium alloy/(mass fraction, %) |
 |
| 点击放大 |
实验装置为普林斯顿VersaScan微区扫描电化学工作站,配置2台双恒电位仪VersaSTAT 3F和VersaSTAT 3.其中的扫描电化学显微镜系统采用三电极体系,工作电极为5083铝镁合金试样,参比电极为饱和氯化银电极(Ag/AgCl),对电极为铂针.在系统工作过程中,超微探针会反馈电信号到计算机,然后计算机收集数据在软件上绘图.
5083铝镁合金工作电极表面为直径5mm圆形抛光面,样品表面首先通过金相砂纸逐级打磨,然后用0.5um金刚石研磨膏抛光,最后经丙酮除油、去离子水清洗后吹干待用.实验环境为0.6mol/L的NaCl溶液,用HCl和NaOH调节溶液的pH值,用奥豪斯仪器有限公司的PHSJ-3F型号pH测试仪进行测试,实验温度控制在20℃左右.具体实验装置如图 1:
 |
| 1.参比电极(Ag/AgCl);2.超微探针;3.对电极(Pt);4.NaCl溶液;5.基底(5083铝镁合金) 图 1 SECM装置图及电解池示意图 Fig. 1 Schematic diagram of SECM device and electrolytic cell |
2 结果及讨论 2.1 不同pH NaCl溶液的极化行为
极化曲线作为一种常用的研究金属腐蚀机理的电化学方法,研究它可以获得5083铝镁合金自腐蚀电流密度、自腐蚀电位等常规电化学特性.为获得腐蚀电流,可采用Tafel外推法处理极化曲线. Tafel外推法:
| $ \begin{array}{l} \;\;\;\;\;\;\;\;\;\;\;{i_c} = {i_{{\rm{corr}}}}\left[{\exp \left( {\frac{{2.3{\eta _c}}}{{{b_c}}}} \right)-\exp \left( {\frac{{2.3{\eta _A}}}{{{b_A}}}} \right)} \right] = {i_{corr}} \cdot \\ \left[{\exp \left( {\frac{{2.3{\eta _c}}}{{{b_c}}}} \right)-\exp \left( {\frac{{2.3{\eta _c}}}{{{b_A}}}} \right)} \right] \end{array} $ |
| $ \begin{array}{l} \;\;\;\;\;\;\;\;\;\;\;\;\;\;{i_A} = {{\mathord{\buildrel{\lower3pt\hbox{$\scriptscriptstyle\leftarrow$}} \over i} }_1}- {{\vec i}_2} = {i_{{\rm{corr}}}}\left[{\exp \left( {\frac{{2.3{\eta _A}}}{{{b_A}}}} \right)-\exp \left( {\frac{{2.3{\eta _c}}}{{{b_A}}}} \right)} \right] = \\ {i_{corr}}\left[{\exp \left( {\frac{{2.3{\eta _A}}}{{{b_A}}}} \right)-\exp \left( {\frac{{2.3{\eta _A}}}{{{b_A}}}} \right)} \right] \end{array} $ |
过电位>70 mV时,
| $ {\eta _c} =-{b_c}\log {i_{{\rm{corr}}}} + {b_c}\log {i_c} $ | (1) |
| $ {\eta _A} =-{b_A}\log {i_{{\rm{corr}}}} + {b_A}\log {i_A} $ | (2) |
式(1)、式(2)中:bA为阳极极化曲线斜率,bc为阴极极化曲线斜率,icorr为腐蚀电流密度.
极化曲线测试电压以开路电位为基准进行设置(-0.3~0.3 V),以1 mV/s速度进行正向扫描. 图 2为5083铝合金在不同pHNaCl溶液中的极化曲线,由图 2可知,在pH=3、5、7条件下,其Tafel曲线线型存在一定的相似度,有明显的钝化平台且钝化区间较长,即在酸性和中性NaCl溶液下,浸泡初期存在相同的腐蚀过程.阳极过程是金属在一定外电势下的溶解过程,氧化反应为:
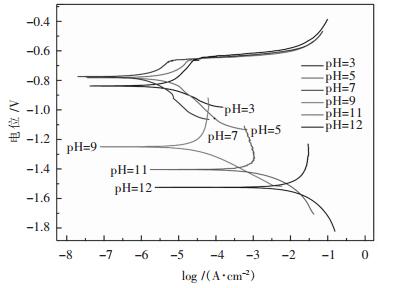 |
| 图 2 不同pH NaCl溶液中的极化曲线 Fig. 2 Polarization curves in different pH NaCl solutions |
| $ {\rm{Al}} \to {\rm{A}}{{\rm{l}}^{{\rm{3 + }}}} + 3{{\rm{e}}^-} $ | (3) |
而在碱性条件下,pH=9、11、12时的Tafel曲线则不存在钝化平台,且线型不同于酸性和中性溶液下的Tafel曲线,说明碱性溶液下的NaCl溶液可以更强烈的破坏钝化膜,腐蚀程度增强.所以碱性条件下的阳极过程为:
| $ {\rm{Al + 4O}}{{\rm{H}}^{\rm{-}}} \to {\rm{Al}}\left( \rm{OH} \right)_4^-+ 3{{\rm{e}}^-} $ | (4) |
因此,统计分析图 2中不同pH下Tafel曲线下的点蚀电位、维钝电流密度和腐蚀电位,得到表 2.
| 表 2 不同pH值(3~7)条件下NaCl溶液中Tafel曲线外推结果 Table 2 Extrapolated results of Tafel curves in NaCl solution at pH shifts from 3 to 7 |
 |
| 点击放大 |
从图 2和表 2分析可知,在pH值在3~7下为钝化体系,随着pH的增加,其腐蚀电位正移,pH=3时腐蚀电位最负,pH=3、5、7下的点蚀电位相差不大,维钝电流密度随着pH的增大而减小,而点蚀电位越高,维钝电流密度越小,材料在此环境中的耐腐蚀性越好,腐蚀速率越小.因此,由以上分析可知,在酸性条件下,随着NaCl溶液中pH的降低,5083铝镁合金的耐腐蚀性逐渐变差,其腐蚀速率加快.
pH值在9~12下为活性溶解体系,随着pH的增加,其腐蚀电位负移,pH=12时腐蚀电位最负.为深入评价材料的耐腐蚀性能好坏,引出腐蚀电流密度计算腐蚀深度,腐蚀深度用年深度(mm/a)变化表示,即1年过程中受腐蚀的金属表面某一点和其原始表面间的垂直距离变化量.计算公式:
| $ V = \frac{{8.76 \times A \times {i_{{\rm{corr}}}}}}{{ndF}} $ | (5) |
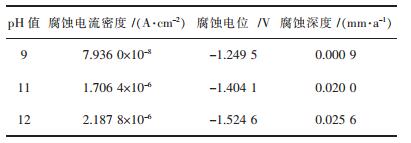
式(5)中:A为原子量;icorr为腐蚀电流密度(A/cm2);n为反应中物质得失电荷数;d为材料密度(g/cm3);F=26.8(A/h).由表 2中的腐蚀电流密度,计算相应的腐蚀深度,Tafel外推法结果如表 3所示.
| 表 3 不同pH值(9~12)条件下NaCl溶液中Tafel曲线外推结果 Table 3 Extrapolation results of Tafel curves in NaCl solution of pH 9~12 |
 |
| 点击放大 |
由表 3可知,在碱性条件下,随着pH的增加,其腐蚀电流密度逐渐增加,腐蚀电位逐渐减小,由-1.2495V降至-1.5246V,腐蚀电流密度逐渐增大,由7.9360×10-8A/cm2增大至2.1878×10-6A/cm2.而如果腐蚀电流密度越小,则腐蚀电位越大,其材料的耐腐蚀性能越好,腐蚀速率越小.因此,基于表 3可知,随着pH的增加,腐蚀深度明显增大,由0.0009mm/a增加至0.0256mm/a,说明5083铝镁合金的耐腐蚀性逐渐变差,其腐蚀速率加快.
2.2 不同pH NaCl溶液的交流阻抗行为对不同pH值条件下的NaCl溶液中的Nyquist阻抗谱进行了测试研究,在0.02~10000 Hz频率测试范围内,由高频率向低频率扫描,正弦波信号的振幅为10mV.不同pH条件下,5083铝镁合金在0.6 mol/L NaCl溶液中的交流阻抗图谱如图 3所示.由图 3可知,在酸性体系下(pH=3, 5, 7), 相对应的图谱只出现高频区一个容抗弧,与之相对应的是金属基体与溶液形成的双电层行为,属于铝合金金属基体溶解过程[4, 7].随着pH的增加,容抗弧呈现收缩趋势;在碱性体系下(pH=9, 11, 12),合金出现高频容抗、中低频容抗的双容抗弧,而且在pH=12时,低频处有感抗弧的出现,高频表现出电极表面的溶解过程,低频表现出电极表面不均匀点蚀过程,该过程伴有Cl-离子的吸附过程,附着在合金试样表面,表面氧化膜完整性遭到溶解破坏,合金表面不稳定腐蚀出现,即该感抗弧段源于腐蚀产物的生成[12-13].
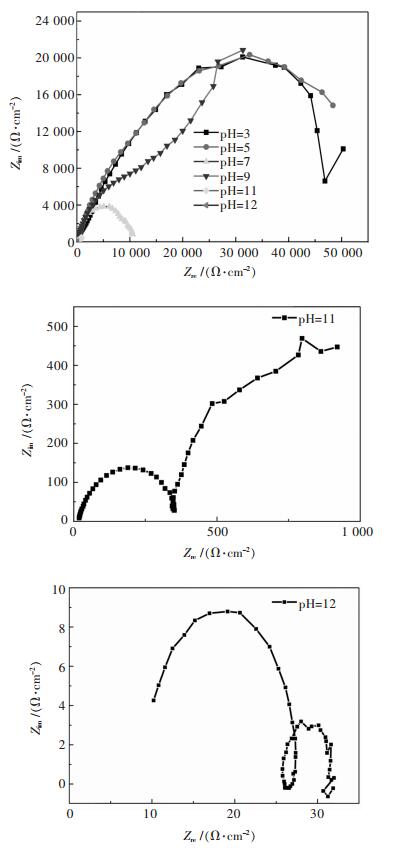 |
| 图 3 不同pHNaCl溶液中的Nyquist图谱 Fig. 3 Nyquist spectra in different pHNaCl solutions |
图 4为5083铝镁合金在不同pH NaCl溶液中的Bode图谱,由图 4可知,在酸性体系中,Bode图谱只表现为一个时间常数,所以只有一个容抗弧,随着pH的增加,阻抗减小、相位角也减小;这是由于在反应过程中钝化膜厚度的减少,Al溶解速率减弱,在腐蚀坑内的腐蚀产物减少[14].在碱性体系中,从Bode图中可看出,Bode图谱表现为2个时间常数,所以只有2个容抗弧,而且随着pH的增加,阻抗减小、相位角也减小;这是由于在反应过程中在腐蚀坑内的金属间化合物颗粒脱离增加,阴极反应加快,使合金表面的腐蚀产物吸脱附增加[15-16].
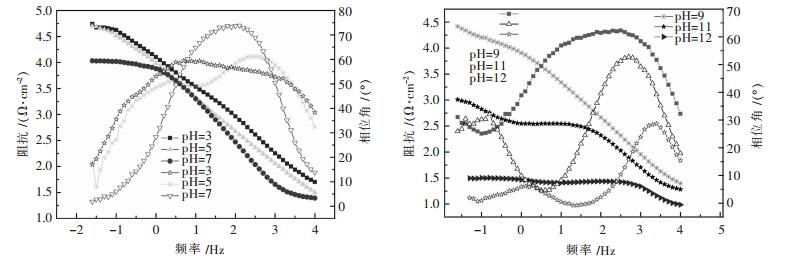 |
| 图 4 5083铝镁合金在不同pH NaCl溶液中的Bode图谱 Fig. 4 5083 Bode spectra of Al Mg alloy in different pH NaCl solutions |
因此,通过上述的Nyquist图谱和Bode图谱分析,经拟合可得到3个等效电路,如图 5所示,RS为溶液电阻,R1为电荷传递电阻. R2为电阻,Q为常相位角元件,L为电感.具体拟合值见表 4,C1、C2分别对应Q1、Q2电容值,n1与n2为弥散指数.
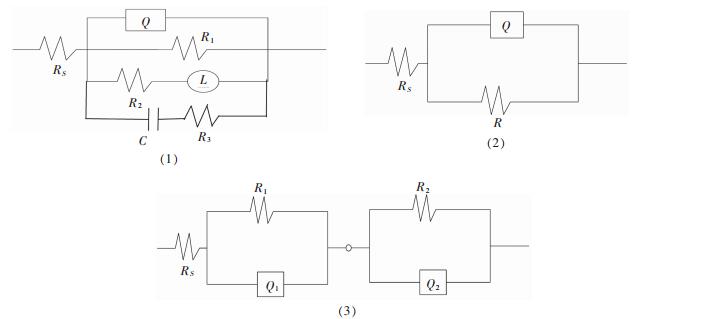 |
| 图 5 不同pH的NaCl溶液中EIS等效电路 Fig. 5 EIS equivalent circuit in NaCl solution of different pH |
| 表 4 不同pHNaCl溶液中EIS拟合结果 Table 4 Fitting results of EIS in NaCl solutions of different pH |
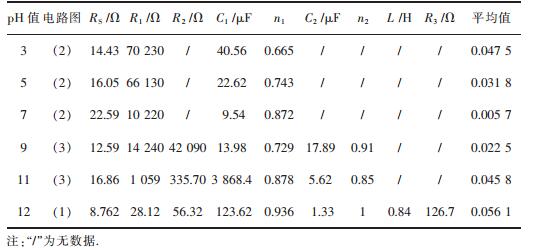 |
| 点击放大 |
由表 4可知,在酸性体系下(pH=3、5、7),随着pH的增加,溶液电阻增加,电荷传递电阻减小,即酸度减小电荷传递电阻加大,传递受到抑制,耐腐蚀性能上升,并且弥散指数n随pH的增加而增大,电容越趋向于纯电容,电容值减小, 合金表面腐蚀速率减小.在碱性体系下(pH=9、11、12),随着pH的增加,溶液电阻减小,电荷传递电阻从pH=9的14240 Ω降低到pH=12的28.12 Ω,电荷传递变得非常容易,电极表面氧化膜完整性易被损坏,耐腐蚀性能显著下降.这与Nyquist图谱的分析结果相吻合.
3 结论本文采用扫描电化学显微镜技术研究了5083铝镁合金在不同pH NaCl溶液中的腐蚀行为,利用动电位极化曲线、电化学阻抗谱、bode图谱等电化学测试技术探究了5083铝镁合金在不同pH NaCl溶液中的腐蚀机理,分析了pH值对合金腐蚀过程的影响,结论如下:
1) pH值为3~7,5083铝镁合金在溶液中的腐蚀体系为钝化体系,随着pH的增加,其腐蚀电位正移,点蚀电位相差不大,维钝电流密度随着pH的增大而减小,电化学阻抗谱中仅有1个容抗弧且容抗弧呈现收缩趋势.随着pH的增加,阻抗减小、相位角也减小.
2) pH值为9~12,5083铝镁合金在溶液中的腐蚀体系为活性溶解体系,随着pH的增加,其腐蚀电位负移,腐蚀电流密度逐渐增加,腐蚀电位逐渐减小,电化学阻抗谱中仅有2个容抗弧,而且在pH=12处有感抗弧出现.随着pH的增加,阻抗减小、相位角也减小.
3) 5083铝镁合金在pH=7的NaCl溶液中耐腐蚀性最好,腐蚀速率最小.其pH减小,会使溶液电阻减小,电荷传递电阻减小,电荷传递变得容易,Al溶解速率加快,耐腐蚀性能下降,电容值变大,电容越趋向于纯电容;其pH增加,会使电荷传递电阻从pH=9的14240 Ω降低到pH=12的28.12 Ω,电荷传递变得非常容易,电极表面氧化膜完整性易被损坏,Al溶解速率加快,耐腐蚀性能显著下降.
| [1] |
杨渊, 李玉光, 涂树林. 国外热镀锌铝镁合金镀层钢板及其标准综述[J].
冶金标准化与质量, 2013(6): 45–49.
|
| [2] |
祝晓文, 韩建民, 崔世海, 等. 铝、镁合金微弧氧化技术研究进展[J].
材料科学与工艺, 2006, 14(4): 366–369.
|
| [3] |
张静, 潘复生, 李忠盛. 耐热镁合金材料的研究和应用现状[J].
铸造, 2004, 53(10): 770–774.
DOI: 10.3321/j.issn:1001-4977.2004.10.003. |
| [4] |
张艾艾, 何晶靖, 刘天娇, 等. 5A06铝镁合金海水腐蚀电化学特性[J].
航空学报, 2015, 36(9): 3147–3154.
|
| [5] |
赵月红, 林乐耘. 不同加工及表面处理状态LF6铝镁合金的深海腐蚀行为[J].
中国有色金属学报, 2001, 11(增刊1): 27–30.
|
| [6] |
穆振军, 陈翔峰, 任润桃, 等. 45#钢和铝镁合金在淡海水交替环境下的腐蚀行为研究[C]// 2009'水环境腐蚀与防护学术研讨会. 北京: 中国腐蚀与防护学会, 2009.
|
| [7] |
王新印, 夏妍, 周亚茹, 等. 基于扫描电化学显微镜产生/收集和反馈模式研究纯Mg腐蚀行为[J].
金属学报, 2015, 51(5): 631–640.
DOI: 10.11900/0412.1961.2014.00602. |
| [8] |
MICHAEL V M, BENJAMIN R H. Elect roanalytical measurements using the scanning elect rochemical microscope[J].
Analytica Chimica Acta, 2000(406): 119–146. |
| [9] |
周亚茹, 朱泽洁, 聂林林, 等. 氯离子浓度对Ni-P合金涂层失效过程影响的SECM实验和COMSOL模拟研究[J].
表面技术, 2016, 45(7): 8–16.
|
| [10] |
杨少华, 赵宇娟, 李林山, 等. 微区电化学扫描技术应用现状[J].
有色金属科学与工程, 2017, 8(3): 29–34.
|
| [11] |
骆鸿, 魏丹. 金属腐蚀微区电化学研究进展(1)扫描电化学显微镜技术[J].
腐蚀与防护, 2009, 30(7): 437–441.
|
| [12] |
BERNARDO B K, CARLOTA G I. Precursor sites for localised corrosion on lacquered tinplates visualised by means of alternating current scanning electrochemical microscopy[J].
Electrochimica Acta, 2003(48): 1151–1121. |
| [13] |
LI J G, WU Z S.
Anti-corrosive Surface Engineering and Technology[M]. Beijing: Chemical Industry Press, 2003.
|
| [14] |
AHMAD S, GUPTA A P, SHARMIN E, et al. Synthesis, characterization and development of high performance siloxane-modified epoxy paints[J].
Prog. Org. Coat., 2005, 54: 248–255. DOI: 10.1016/j.porgcoat.2005.06.013. |
| [15] |
SANCHEZ-SANCHEZ C M, SOLLA-GULLON J, VIDAL-IGLESIAS F J, et al. Imaging structure sensitive catalysis on different shape-controlled platinum nanoparticles[J].
Journal of the American Chemical Society, 2010, 132(16): 5622–5624. DOI: 10.1021/ja100922h. |
| [16] |
HENDERSON J D, FILICE F P, LI M S, et al. Tracking live cell response to cadmium (Ⅱ) concentrations by scanning electrochemical microscopy[J].
Journal of Inorganic Biochemistry, 2015, 158: 92–98. |
 2018, Vol. 9
2018, Vol. 9


