| 六水草酸镝热分解过程机理及动力学研究 |
氧化镝用作制取金属镝的原料、玻璃添加剂,还用于金属卤素灯、磁光记忆材料、钇铁或钇铝石榴石、原子能工业中.因此,氧化镝的应用范围十分广泛,应用价值也很高.制取氧化镝通常有2种方法,一种是草酸镝盐热分解制得稀土氧化物,另一种是碳酸镝盐热分解制得稀土氧化物.草酸镝盐是目前制备氧化镝,尤其是制备具有可控粒度的氧化镝常用的前驱体,它具有沉淀物晶型好,易于过滤分解等优点.因此,研究草酸镝盐的热分解动力学,对掌握草酸镝盐热分解过程的规律以及控制产物的组织形貌和粒度有着重大的意义.
热分析技术被广泛用于热分解机理研究和动力学的研究中[1-5],许多学者用此法对草酸盐的热分解过程进行了研究,如李靖华等[6]研究了草酸锰的热分解,潘云祥等[7]研究了草酸镍脱水过程的非等温动力学,邹华红等[8]研究了不同样品量、升温速度、粒径大小和反应气氛下水合草酸钙热分解差热分析数据的区别,分析这些因素对热分析数据的影响.关于稀土草酸盐水合物的热分解也有过较多研究[9-10].如倪兆艾等[11]采用程序式升温的热分析法研究稀土草酸盐的热分解机理,得出脱水峰值温度随镧系元素原子序数的增大而升高.郑晓玲等[12]用热分析技术研究了重稀土草酸盐在氢气气氛中的热分解规律,并提出了热分解机理.张克立等[13]用热分析法研究了十水草酸镧的热分解机理.顾翼东等[14]研究了Pr2(C2O4)3﹒10H2O热分解过程,得出其DTA曲线有3个峰.方正东等[15]用热重-差热分析法研究了十水草酸铈在程序升温下的热分解行为,TG曲线表明它有5个分解阶段,前3个阶段为脱水过程,后2个阶段为无水草酸铈热分解过程,最终产物为CeO2.他们都只是研究了热分解机理,而未研究热分解动力学.关于稀土草酸盐的动力学研究,胡艳宏等[16]利用DTA法研究了草酸铈前驱体的热分解动力学,詹光等[17]研究了十水草酸镧在室温至900 ℃下的热分解动力学,张湘辉等[18]研究了La2(CO3)3﹒3.4H2O在空气中热脱水的非等温动力学.在国外研究中,AYODELE B V等[19]采用热重分析法研究了轻稀土硝酸盐水合物热分解的非等温动力学及机理,分析其分解机理,得出了硝酸盐前驱体热分解的各动力学参数,KOVÁCS T N等[20]研究了2种不同的钼酸铵在惰性气体和氧气气氛下的热分解行为.但关于稀土草酸盐的许多研究都只是研究了分解机理,对动力学参数的研究较少.
为了研究草酸镝的热分解过程机理和动力学,拟用热重-差热分析法研究草酸镝在程序升温下的热分解行为,通过不同升温速率下草酸镝盐分解的TG-DTA数据对其进行动力学分析,以确定草酸镝盐分解的分解反应级数、分解活化能和分解机理,为草酸镝盐分解制备良好形貌和粒度的氧化镝提供一定的理论依据.
1 实验过程称取5 g氧化镝Dy2O3加水溶解,将12 mol/L的HCl配制成6 mol/L的HCl溶液,再称取58.006 g固体H2C2O4﹒2H2O并加水溶解配制成20 %的草酸溶液,取该溶液70 mL分别加入氧化镝Dy2O3水溶液中,置于磁力子搅拌器中,在60 ℃下持续搅拌30 min.搅拌后的溶液趁热过滤,将过滤后的滤渣置于表面皿中,放在烘干室内,100 ℃下烘干3 h.
取适量的待分析样品置于北京博渊同步热分析仪DTU-3B的坩埚,以5 ℃/min、10 ℃/min、15 ℃/min、20 ℃/min、25 ℃/min、30 ℃/min的升温速度加热样品,初始温度设定30 ℃,终止温度设定1 000 ℃.通过同步热分析仪记录热分析数据,用Origin作图软件作出不同的升温速度下的TG曲线和DTA曲线,根据不同数据处理法算出动力学参数.
2 实验数据处理方法 2.1 Kissinger法Kissinger法[21]用到以下方程:
| $\ln \left( {\frac{\beta }{{{\mathit{\Gamma }^2}}}} \right) = \ln \left( {\frac{{RA}}{{Ea}}} \right) - \frac{{Ea}}{R} \cdot \frac{1}{\mathit{\Gamma }}$ | (1) |
进行差热分析实验时,DTA会得到峰值温度T,可以计算
Ozawa法[22]由于不知道机理函数,因此只能求出化学反应的表观活化能Ea. Ozawa法的基本方程:
| $\lg \beta = \lg \left[ {\frac{{A \cdot Ea}}{{R \cdot G\left( a \right)}}} \right] - 2.315 - 0.4567\frac{{Ea}}{{RT}}$ | (2) |
如式(2),将不同升温速度下的TG曲线拟合在同一坐标系中,做1条转化率α相同的线,与每条TG线都会有1个交点,读出每个交点的温度T.再将各点的lgβ和
Crane法[23]的动力学方程为:
| $\frac{{{\rm{d}}\left( {\ln \beta } \right)}}{{{\rm{d}}\frac{1}{{{T_{\max }}}}}} = - \left( {\frac{{Ea}}{{n \cdot R}} + {T_{\max }}} \right)$ | (3) |
找出DTA曲线中在不同升温速度β下,每个峰的对应的峰值温度Tmax,求出lnβ和
Coats-Redfern法[24]是根据式(4):
| $\ln \left[ {\frac{{f\left( a \right)}}{{{\mathit{\Gamma }^2}}}} \right] = \ln \left( {\frac{{A \cdot R}}{{\beta \cdot Ea}}} \right) - \frac{{Ea}}{{R \cdot T}}$ | (4) |
把常见的机理函数代入式(4)中,将
为了研究六水草酸镝热分解的动力学参数,先对其分解机理进行分析,确定分解机理后,采用Kissinger法、Ozawa法和Crane法进一步确定热分解反应的表观活化能Ea、指前因子A和反应级数n,再根据Coats-Redfern法,确定其热分解反应的机理函数g(α).
3.1 分解机理分析为了分析草酸镝的热分解机理,需要对草酸镝TG-DTA曲线进行分析,研究DTA曲线上的吸热峰和放热峰,结合TG失重量来确定分解机理.现选取20 K/min的TG-DTA-DTG曲线进行分析如图 1所示.
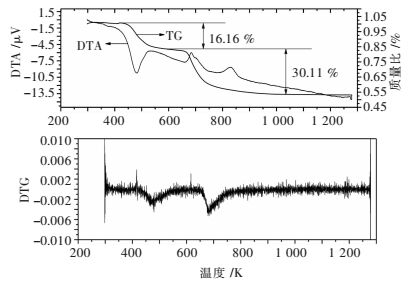 |
| 图 1 20 K/min六水草酸镝热分解TG-DTA曲线 Fig. 1 TG-DTA curves of dysprosium oxalate with six water thermal decomposition reaction in 20 K/min |
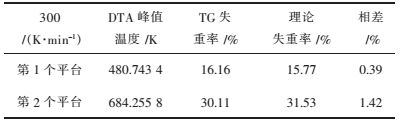
由图 1可见,TG失重线共有2个失重台阶,因此,草酸镝的热分解过程为2步分解过程.第1个失重过程的温度在450~500 K之间,在DTA曲线上是一个吸热峰,故认为它是一个失水的过程,根据TG线算出第1个台阶的失重率约为16.16 %,与失去6个水分子的理论失重率15.77 %相当,仅相差0.39 %.因此,草酸镝在这个过程中应是失去6个结晶水.对应第2个平台,DTA曲线上有一个放热峰,根据TG线得到该过程的失重率为30.11 %,与失去3个CO2分子和3个CO分子的理论失重率31.53 %相近,仅相差1.42 %. DTA最后一个放热峰应是产物的晶型转变过程,因为这时在DTG线上没有出现峰,说明此时没有发生质量变化.且样品草酸镝在505 ℃(778.16 K)和800 ℃(1 073.15 K)焙烧1 h后的XRD物相分析均为Dy2O3.(图 2和图 3所示),只是对应不同的晶型结构而已,这充分说明DTA上的第3个放热峰确实为相变过程所致.样品DTA峰值温度和TG失重率如表 1所列.通过查阅相关文献[25],重稀土草酸盐结晶水个数一般为6个,结合实验TG失重率,可以确定本实验草酸镝含6个结晶水,为六水草酸镝.
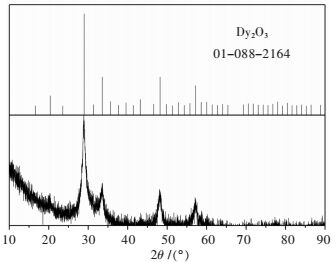 |
| 图 2 六水草酸镝热分解505 ℃产物XRD物相分析 Fig. 2 XRD pattern of the product in 505 ℃ of dysprosium oxalate with six water thermal decomposition reaction |
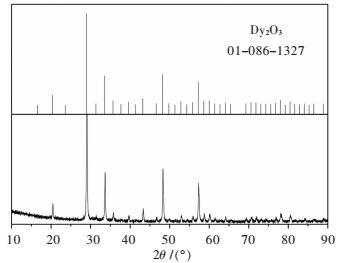 |
| 图 3 六水草酸镝热分解最终产物XRD物相分析 Fig. 3 XRD pattern of the final product of dysprosium oxalate with six water thermal decomposition reaction |
| 表 1 六水草酸镝热分解机理数据 Table 1 Data of thermal decomposition mechanism of dysprosium oxalate with six water |
 |
| 点击放大 |
根据以上分析,可以确定六水草酸镝(Dy2(C2O4)3·6H2O)热分解过程如下:
第1步:(Dy2(C2O4)3·6H2O→(Dy2(C2O4)3+6H2O↑
第2步:(Dy2(C2O4)3→Dy2O3+3CO2↑+3CO↑
为了研究草酸镝水合物在分解过程中组织形貌的演变过程,对草酸镝原样、300 ℃和800 ℃下的灼烧样进行了SEM检测,结果如图 4所示.
 |
| 图 4 草酸镝的SEM形貌 Fig. 4 SEM images of dysprosium oxalate |
由图 4可见,原样及2个灼烧温度下的试样,在相同的放大倍数下,都呈片层状,说明分解过程样品的形貌具有继承性.并且,随着温度的升高,试样的粒度明显减小,片层状更加明显.
3.2 动力学研究 3.2.1 Kissinger法分析分解活化能和指前因子为分析草酸镝的分解过程动力学,现将不同升温速度下的DTA曲线拟合在一起,得到图 5.
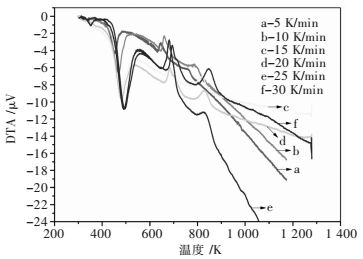 |
| 图 5 不同升温速度下六水草酸镝热分解DTA曲线 Fig. 5 DTA curves of dysprosium oxalate with six water thermal decomposition reaction at different heating rates |
由图 5可见在草酸镝的热分解过程中,DTA曲线中一共有3个峰,其中第1个峰是吸热峰,后两个峰是放热峰,但是根据前文反应机理的推断,最后一个峰为反应过程中发生的相变等过程,因此,只需分析前两个峰.
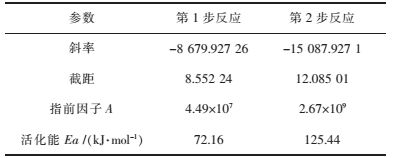
六水草酸镝热分解2步反应的DTA数据经过Kissinger法处理后,求得各个反应过程的动力学参数如表 2所列.
| 表 2 六水草酸镝热分解过程分步反应动力学参数 Table 2 Kinetic parameters of dysprosium oxalate with six water thermal decomposition reaction |
 |
| 点击放大 |
经Kissinger法处理差热分析,六水草酸镝((Dy2(C2O4)3﹒6H2O)热分解过程中发生的第1步脱水反应表观活化能Ea和指前因子A分别是72.16 kJ/mol和4.49×107,第2步分解反应表观活化能Ea和指前因子A分别是125.44 kJ/mol和2.67×109.
3.2.2 Ozawa-Flynn-Wall法分析分解活化能将不同升温速度下草酸镝热分解TG线拟合在同一个坐标系中,得到图 6,利用等转化率法对其进行分析.这6个升温速度下,草酸镝热分解过程的TG线重合性都较好,TG线上共有2个失重平台.
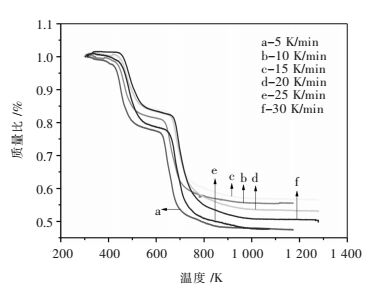 |
| 图 6 不同升温速度下六水草酸镝热分解TG曲线 Fig. 6 TG curves of dysprosium oxalate with six water thermal decomposition at different heating rates |
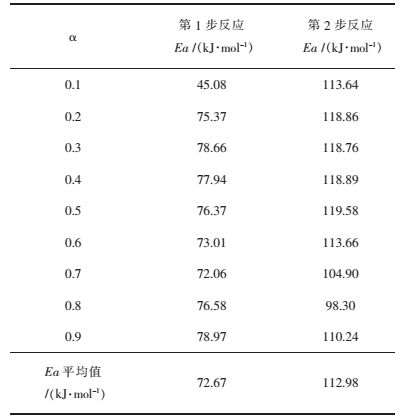
根据Ozawa法,求得2个分解反应的活化能值如表 3所列.
| 表 3 六水草酸镝热分解反应不同转化率活化能值 Table 3 Activation energy in different conversion rate of dysprosium oxalate with six water thermal decomposition reaction |
 |
| 点击放大 |
实验采用Ozawa法处理差热分析数据,六水草酸镝((Dy2(C2O4)3﹒6H2O)热分解过程中发生的第1步脱水反应表观活化能Ea是72.67 kJ/mol,第2步分解反应表观活化能Ea是112.98 kJ/mol.
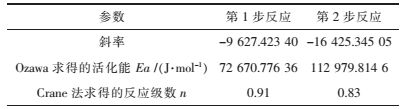
3.2.3 Crane法求分解反应级数为求分解反应的反应级数,采用Crane法进行求解.Crane法是用和Kissinger法相同的峰顶温度,把lnβ对每个峰的峰顶温度
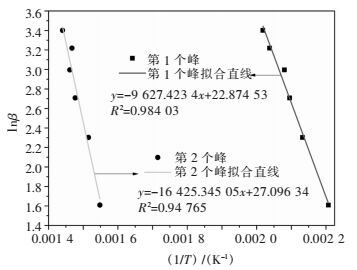 |
| 图 7 Crane法拟合曲线 Fig. 7 The graph fitted by crane method |
| 表 4 Crane法计算反应级数 Table 4 Reaction order calculated by the Crane method |
 |
| 点击放大 |
因此,采用Crane法处理六水草酸镝热分析数据,得出六水草酸镝第1步脱水反应的反应级数n为0.91,近似为1级反应,第2步分解反应的反应级数n为0.83,也近似为1级反应.
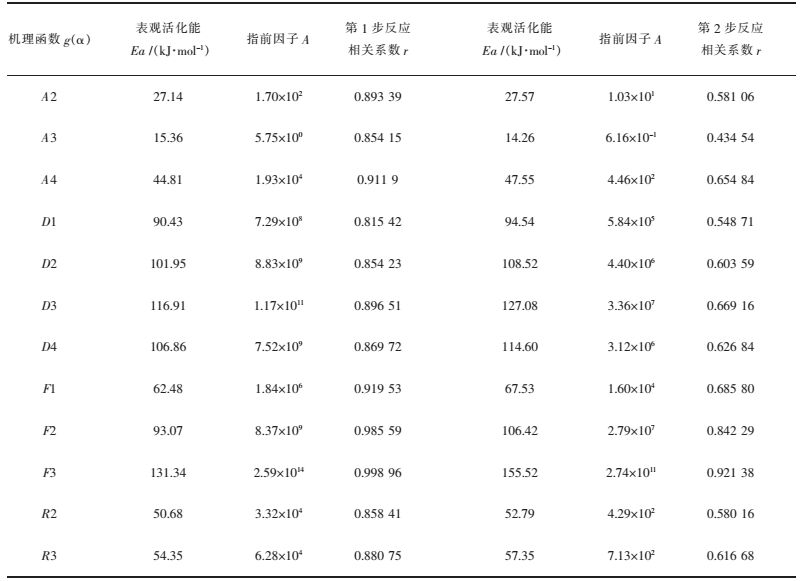
3.2.4 机理函数的确定根据Coats-Redfern法,在确定机理函数时,把12种常见的机理函数代入Coats-Redfern方程中,求出每个反应机理函数下的
将
| 表 5 六水草酸镝热分解反应数据 Table 5 Data of dysprosium oxalate with six water thermal decomposition reaction |
 |
| 点击放大 |
结合其他方法求得的活化能数据和指前因子数据,再根据求出的相关系数,找出最匹配的机理函数即为Coats-Redfern法求得的机理函数.Kissinger法求得第1步反应的表观活化能为72.16 kJ/mol,指前因子为4.49×107,与之最匹配的机理函数为F1;第2步反应的表观活化能为125.44 kJ/mol,指前因子为2.67×109,与之最匹配的机理函数为F2.所以,六水草酸镝热分解第1步反应机理函数为F1,说明反应的控制步骤为化学反应,该反应表观活化能为62.48 kJ/mol,指前因子为1.84×106;第2步反应的机理函数为F2,说明反应的控制步骤为化学反应,该反应表观活化能为106.42 kJ/mol,指前因子为2.79×107.故六水草酸镝热分解2步反应的反应机理函数分别为:
第1步:g(a)=-ln(1-a)
第2步:g(a)=(1-a)-1-1
其中,a为反应某时刻转化率.
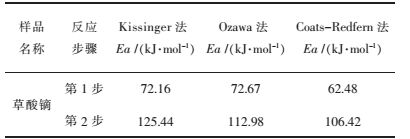
3.2.5 各方法所求活化能文中用3种方法计算了草酸镝热分解活化能,结果汇总于表 6.
| 表 6 六水草酸镝热分解反应表观活化能值 Table 6 Apparent activation energy of dysprosium oxalate with six water thermal decomposition reaction |
 |
| 点击放大 |
根据表 6可以看出3种方法计算的草酸镝热分解过程活化能值相差不大,说明计算较为合理.
3.3 结论在空气中六水草酸镝((Dy2(C2O4)3·6H2O)的热分解发生2步反应,分解过程为:
第1步:(Dy2(C2O4)3·6H2O→(Dy2(C2O4)3+6H2O↑
第2步:(Dy2(C2O4)3→Dy2O3+3CO2↑+3CO↑
第1步反应机理函数为F1,表观活化能为62.48 kJ/mol,指前因子为1.84×106;第2步反应的机理函数为F2,该反应表观活化能为106.42 kJ/mol,指前因子为2.79×107. Crane法计算得到的六水草酸镝热分解2步反应的反应级数均近似为1.
六水草酸镝热分解2步反应的反应机理函数分别为:
第1步为F1:g(a)=-ln(1-a)
第2步为F2:g(a)=(1-a)-1-1
其中,a为反应某时刻转化率.
| [1] |
BUSHUEV N N, ZININ D S. Thermal decomposition features of calcium and rare-earth oxalates[J].
Russian Journal of Inorganic Chemistry, 2016, 61(2): 161–167. DOI: 10.1134/S0036023616020030. |
| [2] |
MONTEIRO D D S, SOUZA M O D G. Thermal decomposition of precursors and iron oxide properties[J].
Journal of Thermal Analysis and Calorimetry, 2016, 123(2): 1–9. |
| [3] |
MELNIKOV P, ARKHANGELSKY I V, NASCIMENTO V A, et al. Thermolysis mechanism of samarium nitrate hexahydrate[J].
Journal of Thermal Analysis and Calorimetry, 2014, 118(3): 1537–1541. DOI: 10.1007/s10973-014-4067-x. |
| [4] |
易宇, 石靖, 郭学益. 工艺条件对硝酸银溶液雾化热分解制备超细银粉的影响[J].
有色金属科学与工程, 2015, 6(3): 6–15.
|
| [5] |
汤卫东, 朱伟伟, 姜平国, 等. CuO氯化过程动力学研究[J].
有色金属科学与工程, 2017, 8(1): 46–50.
|
| [6] |
李靖华, 张桂恩, 黄山. 草酸锰分解过程的机理函数判别和动力学研究[J].
高等学校化学学报, 1991, 11: 67–72.
|
| [7] |
潘云祥, 管翔颖, 冯增媛, 等. 一种确定固相反应机理函数的新方法-固态草酸镍(Ⅱ)二水合物脱水过程的非等温动力学[J].
无机化学学报, 1999, 15(2): 247–251.
|
| [8] |
邹华红, 胡坤, 桂柳成, 等. 一水草酸钙热重-差热综合热分析的最优化表征方法[J].
广西科学院学报, 2011, 27(1): 17–21.
|
| [9] |
FULLER M J, PINKSTONE J. Thermal analysis of the oxalate hexahydrates and decahydrates of yttrium and the lanthanide elements[J].
Journal of the Less Common Metals, 1980, 70(2): 127–142. DOI: 10.1016/0022-5088(80)90222-2. |
| [10] |
GALLAGHER P K, SCHREY F, PRESCOTT B. Thermal decomposition of europium (Ⅲ) oxalate[J].
Inorg Chem, 1970, 9(2): 215. DOI: 10.1021/ic50084a004. |
| [11] |
倪兆艾, 晁斌, 马福泰. 程序升温热分析法研究稀土草酸盐(Ⅰ)[J].
杭州大学学报, 1988, 15(4): 430–436.
|
| [12] |
郑晓玲, 倪兆艾, 晁斌. 程序升温热分析法研究稀土草酸盐(Ⅱ)[J].
福州大学学报(自然科学版), 1997, 25(5): 92–96.
|
| [13] |
张克立, 陈雄斌, 席美云, 等. 十水草酸镧的热分解机理[J].
武汉大学学报(自然科学版), 1996, 42(2): 163–166.
|
| [14] |
顾翼东, 谢高阳, 沈民. 草酸镨草酸钕及其混合物的热分解[J].
复旦大学(自然科学学报), 1996(2): 313–319.
|
| [15] |
方正东, 汪敦佳. 十水草酸铈热分解过程和非等温动力学研究[J].
稀土, 2005, 26(3): 19–22.
|
| [16] |
胡艳宏, 李梅, 柳召刚, 等. 大颗粒氧化铈的草酸盐前驱体热分解研究[J].
稀土, 2009, 30(4): 34–38.
|
| [17] |
ZHAN G, YU J X, XU Z G, et al. Kinetics of thermal decomposition of lanthanum oxalate hydrate[J].
Transactions of Nonferrous Metals Society of China, 2012, 22(4): 925–934. DOI: 10.1016/S1003-6326(11)61266-1. |
| [18] |
ZHANG X H, HE C, WANG L, et al. Non-isothermal kinetic analysis of thermal dehydration of La2(CO3)3﹒3.4H2O in air[J].
Transactions of Nonferrous Metals Society of China, 2014, 24(10): 3378–3385. DOI: 10.1016/S1003-6326(14)63480-4. |
| [19] |
AYODELE B V, HOSSAIN M A, CHONG S L, et al. Non-isothermal kinetics and mechanistic study of thermal decomposition of light rare earth metal nitrate hydrates using thermogravimetric analysis[J].
Journal of Thermal Analysis and Calorimetry, 2016, 125(1): 423–435. DOI: 10.1007/s10973-016-5450-6. |
| [20] |
KOVÁCS T N, HUNYADI D, LUCENA A L A D, et al. Thermal decomposition of ammonium molybdates[J].
Journal of Thermal Analysis and Calorimetry, 2016, 124(2): 1013–1021. DOI: 10.1007/s10973-015-5201-0. |
| [21] |
KISSINGER H E. Reaction kinetics in differential thermal analysis[J].
Analytical Chemistry, 1957, 29(11): 1702–1706. DOI: 10.1021/ac60131a045. |
| [22] |
OZAWA T. Kinetics in differential thermal analysis[J].
Bull Chem Soc Jpn, 1965, 38(11): 1881–6. DOI: 10.1246/bcsj.38.1881. |
| [23] |
BARICK A K, TRIPATHY D K. Thermal and dynamic mechanical characterization of thermoplastic polyurethane/organoclay nanocomposites prepared by melt compounding[J].
Materials Science & Engineering A, 2010, 527(3): 812–823. |
| [24] |
COATS A W, REDFERN J P. Kinetic parameters from thermogravimetric data[J].
Nature, 1964, 201(4914): 68–69. DOI: 10.1038/201068a0. |
| [25] |
吴文远.
稀土冶金学[M]. 北京: 化学工业出版社, 2005: 11-13.
|
 2017, Vol. 8
2017, Vol. 8


