| 离子型稀土矿山集液沟区域耐盐异养硝化细菌的筛选及其脱氮特征 |
2. 江西省矿冶环境污染控制重点实验室,江西 赣州 341000
2. Jiangxi Key Laboratory of Environmental Pollution Control of Mining and Metallurgy, Ganzhou 341000, China
高盐氨氮废水属于极难处理的废水之一,这些氨氮废水中含有大量的无机盐离子(Na+、Cl-、SO42-、Ca2+等离子),传统生物法在处理低盐度废水时具有很大优势,但当废水盐度浓度过高时,会抑制微生物的代谢作用,从而使微生物失去降解能力.因而,筛选耐盐菌和嗜盐菌成为了生物法处理高盐废水工艺的工作重点之一.
硝化作用是生物脱氮的关键步骤,异养硝化细菌具有生长速度快、耐高溶氧及对环境适应能力强等优点,使其在生物脱氮过程中具有重大的应用前景[1].目前报道较多的异养硝化细菌主要集中在假单胞菌属(Pseudomonas),如托拉假单胞菌(P. tolaasii)[2]、施氏假单胞菌(P. stutzeri)[3-5]、恶臭假单胞菌(P. putida)[6]、产碱假单胞菌(P. alcaligenes)[7]等,此外也有许多其他异养硝化细菌菌属的报道,如克雷白氏杆菌(Klebsiella pneumonia)[8]、脱氮副球菌(Paracoccus denitrificans)[9]、粪产碱杆菌(Alcaligenes faecalis)[10]、蜡样芽孢杆菌(Bacillus cereus)[11]等.然而,对于耐盐异养硝化细菌的相关研究报道较少.
赣州离子型稀土矿主要利用“原地浸出”工艺开采[12],由于浸矿剂选用硫酸铵溶液,灌注的硫铵液浓度至少为3 %,土壤浸液时间为150~400 d.由于在矿物中稀土与其他元素共生,其中的铝、铁、硅、钙、铅等离子在浸取时不同程度的随稀土进入浸出液,同时,还含有大量的SO42-和部分NH4+进入浸出液[13].集液沟区域土壤受到浸出液长时间浸泡、冲刷,该区域可能存在一些耐盐异养硝化细菌等微生物功能菌以应对恶化的生态环境.
本研究拟从江西赣州龙南离子型稀土矿山原地浸出集液沟区域取样分离耐盐异养硝化细菌,并考察了实际工艺中重要参数碳源、pH值和盐度对其脱氮的影响,以期为高盐含氨氮矿冶废水的生物处理工艺提供有效菌株.
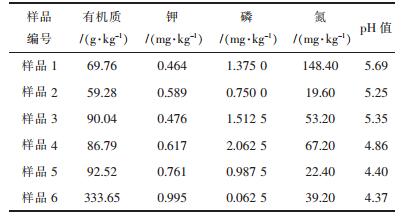
1 材料与方法 1.1 样品采集从赣州龙南县某稀土矿山“原地浸矿”工艺(浸矿剂为硫酸铵)的集液沟区域采集土壤样品,共采集了6份土壤样品,土壤样品养分含量见表 1.
| 表1 某稀土矿集液沟区域土壤样品养分含量 Table 1 Nutrient content of samples from the collecting groove region of ion-type rare earth ore |
 |
| 点击放大 |
1.2 培养基
① 异养硝化培养基:蔗糖2.4 g,(NH4)2SO4 0.5 g,维氏盐溶液50 mL,H2O 1 000 mL,pH 7.0 (若配固体培养基加2 %琼脂);② 维氏盐溶液:K2HPO4 5.0 g,MgSO4·7H2O 2.5 g,NaCl 2.5 g,FeSO4·7H2O 0.05 g,MgSO4·4H2O 0.04 g,H2O 1 000 mL;③ 富集培养基:在异养硝化培养基添加维氏盐溶液,调NaCl浓度为100 g/L.
1.3 耐盐菌株筛选称取10 g混合均匀的样品,接入装有90 mL富集培养基的250 mL三角瓶中,置于恒温气浴摇床上30 ℃、120 r/min震荡培养3 d,再转接培养3次;将富集培养液稀释涂布于异养硝化固体培养基平板上,30 ℃恒温培养3 d,分别挑取单菌落划线纯化3次,获得耐盐菌株.将经24 h活化培养的耐盐菌株分别以2 %的接种量接入异养硝化培养基中,置于恒温气浴摇床30 ℃、120 r/min震荡培养5 d,每隔12 h取样测定NH4+-N浓度,筛选出NH4+-N去除率高的耐盐菌株.
1.4 16S rDNA序列分析将菌株X1培养液离心获得的菌体送至上海生工生物工程有限公司,完成16S rDNA基因的PCR扩增、产物纯化及测序.将16S rDNA测序结果输入Genebank中进行BLASTN序列比对,下载相关菌株的16S rDNA序列,利用phylogeny.fr[14]工具构建系统发育树.
1.5 生长曲线测定将菌株X1接入异养硝化培养基中,置于恒温气浴摇床中30 ℃、120 r/min震荡培养,每隔3 h采样,在波长为600 nm下测定其吸光度,并测定NH4+-N含量,绘制生长曲线.
1.6 不同碳源的异养硝化特征以(NH4)2SO4作为唯一氮源,分别添加总碳质量浓度为1 g/L的4种碳源:酒石酸钾钠、葡萄糖、蔗糖、丁二酸钠.将菌株X1接入不同碳源的异养硝化培养基中,置于恒温气浴摇床中,30 ℃、120 r/min震荡培养,定期采样测定NH4+-N浓度.
1.7 不同初始pH值的异养硝化特征配制不同初始pH值的异养硝化培养基,初始氮质量浓度控制为0.1 g/L左右,调节其初始pH值为5.0、6.0、7.0、8.0、9.0、10.0.将菌株X1分别接入不同pH值的异养硝化培养基中,置于恒温气浴摇床中,30 ℃、120 r/min进行培养,每隔12 h取样测定NH4+-N含量.
1.8 不同盐度对NH4+-N检测方法的影响配制不同盐度的异养硝化培养基,初始碳质量浓度控制在1 g/L,初始氮质量浓度控制在0.1 g/L左右,调节异养硝化培养基初始NaCl浓度分别为2 %、4 %、6 %、8 %和10 %,不接种菌株X1,置于恒温气浴摇床中,30 ℃、120 r/min进行模拟培养,每隔5 h取样测定NH4+-N含量.
1.9 不同盐度的异养硝化特征配制不同盐度的异养硝化培养基,初始碳质量浓度控制在1 g/L,初始氮质量浓度控制在0.1 g/L左右,考虑实际工业有机废水情况,调节异养硝化培养基初始NaCl浓度分别为5 %、10 %和15 %.将菌株X1分别接入不同盐度的异养硝化培养基中,置于恒温气浴摇床中,30 ℃、120 r/min进行培养,每隔12 h取样测定NH4+-N含量.
1.10 分析方法氨氮(NH4+-N)含量测定均采用纳氏试剂光度法.
2 结果与分析 2.1 耐盐异养硝化细菌X1筛选与16S rDNA序列分析从龙南稀土矿山集液沟区域取样,经过多次富集培养及稀释分离纯化,得到7株耐盐菌株.通过摇瓶初筛,测定NH4+-N含量,计算NH4+-N去除率,结果发现,分离得到的菌株X1异养硝化能力较强,NH4+-N去除率为67.7 %,因此,研究中选用菌株X1为研究对象.菌株X1在固体平板上培养的菌落形态如图 1所示,为不规则白色颗粒状.
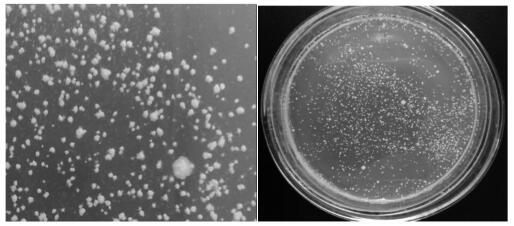 |
| 图 1 菌株X1的菌落形态 Fig. 1 Colonial morphology of strain X1 |
对分离纯化的菌株X1的16S rDNA基因进行PCR扩增测序,获得序列长度为1 399 bp.将该序列在GenBank数据库进行BLAST相似性比对,结果显示:菌株X1与多株肠杆菌属(Enterobacter)菌株的16S rDNA序列有较高的同源性,覆盖度(Query cover)和相似度(Ident)均大于98 %.选取相似度高的菌株的16S rDNA序列构建进化树(图 2),从图 2可以看出,菌株X1与Enterobacter sp. XW122同源性最高,初步确定菌株X1为肠杆菌属菌株,命名菌株X1为Enterobacter sp. X1.
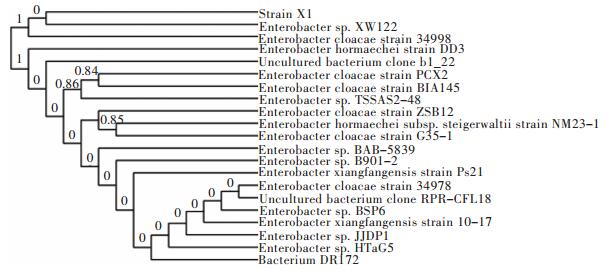 |
| 图 2 基于16S rDNA序列的菌株X1系统发育树 Fig. 2 Phylogenetic tree based on 16S rDNA sequence of strain X1 and sequences of relating species |
2.2 菌株X1生长曲线的测定
菌株X1接于异养硝化培养基后的初始阶段,由于进入新环境,细菌处于迟缓期,对环境不适应,细菌活性低,数量基本不变;在培养6 h左右后,细菌适应培养环境并开始大量繁殖,数量急剧增加,进入对数生长期;培养30 h后,细菌进入稳定期(图 3).
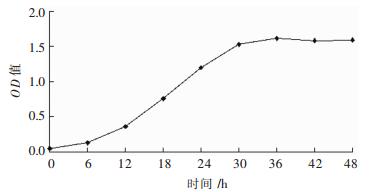 |
| 图 3 菌株X1的生长曲线 Fig. 3 Growth curve of strain X1 |
在菌株X1生长过程中,定时取样测定培养基中NH4+-N剩余含量,以此计算NH4+-N去除率,绘制得到NH4+-N去除率与培养时间的关系曲线图(图 4).由图 4可知,0~6 h内,细菌处于迟缓期,细菌活性低,NH4+-N去除率几乎为零;6~24 h内,细菌进入对数期,硝化作用不断增强,NH4+-N去除率急剧上升;24 h后,NH4+-N去除率达到60 %以上,趋于稳定.
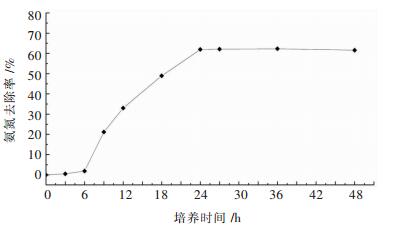 |
| 图 4 菌株X1的氨氮去除曲线 Fig. 4 Ammonia removal curve of strain X1 |
2.3 不同环境因子对菌株X1脱氮性能的影响 2.3.1 在不同碳源下菌株X1异养硝化特性
不同碳源对菌株X1异养硝化特性影响如图 5所示,在以葡萄糖和蔗糖为碳源的培养基中,菌株X1对NH4+-N去除率达到了60 %以上;在以丁二酸钠为碳源的培养基中,菌株X1对NH4+-N去除率稍低,接近40 %;在以酒石酸钾钠为碳源的培养基中,菌株X1生长缓慢,对NH4+-N去除率最低,不到10 %.考虑实际运行成本等因素,研究中选用蔗糖作为菌株X1的最佳碳源.
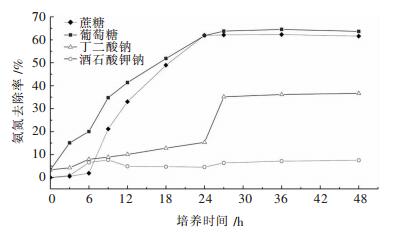 |
| 图 5 不同碳源对菌株X1的NH4+-N去除率影响 Fig. 5 ffect of carbon sources on NH4+-N removal rate for strain X1 |
2.3.2 在不同初始pH值下菌株X1异养硝化特性
菌株X1在不同初始pH值下NH4+-N去除率情况如图 6所示,初始pH值为5、6、7、8时,NH4+-N去除率介于在40 %~60 %之间,其中pH值为5的氨氮去除率最高;初始pH值为9、10时,培养基始终澄清,菌株基本不生长,NH4+-N基本不降解.由此可知菌株X1在pH值在5~8的环境中可以生长并去除氨氮,在偏酸性的环境中生长情况和氨氮去除情况更好.传统自养型硝化细菌在脱氮过程中产酸使pH值降低,在pH值5.0~5.5就不能进行硝化反应,因而菌株X1可以弥补这个缺陷.
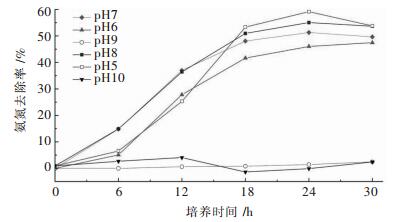 |
| 图 6 不同初始pH值下对菌株X1的NH4+-N去除率的影响 Fig. 6 Effect of pH on NH4+-N removal rate for strain X1 |
2.3.3 不同盐度对NH4+-N检测方法的影响
氨氮(NH4+-N)含量测定均采用纳氏试剂光度法,对高盐含氨氮的水样进行检测时,需要考虑水样含盐量对氨氮测定结果的影响.研究中对不同盐度(2 %、4 %、6 %、8 %和10 %)对NH4+-N检测方法的影响进行了试验,结果如表 2所示.利用origin 9.0软件进行pair-sample t-test分析,发现各个盐度(两两比较)对NH4+-N检测的结果均没有显著性差异,表明不同盐度对NH4+-N检测方法没有显著性影响.
| 表2 不同盐度对NH4+-N检测方法的影响 Table 2 Effect of salinity on NH4+-N detection method |
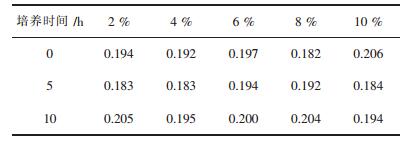 |
| 点击放大 |
2.3.4 在不同盐度下菌株X1异养硝化特性
在不同盐浓度培养基中,菌株X1对NH4+-N去除率影响情况如图 7所示.由图 7可知,菌株X1具有较强的耐盐性能,培养基盐浓度不超过10 %时,菌株X1对NH4+-N的去除率较高,达到40 %以上;培养基盐浓度在10 %~15 %范围内,菌株X1对NH4+-N的去除率下降.
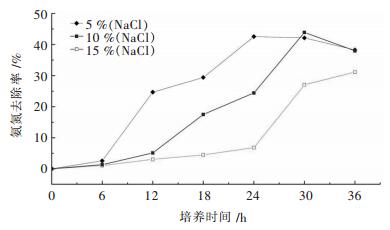 |
| 图 7 同盐浓度下菌株X1的NH4+-N去除率 Fig. 7 Effect of the salinity on NH4+-N removal rate for strain X1 |
3 讨论
异养硝化细菌来源广泛,对环境适应性强.近年来,国内外研究者从各种环境中分离出多株具有异养硝化功能的微生物,这些微生物不仅可以高效去除COD和氨氮,多数还具有好氧反硝化功能.如:从垃圾渗滤液分离到的异养硝化细菌Zobellella taiwanensis DN-7[15],从水产品养殖池塘中分离到的异养硝化细菌Pseudomonas sp.和Acinetobacter baumannii[16],从厌氧消化污泥中分离到的异养硝化细菌Alcaligenes faecalis strain No. 4[17],从屠宰场废水中分离到的具有同步异养硝化和好氧反硝化细菌Chryseobacterium sp. R31[18].研究中从离子型稀土矿集液沟区域土壤环境中分离得到一株异养硝化能力较强的菌株X1,经16S rDNA测序分析,初步确定菌株X1为肠杆菌属菌株,命名为Enterobacter sp. X1.这是首次报道从离子型稀土矿山区域分离到异养硝化细菌.
异养硝化细菌的耐盐性能在高盐废水生物处理工艺中起着至关重要的作用.根据耐盐程度不同,可将微生物分为四类:非嗜盐菌(生长环境盐度小于1 %)、弱嗜盐菌(生长环境盐度为2 %~5 %)、中度嗜盐菌(生长环境盐度为3 %~15 %)及极端嗜盐菌(生长环境盐度为15 %~30 %)[19].近年来,已有较多耐盐异养硝化细菌的相关报道,如:异养硝化细菌Pseudomonas sp. ADN-42在NaCl浓度为40 g/L(盐度为4 %)的环境中脱氮能力为6.52 mg/L· h[20],异养硝化细菌Vibrio diabolicus SF16的生长环境适宜盐度为1-5 %[21].然而,国内外关于肠杆菌属耐盐菌株报道较少,如:Enterobacter sp. strain N18[22]、Enterobacter sp. EJ01[23]等肠杆菌属菌株均具有耐盐特性.研究中分离到的Enterobacter sp. X1耐盐范围较宽,在NaCl浓度小于150 g/L(盐度为15 %)环境中具有较好的脱氮性能.
影响异养硝化细菌生长硝化的主要因素有:有机碳源类型、底物浓度(碳源、氮源)、C/N、pH、温度、溶解氧浓度和抑制剂等[24].有机碳源的类型及浓度对异养硝化活性起着关键作用,刘杰凤等[25]分离的异养硝化细菌粘质沙雷氏菌(Serratia marcescens N-2) 可以利用多种碳源生长,最适生长碳源为蔗糖;王弘宇等[26]分离的2株异养硝化细菌ZW2和ZW5的合适碳源均为丁二酸钠.研究中分离到的耐盐异养硝化细菌Enterobacter sp. X1在以葡萄糖和蔗糖为碳源的培养基中脱氮性能较好.相对于自养硝化细菌,异养硝化细菌所能耐受的pH范围更广.研究中分离到的Enterobacter sp. X1菌株在pH值为5~8的环境中均可生长并去除氨氮,在偏酸性的环境中生长和氨氮去除情况更好,因而,该菌株更适合应用于酸性高盐矿冶废水的生物处理工艺.
与传统自养硝化作用不同,异养硝化作用的底物可以是无机态氮或有机态氮.异养硝化菌可利用氨单加氧酶将氨氮氧化为羟胺,羟胺可在一类异养硝化菌特有的不含血红素的羟胺氧化酶的作用下转化为亚硝酸盐或N2O.在好氧情况下,异养的羟胺氧化酶可将羟胺转化为亚硝酸盐及少量N2O;在厌氧或微好氧情况下将羟胺转化为N2O[27-29].氨单加氧酶和羟胺氧化酶是异养硝化菌代谢过程中的关键酶,与之相对应的是amo和hao基因.研究中分离的Enterobacter sp. X1异养硝化菌株是否存在这样的氨氮去除机理,仍需从分子生物学角度进一步探讨.
4 结论1) 从龙南离子型稀土矿山集液沟区域采样,通过富集培养,筛选出一株具有较强耐盐异养硝化特性的菌株X1,经16S rDNA序列分析,初步确定菌株X1为肠杆菌属菌株,命名为Enterobacter sp. X1.
2) 菌株X1适宜的脱氮条件为:以蔗糖作为碳源,pH值为5,盐度≤15 %.菌株X1的NH4+-N去除率可达到60 %以上.
3) 菌株X1具有生物强化低pH的高盐含氨氮矿冶废水生物处理工艺的潜力.
| [1] |
ROBERTSON L A, VAN NIEL E W, TORREMANS R A, et al. Simultaneous nitrification and denitrification in aerobic chemostat Cultures of Thiosphaera pantotropha[J].
Appl Environ Microbiol, 1988, 54(11): 2812–2818. |
| [2] |
HE T, LI Z, SUN Q, et al. Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11 without nitrite accumulation during nitrogen conversion[J].
Bioresour Technol, 2016, 200(1): 493–499. |
| [3] |
JI B, YANG K, WANG H, et al. Aerobic denitrification by Pseudomonas stutzeri C3 incapable of heterotrophic nitrification[J].
Bioprocess Biosyst Eng, 2015, 38(2): 407–409. DOI: 10.1007/s00449-014-1271-9. |
| [4] |
LI C, YANG J, WANG X, et al. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a phosphate accumulating bacterium Pseudomonas stutzeri YG-24[J].
Bioresour Technol, 2015, 182: 18–25. DOI: 10.1016/j.biortech.2015.01.100. |
| [5] |
SUN Y, LI A, ZHANG X, et al. Regulation of dissolved oxygen from accumulated nitrite during the heterotrophic nitrification and aerobic denitrification of Pseudomonas stutzeri T13[J].
Appl Microbiol Biotechnol, 2015, 99(7): 3243–3248. DOI: 10.1007/s00253-014-6221-6. |
| [6] |
DAUM M, ZIMMER W, PAPEN H, et al. Physiological and molecular biological characterization of ammonia oxidation of the heterotrophic nitrifier Pseudomonas putida[J].
Curr Microbiol, 1998, 37(4): 281–288. DOI: 10.1007/s002849900379. |
| [7] |
SU J J, YEH K S, TSENG P W, et al. A strain of Pseudomonas sp. isolated from piggery wastewater treatment systems with heterotrophic nitrification capability in Taiwan[J].
Curr Microbiol, 2006, 53(1): 77–81. DOI: 10.1007/s00284-006-0021-x. |
| [8] |
PAL R R, KHARDENAVIS A A, PUROHIT H J. Identification and monitoring of nitrification and denitrification genes in Klebsiella pneumoniae EGD-HP19-C for its ability to perform heterotrophic nitrification and aerobic denitrification[J].
Funct Integr Genomics, 2015, 15(1): 63–76. DOI: 10.1007/s10142-014-0406-z. |
| [9] |
MOIR J W, CROSSMAN L C, SPIRO S, et al. The purification of ammonia monooxygenase from Paracoccus denitrificans[J].
FEBS Lett, 1996, 387(1): 71–74. DOI: 10.1016/0014-5793(96)00463-2. |
| [10] |
JOO H S, HIRAI M, SHODA M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4[J].
J Biosci Bioeng, 2005, 100(2): 184–191. DOI: 10.1263/jbb.100.184. |
| [11] |
KIM J K, PARK K J, CHO K S, et al. Aerobic nitrification-denitrification by heterotrophic Bacillus strains[J].
Bioresour Technol, 2005, 96(17): 1897–906. DOI: 10.1016/j.biortech.2005.01.040. |
| [12] | 李春. 原地浸矿新工艺在离子型稀土矿的推广应用[J]. 有色金属科学与工程, 2011, 2(1): 63–67. |
| [13] | 邱廷省, 伍红强, 方夕辉, 等. 风化壳淋积型稀土矿提取除杂技术现状及进展[J]. 稀土, 2012, 33(4): 81–85. |
| [14] |
DEREEPER A, GUIGNON V, BLANC G, et al. Phylogeny.fr: robust phylogenetic analysis for the non-specialist[J].
Nucleic Acids Res, 2008, 36: 465–469. DOI: 10.1093/nar/gkn180. |
| [15] |
LEI Y, WANG Y, LIU H, et al. A novel heterotrophic nitrifying and aerobic denitrifying bacterium, Zobellella taiwanensis DN-7, can remove high-strength ammonium[J].
Appl Microbiol Biotechnol, 2016, 100(9): 4219–4229. DOI: 10.1007/s00253-016-7290-5. |
| [16] |
FAN L, CHEN J, LIU Q, et al. Exploration of three heterotrophic nitrifying strains from a tilapia pond for their characteristics of inorganic nitrogen use and application in aquaculture water[J].
Journal of Biosci Bioeng, 2015, 119(3): 303–309. DOI: 10.1016/j.jbiosc.2014.09.006. |
| [17] |
SHODA M, ISHIKAWA Y. Heterotrophic nitrification and aerobic denitrification of high-strength ammonium in anaerobically digested sludge by Alcaligenes faecalis strain No. 4[J].
Journal of Biosci Bioeng, 2014, 117(6): 737–741. DOI: 10.1016/j.jbiosc.2013.11.018. |
| [18] |
KUNDU P, PRAMANIK A, DASGUPTA A, et al. multaneous heterotrophic nitrification and aerobic denitrification by Chryseobacterium sp. R31 isolated from abattoir wastewater[J].
Biomed Res Int, 2014, ID, 436056: 1–12. |
| [19] | KUSHNER D J. Life in high salt and solute concentrations, in Microbial Life in Extreme Environments[M]. London: Academic Press, 1978. |
| [20] |
JIN R, LIU T, LIU G, et al. Simultaneous heterotrophic nitrification and aerobic denitrification by the marine origin bacterium Pseudomonas sp. ADN-42[J].
Appl Biochem Biotechnol, 2015, 175(4): 2000–2011. DOI: 10.1007/s12010-014-1406-0. |
| [21] |
DUAN J, FANG H, SU B, et al. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater[J].
Bioresour Technol, 2015, 179: 421–428. DOI: 10.1016/j.biortech.2014.12.057. |
| [22] |
YOU J, LIU J F, YANG S, et al. Low-temperature-active and salt-tolerant beta-mannanase from a newly isolated Enterobacter sp. strain N18[J].
Journal of Biosci Bioeng, 2016, 121(2): 140–146. DOI: 10.1016/j.jbiosc.2015.06.001. |
| [23] |
KIM K, JANG Y J, LEE S M, et al. Alleviation of salt stress by enterobacter sp. EJ01 in tomato and Arabidopsis is accompanied by up-regulation of conserved salinity responsive factors in plants[J].
Mol Cells, 2014, 37(2): 109–117. DOI: 10.14348/molcells.2014.2239. |
| [24] | 苟莎, 黄钧. 异养硝化细菌脱氮特性及研究进展[J]. 微生物学通报, 2009(2): 255–260. |
| [25] | 刘杰凤, 周天, 刘正辉, 等. 一株新型异养硝化细菌的分离鉴定及硝化特性[J]. 环境科学与技术, 2014, 37(8): 99–103. |
| [26] | 王弘宇, 马放, 杨开, 等. 两株异养硝化细菌的氨氮去除特性[J]. 中国环境科学, 2009, 29(1): 47–52. |
| [27] |
RICHARDSON D J, WEHRFRITZ J M, KEECH A, et al. The diversity of redox proteins involved in bacterial heterotrophic nitrification and aerobic denitrification[J].
Biochem Soc Trans, 1998, 26(3): p. 401–408. DOI: 10.1042/bst0260401. |
| [28] | 金敏, 王景峰, 庆鑫, 等. 好氧异养硝化菌Acinetobacter sp. YY-5的分离鉴定及脱氮机理[J]. 应用与环境生物学报, 2009, 15(5): 692–697. |
| [29] | 何霞, 吕剑, 何义亮, 等. 异养硝化机理的研究进展[J]. 微生物学报, 2006, 46(5): 844–847. |
 2017, Vol. 8
2017, Vol. 8

