| 风化壳淋积稀土矿浸取动力学基础理论研究 |
b. 江西理工大学, 资源与环境工程学院,江西 赣州 341000
b. School of Resources and Environmental Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China
风化壳淋积型稀土矿(俗称离子吸附型稀土,简称离子型稀土)是我国特有、世界罕见的矿产资源,含有丰富的中重稀土,主要分布在江西、福建、广东、湖南、广西、云南、浙江等南方七省区[1-3].在该类矿床中,稀土以水合阳离子或羟基水合离子吸附在黏土矿物上,无法用常规的采选方法富集稀土,国际上亦没有同类矿物采选的理论和技术可以借鉴[4-6].经过我国科技工作者40多年的攻关与发展,建立了用盐类溶浸液通过离子交换反应浸取稀土的方法[7-9],形成了以原地浸取为代表的风化壳淋积型稀土提取工艺,推动了整个稀土采选学科的发展[10].原地浸矿过程是一个集采矿、选矿、冶金于一体的综合过程,实际生产中的浸取效率通常与浸取动力学条件、热力学条件、化学反应速度、扩散速度等息息相关.因此研究浸出过程动力学对提高稀土浸矿效率具有重要意义.
关于浸取动力学模型有多种,大部分是基于矿物溶解浸取过程而提出的[11],例如A F Lewis和P R Taylor提出的基于实测化学反应速率常数和扩散控制机理的动力学模型;R W Bartlett提出的将连续方程应用于浸出含黄铜矿的动力学模型;R L Braun等根据矿石的浸出原理提出的“反应区域模型”.许多学者对于不同矿物的浸取动力学进行了研究,方兆珩等[12]对含铜硫化金精矿中氰化浸取金和银的动力学进行了试验研究;欧腾蛟等[13]系统地研究了菱镁矿的煅烧条件以及煅烧粉在氯化铵乙二醇溶液中的浸取动力学;吴一峰等[14]研究了铝土矿渣与硫酸反应动力学.田君等[15-16]研究了风化壳淋积型稀土矿浸取动力学,将风化壳淋积型稀土矿整个浸取过程分为五个步骤,通过动力学实验建立浸取动力学方程,得到了表观活化能,求得动力学控速步骤[17-18],笔者在风化壳淋积稀土矿浸取动力学基础理论研究上,提出了强化稀土浸出过程的建议与方法.
2 浸取动力学分析 2.1 浸取化学反应过程风化壳淋积型稀土矿床的主要矿物有高岭土、白云母、石英和钾长石等,原矿的化学成分以SiO2为主,约占70 %;其次是Al2O3,约占15 %;再次是K2O、Fe2O3、CaO、MgO以及少量其他元素,其中高岭土、白云母等黏土矿物是天然的离子交换剂[19].风化壳淋积型稀土矿是黏土类矿物,黏土矿是稀土的负载相,矿中稀土元素约80 %是以离子相存在,主要吸附于高岭土和白云母等铝硅酸盐矿物中,稀土在这二者中的分配比为20:1.
风化壳淋积型稀土浸出过程属于多相反应过程,以高岭土为例,用硫酸铵作为浸矿剂,其离子交换过程是液固相之间的反应[15-16]:
| $ \begin{align} &\left[\rm{Al2Si2O5}\left( \rm{OH} \right)4 \right]_\rm{m}\cdot {{\text{nRE}}^{\text{3+}}}_{(\text{s})}\rm{+3nNH}_{4}^{\rm{+}}\rm{(aq)}\rightleftharpoons \\ &{{\left[\rm{Al2Si2O5}\left( \rm{OH} \right)4 \right]}_{\rm{m}}}\cdot \text{3n}{{(\text{NH}_{\text{4}}^{\text{+}})}_{(\text{s})}}+\text{nRE}_{_{{}}}^{\rm{3+}}\rm{(aq)} \\ \end{align} $ |
其中:s表示固相,aq表示液相.
由于风化壳淋积型稀土矿由颗粒状黏土组成,黏土矿物颗粒可以看成是一个球形粒子,相关研究表明[20],球形矿粒浸取过程的液-固相反应过程模型可用“收缩未反应芯模型”表示,如图 1所示.其中a为未反应的风化壳淋积型稀土矿粒核;b为离子交换反应生成的固体膜或反应生成物;c为浸取剂(NH4+)的扩散层;浸取剂(NH4+)在水溶液中的浓度为C0;浸取剂(NH4+)在固体表面处的浓度为Cs;浸取剂(NH4+)在反应区的浓度为Cs’;d1为浸取剂(NH4+)在扩散层厚度;d2为固膜厚度.扩散层的厚度随浸矿的溶质种类、溶液粘度、搅拌强度的改变而不同.
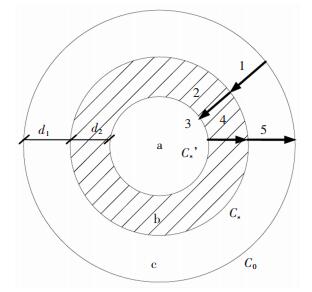 |
| 图 1 风化壳淋积型稀土浸取过程示意 Fig. 1 Illustrative diagram of leaching process |
从图 1可知,风化壳淋积型稀土整个浸取过程可以分为以下5个步骤:
步骤1.外扩散.浸取剂从水溶液中扩散到矿物颗粒表面,即通过包围在矿粒表面的液-固界面膜,到达矿粒表面.
步骤2.内扩散.通过固体膜在黏土颗粒内扩散,即达到矿物颗粒表面的浸取剂离子进一步扩散,进入矿物的交联网孔内.
步骤3.化学反应.浸取剂与矿物颗粒发生化学反应,生成的不溶产物附着在矿物颗粒表面,使固体膜增厚,反应时亦可能包括有吸附或解吸.
步骤4.内扩散.被交换下来的可溶性稀土离子(RE3+)通过固体膜,扩散到膜表面.
步骤5.外扩散.可溶性稀土离子(RE3+)继续扩散,经过黏土矿物表面进入溶液中,稀土离子浸取过程完成.
2.2 速度方程以高岭土为例,研究各步骤的速度方程及总浸出速度.在稀土发生离子交换反应时,各物质按照高岭土与硫酸铵的化学方程式的化学比例进行,由此可以计算得出它们之间定量关系.为简便计算,定义速度单位为单位时间、单位面积上消耗的浸取剂的摩尔数.
步骤1.根据Fick第一定律,得到步骤1的速度公式为:
| $ {{v}_{1}}=\frac{{{D}_{1}}({{C}_{0}}-{{C}_{s}})}{{{d}_{1}}} $ | (1) |
式(1) 中:D1为浸取剂在水溶液中的扩散系数;
式(1) 可以改写成:
| $ {{C}_{0}}-{{C}_{s}}=\frac{{{v}_{1}}\cdot {{d}_{1}}}{{{D}_{1}}} $ | (2) |
步骤2.根据Fick第一定律,得到步骤2的速度公式为:
| $ {{v}_{2}}=\frac{{{D}_{2}}({{C}_{s}}-{{C}_{s}}^{\prime })}{{{d}_{2}}} $ | (3) |
式(3) 中:D2为浸取剂在固膜中的扩散系数.
式(3) 可以改写成:
| $ {{C}_{\rm s}}-{{C}_{s}}^{\prime }=\frac{{{v}_{2}}\cdot {{d}_{2}}}{{{D}_{2}}} $ | (4) |
步骤3.设正、逆反应速度只与反应物浓度的一次方成正比,即它们都是一级反应,离子交换反应速度为正、逆反应速度之差,则步骤3的速度公式为:
| $ {{v}_{3}}={{k}_{+}}{{C}_{s}}^{\prime }-{{k}_{-}}{{C}_{s}}{{({\rm{R}}{{\rm{E}}^{3+}})}^{\prime }} $ | (5) |
式(5) 中:Cs(RE3+)′为可溶性稀土生成物在反应区的浓度.
式(5) 可以改写成:
| $ {{C}_{s}}^{\prime }-\frac{{{k}_{-}}}{{{k}_{+}}}{{C}_{s}}{{({\rm{R}}{{\rm{E}}^{3+}})}^{\prime }}=\frac{{{v}_{3}}}{{{k}_{+}}} $ | (6) |
步骤4.可溶性稀土生成物通过固膜的速度公式为:
| $ {{v}_{4}}({\rm{R}}{{\rm{E}}^{3+}})=\frac{{{D}_{2}}^{\prime }[{{C}_{s}}{{({\rm{R}}{{\rm{E}}^{3+}})}^{\prime }}-{{C}_{s}}({\rm{R}}{{\rm{E}}^{3+}})]}{{{d}_{2}}} $ | (7) |
式(7) 中:D2′为可溶性稀土生成物在固膜内的扩散系数,Cs(RE3+)为可溶性稀土生成物在矿粒表面的浓度.
从高岭土与硫酸铵的化学反应式可知,生成1 mol的可溶性稀土生成物RE3+(aq),需要消耗3 mol的浸取剂(NH4+)(aq),故按浸取剂摩尔数计算的速度为:
| $ {{v}_{4}}=\frac{3{{D}_{2}}^{\prime }[{{C}_{s}}{{({\rm{R}}{{\rm{E}}^{3+}})}^{\prime }}-{{C}_{s}}({\rm{R}}{{\rm{E}}^{3+}})]}{{{d}_{2}}} $ | (8) |
式(8) 可以改写成:
| $ \frac{{{k}_{-}}}{{{k}_{+}}}[{{C}_{s}}{{({\rm{R}}{{\rm{E}}^{3+}})}^{\prime }}-{{C}_{s}}({\rm{R}}{{\rm{E}}^{3+}})]=\frac{{{k}_{-}}}{{{k}_{+}}}\cdot \frac{{{v}_{4}}{{d}_{2}}}{3{{D}_{2}}^{\prime }} $ | (9) |
步骤5.按照步骤4的分析,同理可得:
| $ {{v}_{5}}=\frac{3{{D}_{1}}^{\prime }[{{C}_{s}}({\rm{R}}{{\rm{E}}^{3+}})-{{C}_{0}}({\rm{R}}{{\rm{E}}^{3+}})]}{{{d}_{1}}^{\prime }} $ | (10) |
式(10) 中:D1′为可溶性稀土生成物在水中的扩散系数,C0(RE3+)为可溶性稀土生成物在水中的浓度,d1′为可溶性生成物的扩散层厚度.
式(10) 可以改写成:
| $ \frac{{{k}_{-}}}{{{k}_{+}}}[{{C}_{s}}{{({\rm{R}}{{\rm{E}}^{3+}})}^{\prime }}-{{C}_{0}}({\rm{R}}{{\rm{E}}^{3+}})]=\frac{{{k}_{-}}}{{{k}_{+}}}\cdot \frac{{{v}_{5}}{{d}_{1}}^{\prime }}{3{{D}_{1}}^{\prime }} $ | (11) |
将式(2)、式(4)、式(6)、式(9)、式(11) 相加,因为各步骤连续进行,在稳定条件下,可以认为各步骤的速度相等,且等于总速度v0,则:
| $ {{v}_{0}}=\frac{{{C}_{0}}-{{C}_{0}}({\rm{R}}{{\rm{E}}^{3+}})\cdot (\frac{{{k}_{-}}}{{{k}_{+}}})}{\frac{{{d}_{1}}}{{{D}_{1}}}+\frac{{{d}_{2}}}{{{D}_{2}}}+\frac{1}{{{k}_{+}}}+\frac{{{k}_{-}}}{3{{k}_{+}}}(\frac{{{d}_{2}}}{{{D}_{2}}^{\prime }}+\frac{{{d}_{1}}^{\prime }}{{{D}_{1}}^{\prime }})} $ | (12) |
分析可知,浸出总速度与式(12) 的分母项成反比,可以把分母项看成反应的总阻力.显然,总阻力包括了4部分:
(a) 外扩散阻力项:d1/D1;
(b) 内扩散阻力项:d2/D2;
(c) 离子交换反应阻力项:1/k+;
(d) 反应生成物向外扩散阻力项:
由于风化壳淋积型稀土与浸取剂发生化学反应的平衡常数较大,即k+≫k-时,离子交换基本上朝着正方向反应,式(12) 可以简化为:
| $ {{v}_{0}}=\frac{{{C}_{0}}}{\frac{{{d}_{1}}}{{{D}_{1}}}+\frac{{{d}_{2}}}{{{D}_{2}}}+\frac{1}{{{k}_{+}}}} $ | (13) |
由式(13) 可以看出,反应速度主要取决(a)、(b)和(c)3部分,(d)可以忽略不计.
浸出速度决定于上述最慢的步骤,例如当内扩散步骤最慢,以至于内扩散阻力远大于外扩散阻力及离子交换反应阻力即:
| $ \frac{{{d}_{2}}}{{{D}_{2}}}\gg \frac{{{d}_{1}}}{{{D}_{1}}}, \frac{{{d}_{2}}}{{{D}_{2}}}\gg \frac{1}{{{k}_{\rm{+}}}} $ |
此时,有:
| $ {{v}_{0}}=\frac{{{C}_{0}}}{\frac{{{d}_{2}}}{{{D}_{2}}}}=\frac{{{C}_{0}}{{D}_{2}}}{{{d}_{2}}} $ | (14) |
即浸取过程的总速度决定于内扩散步骤,内扩散步骤成为控制性步骤,或称为内扩散控制.同理,可以类推外扩散控制和化学反应控制.若其中两个步骤的阻力大致相同,且远大于第3个步骤,则称为混合控制[21].
由式(13) 可以看出,浸出过程的速度总是和浸取剂的浓度C0成正比.另外,矿物浸出过程的控制步骤不一定是恒定不变的,有时会随着温度、pH值等条件的改变而变化.
2.3 速率控制步骤 2.3.1 化学反应控制设浸取过程受化学反应控制,即浸取过程中通过扩散层及固膜的扩散阻力很小,讨论浸出分数与时间的关系.
对于一级反应而言,有:
| $ \frac{-{\rm{d}}N}{-{\rm{d}}t}=kSC $ | (15) |
式(15) 中:N为稀土矿在t时刻的摩尔数,S为矿物颗粒的表面积,C为浸出剂的浓度,k为化学反应速度常数.
在化学反应中,反应速度随矿物颗粒的表面积S的改变而改变.设矿粒为球形且致密无孔隙,则有:
| $ S=4\pi {{r}^{2}} $ | (16) |
式(16) 中:r为矿粒半径,ρ为矿粒密度,M为矿物的摩尔质量.
| $ N=\frac{\frac{4}{3}\pi {{r}^{3}}\rho }{M} $ | (17) |
把式(16)、式(17) 代入式(15),可得:
| $ \frac{4\pi {{r}^{2}}\rho }{M}\cdot \frac{{\rm{d}}r}{{\rm{d}}t}=4\pi {{r}^{2}}kC $ | (18) |
假设浸取过程中,浸取剂充足,其浓度C保持为恒定值C0,则有:
| $ -\int_{{{r}_{0}}}^{r}{{\rm{d}}r}=\frac{k{{C}_{0}}M}{\rho }\int_{0}^{t}{{\rm{d}}t} $ | (19) |
对式(19) 积分,可得:
| $ {{r}_{0}}-r=\frac{k{{C}_{0}}M}{\rho }t $ | (20) |
式(20) 中:r0为矿物颗粒的初始半径,r为矿物颗粒在t时刻的半径.
一般来说,矿粒半径不易测得,因此常采用矿物浸取率α与时间t的关系表示浸取动力学方程式,其关系如下:
| $ \alpha =\frac{{{N}_{0}}-N}{N}=\frac{\frac{4\pi {{r}_{0}}^{3}\rho }{3M}-\frac{4\pi {{r}^{3}}\rho }{3M}}{\frac{4\pi {{r}_{0}}^{3}\rho }{3M}}=1-\frac{{{r}_{0}}^{3}}{{{r}^{3}}} $ | (21) |
式(21) 中:N0为开始时精矿的摩尔数.
整理式(21),可得:
| $ r={{r}_{0}}{{(1-\alpha )}^{\frac{1}{3}}} $ | (22) |
把式(22) 代入式(20),可得:
| $ {{r}_{0}}-{{r}_{0}}{{(1-\alpha )}^{\frac{1}{3}}}=\frac{k{{C}_{0}}M}{\rho }t $ | (23) |
整理,可得:
| $ 1-{{(1-\alpha )}^{\frac{1}{3}}}=\frac{k{{C}_{0}}M}{\rho {{r}_{0}}}t $ | (24) |
当浓度C0保持不变时,式(24) 可以改写成:
| $ 1-{{(1-\alpha )}^{\frac{1}{3}}}={{k}_{1}}t $ | (25) |
式(25) 中:k1=kC0M/ρr0.
化学反应控制时,提高浸取率的途径主要有:
1) 提高温度T,因为α随速度常数k的增加而提高,根据Arrhenius方程,温度升高,k值相应增大;
2) 提高浸取剂浓度C0;
3) 减小矿物颗粒反应前的原始半径.
2.3.2 外扩散控制设浸取过程受外扩散控制,则矿物浸取总的速度取决于浸取剂通过扩散层的扩散,又因为外扩散控制时Cs=0,得到单位时间通过扩散层的浸取剂摩尔数为:
| $ J={{V}_{1}}S=\frac{{{C}_{0}}{{D}_{1}}S}{{{d}_{1}}} $ | (26) |
稀土在发生离子交换反应后时,通过扩散层的浸取剂(NH4+)(aq)摩尔数J与反应的稀土矿物(RE3+) (aq)的摩尔数成正比,比例系数是3,则单位时间内浸出稀土矿物摩尔数为:
| $ \frac{-{\rm{d}}N}{{\rm{d}}t}=\frac{{{C}_{0}}{{D}_{1}}S}{3{{d}_{1}}} $ | (27) |
当浸取过程生成固体膜,且矿粒总尺寸不变时,S为常数,此时-dN/dt=常数,即浸取速度与时间无关,浸出率与时间成正比.
当浸出过程不生成固体膜,则S为未反应核的表面积.随着反应进行,未反应核不断减小,S随之减小.参照式(16)~式(26) 的推导过程,可以得出外扩散控制的动力学方程为:
| $ 1-{{(1-\alpha )}^{\frac{1}{3}}}=\frac{{{D}_{1}}{{C}_{0}}M}{3{{d}_{1}}\rho {{r}_{0}}}={{k}_{2}}t $ | (28) |
外扩散控制时,提高浸取率的途径主要有:
1) 提高温度,因为扩散系数D1随温度的升高而增大,所以相应地提高温度亦能加快外扩散的速度,提高浸取率;
2) 提高浸取剂浓度C0;
3) 减小扩散层厚度d1.
2.3.3 内扩散控制在化学反应过程中,如果生成固体产物,则在局部反应后的矿物颗粒表面将形成固态膜,若此固体膜很致密,则其对浸取剂的扩散阻力将远大于外扩散和化学反应阻力,则此时属于内扩散控制.
设t时刻内扩散穿过固体膜的浸取剂摩尔数为J,则有:
| $ J={{v}_{2}}S=S{{D}_{2}}\frac{{\rm{d}}C}{{\rm{d}}r}=4\pi {{r}^{2}}{{D}_{2}}\frac{{\rm{d}}C}{{\rm{d}}r} $ | (29) |
设反应后矿物颗粒的大小不变,其半径保持r0,则有:
| $ \int_{{{C}_{\rm{s}}}^{\prime }}^{{{C}_{\rm{s}}}}{dC}=\frac{J}{4\pi {{D}_{2}}}\int_{{{r}_{1}}}^{{{r}_{0}}}{\frac{{\rm{d}}r}{{{r}^{2}}}} $ | (30) |
对式(30) 积分,可得:
| $ {{C}_{\rm{s}}}-{{C}_{\rm{s}}}^{\prime }=\frac{J}{4\pi {{D}_{2}}}\cdot \frac{{{r}_{0}}-{{r}_{1}}}{{{r}_{0}}{{r}_{1}}} $ | (31) |
式(31) 中:r1为未反应核半径,r0为矿粒原始半径.
对于内扩散控制,Cs=C0,Cs′=0,所以
| $ J=4\pi {{D}_{2}}{{C}_{0}}\cdot \frac{{{r}_{0}}r}{{{r}_{0}}-{{r}_{1}}} $ | (32) |
在任意时刻t,未反应核的摩尔数为:
| $ N=\frac{4}{3}\pi {{r}_{1}}^{3}\frac{\rho }{M} $ | (33) |
式(33) 中:M为未反应核的摩尔质量,ρ为未反应核的密度.
| $ \frac{{\rm{d}}N}{{\rm{d}}t}=\frac{4\pi \rho {{r}_{1}}^{2}}{M}\cdot \frac{{\rm{d}}{{r}_{1}}}{{\rm{d}}t} $ | (34) |
稀土在发生离子交换反应后时,单位时间浸取剂(NH4+) (aq)消耗量与反应的稀土(RE3+)(aq)矿物量-dN/dt成正比,比例系数是3,则有:
| $ J=4\pi {{D}_{2}}{{C}_{0}}\cdot \frac{{{r}_{0}}r}{{{r}_{0}}-{{r}_{1}}}=3\cdot (-\frac{4\pi \rho {{r}_{1}}^{2}}{M}\cdot \frac{{\rm{d}}{{r}_{1}}}{{\rm{d}}t}) $ | (35) |
整理后,得:
| $ -\frac{M{{D}_{2}}{{C}_{0}}}{3\rho }{\rm{d}}t=({{r}_{1}}-\frac{{{r}_{1}}^{2}}{{{r}_{0}}}){\rm{d}}{{r}_{1}} $ | (36) |
对式(36) 积分,可得:
| $ -\frac{M{{D}_{2}}{{C}_{0}}}{3\rho }\int_{0}^{t}{{\rm{d}}t}=\int_{{{r}_{0}}}^{{{r}_{1}}}{({{r}_{1}}-\frac{{{r}_{1}}^{2}}{{{r}_{0}}}\rm{)}}{\rm{d}}{{r}_{1}} $ | (37) |
求解式(37),得到:
| $ -\frac{M{{D}_{2}}{{C}_{0}}}{3\rho }t=\frac{1}{2}{{r}_{1}}^{2}-\frac{1}{6}{{r}_{0}}^{2}-\frac{1}{3}\frac{{{r}_{1}}^{3}}{{{r}_{0}}} $ | (38) |
矿物颗粒半径r1采用矿物浸取率α表示,即把式(22) 代入式(38) 中,可得:
| $ 1-\frac{2}{3}\alpha-{{(1-\alpha )}^{\frac{2}{3}}}=\frac{2M{{D}_{2}}{{C}_{0}}}{3\rho {{r}_{0}}^{2}}t={{k}_{3}}t $ | (39) |
式(39) 即为内扩散控制时的动力学方程.
内扩散控制时,提高浸取率的途径主要有:
1) 减小矿物颗粒的粒度,浸取时间与r0的平方成反比,故减小粒度有利于缩短浸取时间;
2) 减小固膜厚度,可以大幅度提高浸取率;
3) 提高温度,可以使得扩散系数D2增加,从而增加浸取速度.
2.3.4 混合控制当化学反应速度与外扩散速度有相同的数量级,且不存在固膜层时,该过程为化学反应与外扩散混合控制.通过扩散层形成浓度梯度(C0-CS)/d1,从化学反应角度而言,(-dN/dt)=k1SCs,从扩散角度而言,(-dN/dt)=k2S(C0-CS),联立可以得出:
| $ {{C}_{\rm{s}}}=\frac{{{k}_{2}}}{{{k}_{1}}+{{k}_{2}}}{{C}_{0}} $ | (40) |
则反应速度为:
| $ -\frac{{\rm{d}}N}{{\rm{d}}t}=\frac{{{k}_{1}}{{k}_{2}}}{{{k}_{1}}+{{k}_{2}}}S{{C}_{0}} $ | (41) |
对于球形颗粒,则有:
| $ -\frac{{\rm{d}}N}{{\rm{d}}t}=\frac{{{k}_{1}}{{k}_{2}}}{{{k}_{1}}+{{k}_{2}}}4\pi {{r}^{2}}{{C}_{0}} $ | (42) |
根据前文的推导,同理可得:
| $ 1-{{(1-\alpha )}^{\frac{1}{3}}}=\frac{{{k}_{1}}{{k}_{2}}}{{{k}_{1}}+{{k}_{2}}}\cdot \frac{{{C}_{0}}M}{{{r}_{0}}\rho }t $ | (43) |
浸取动力学实验一般采用“三颈法”,在500 mL三颈瓶中进行,分别装上可控速电动搅拌、回流冷凝管、温度计.实验过程中,用EDTA络合滴定法分析稀土浓度,按下式计算浸取分数[22]:
| $ \alpha =\frac{\varepsilon }{{{\varepsilon }_{0}}} $ | (44) |
式(44) 中:ε为浸取稀土量,ε0为实验中稀土总量.
在化学动力学中,控制步骤的判别方法主要是实验判别方法,即首先实验测定相关的动力学数据,然后分析数据并拟合相关动力学方程,从而确定浸取过程的控制步骤,通常有改变温度法、改变搅拌强度法、尝试法等[22].
2.4.2 浸取动力学方程文献[23]用尝试法探求稀土浸取动力学控制步骤及其动力学方程.将实验测得的数据分别代入不同控制步骤的动力学方程中进行拟合分析,结果发现,1-2α/3-(1-α)2/3对浸取时间t作图得到一系列直线,且通过原点,如图 2所示.
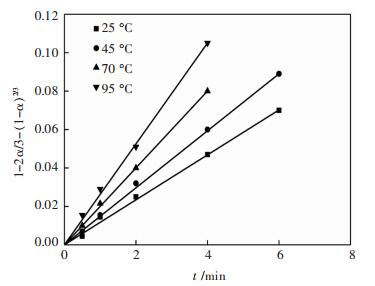 |
| 图 2 不同温度下内扩散控制稀土浸取动力学曲线 Fig. 2 Kinetic curves of internal diffusion control of rare earth leaching under different temperature |
风化壳淋积型稀土浸取过程较好地符合“收缩未反应芯模型”[23],浸取速率可以使用内扩散步骤控制模型,浸取动力学方程可表达为:
| $ 1-\frac{2}{3}\alpha-{{(1-\alpha )}^{\frac{2}{3}}}=0.53\cdot {{r}_{0}}^{-0.52}\cdot {{\rm{e}}^{-\frac{9240}{RT}}}\cdot t $ | (45) |
式(45) 中:R为理想气体常数,T为温度(K).
3 结束语风化壳淋积型稀土浸取过程的动力学结果对高效、科学地开采风化壳淋积型稀土矿有一定理论指导意义.提高浸取速度,则在一定的浸出时间内能保证更高的浸出率,或在保证一定的浸取率的情况下,能缩短浸取时间或减少浸矿剂的使用量.针对风化壳淋积型稀土生产实际,提出以下提高浸取速率的建议和方法:
1) 在春、夏、秋季进行原地浸矿,减少冬季的矿山生产.因为温度较高时,硫酸铵在稀土矿物颗粒固体膜中的扩散系数D2随之增大,从而增加浸矿速度,提高稀土的浸矿效率.
2) 在原地浸矿中先灌注清水,再注入浸矿液.通过水洗,可以使得稀土矿物周围的细小颗粒从矿物颗粒表面淘洗下来,随着清水从孔隙中流走,达到减小稀土矿物颗粒的粒度,从而提高浸取速率.
3) 通过强化磁场、选择复合浸矿剂等物理化学措施,达到减小矿物颗粒的固膜厚度的目的,从而提高稀土的浸矿效率.
| [1] | 池汝安, 田君. 风化壳淋积型稀土矿评述[J]. 中国稀土学报, 2007, 25(6): 641–650. |
| [2] | 池汝安, 田君, 罗仙平, 等. 风化壳淋积型稀土矿的基础研究[J]. 有色金属科学与工程, 2012, 3(4): 1–13. |
| [3] | 李永绣, 周新木, 刘艳珠, 等. 离子吸附型稀土高效提取和分离技术进展[J]. 中国稀土学报, 2012, 30(3): 258–264. |
| [4] |
HUANG X W, LONG Z Q, LI H W, et al. Development of rare earth hydrometallurgy technology in China[J].
Journal of Rare Earths, 2005, 23(1): 1–4. |
| [5] | 罗仙平, 钱有军, 梁长利. 从离子型稀土矿浸取液中提取稀土的技术现状与展望[J]. 有色金属科学与工程, 2012, 3(5): 50–53. |
| [6] | 金解放, 陶伟, 邱灿, 等. 离子型稀土一维垂直入渗规律及最大粒径的影响试验研究[J]. 有色金属科学与工程, 2015, 6(6): 125–131. |
| [7] | 丁嘉榆. 离子型稀土矿开发的历史回顾——纪念赣州有色冶金研究所建所60周年[J]. 有色金属科学与工程, 2012, 3(4): 14–19. |
| [8] | 饶振华, 武立群, 袁源明. 离子型稀土发现、命名与提取工艺发明大解密[J]. 中国金属通报, 2007(29): 8–15. |
| [9] | 郭钟群, 金解放, 秦艳华, 等. 南方离子型稀土一维水平入渗规律试验研究[J]. 有色金属科学与工程, 2017, 8(2): 102–106. |
| [10] | 程建忠, 车丽萍. 中国稀土资源开采现状及发展趋势[J]. 稀土, 2010, 31(2): 65–69. |
| [11] | 李永绣. 离子吸附型稀土资源与绿色提取[M]. 北京: 化学工业出版社, 2014. |
| [12] | 方兆珩, MUHAMMEDM. 从复杂硫化精矿中浸取金和银:氰化浸取动力学的研究[J]. 中国有色金属学报, 1992, 2(3): 42–47. |
| [13] | 欧腾蛟, 卢旭晨, 梁小峰, 等. 煅烧菱镁矿在氯化铵乙二醇溶液中的浸取动力学[J]. 过程工程学报, 2007, 7(5): 928–933. |
| [14] | 吴一峰, 刘峙嵘, 曾凯, 等. 铝土矿渣浸取动力学研究[J]. 化工矿物与加工, 2008(5): 9–10, 19. |
| [15] | 田君, 卢盛良, 尹敬群. 我国南方某稀土矿浸出动力学研究[J]. 化工冶金, 1995, 16(4): 354–357. |
| [16] |
TIAN J, YIN J Q, CHI R A, et al. Kinetics on leaching rare earth from the weathered crust elution-deposited rare earth ores with ammonium sulfate solution[J].
Hydrometallurgy, 2010, 101(3/4): 166–170. |
| [17] |
TIAN J, YIN J Q, TANG X K, et al. Enhanced leaching process of a low-grade weathered crust elution-deposited rare earth ore with carboxymethyl sesbania gum[J].
Hydrometallurgy, 2013, 139(3): 124–131. |
| [18] |
TIAN J, TANG X K, YIN J Q, et al. Enhanced leach ability of a lean weathered crust elution-Deposited rare-earth ore: effects of sesbania gum filter-aid reagent[J].
Metallurgical and Materials Transactions B, 2013, 44(5): 1070–1077. DOI: 10.1007/s11663-013-9871-3. |
| [19] | 张恋, 吴开兴, 陈陵康, 等. 赣南离子吸附型稀土矿床成矿特征概述[J]. 中国稀土学报, 2015, 33(1): 10–17. |
| [20] |
LIDDELL K C. Shrinking core models in hydrometallurgy: What students are not being told about the pseudo-steady approximation[J].
Hydrometallurgy, 2005, 79(1/2): 62–68. |
| [21] | 李洪桂. 浸出过程的理论基础与实践[J]. 稀有金属与硬质合金, 1992(4): 29–33. |
| [22] | 池汝安, 田君. 风化壳淋积型稀土矿化工冶金[M]. 北京: 科学出版社, 2006. |
| [23] | 田君, 唐学昆, 尹敬群, 等. 风化壳淋积型稀土矿浸取过程中基础理论研究现状[J]. 有色金属科学与工程, 2012, 3(4): 48–52. |
 2017, Vol. 8
2017, Vol. 8


