| 高岭石表面上铵离子吸附的量子化学研究 |
南方离子型稀土矿是我国特有的、世界上罕见的稀土资源, 其稀土配分中富含各种高新技术新材料应用中急需的中、重稀土元素[1, 2].这些稀土元素主要以离子形式吸附在黏土矿物(高岭石、海洛石和云母等)的表面上.当采用常规的物理选矿方法时稀土元素无法富集成精矿, 但是采用化学性质活泼的阳离子(如Na+、NH4+和Mg2 +等)能将稀土离子交换解吸下来[3, 4].目前大多数离子吸附型稀土矿采用硫酸铵溶液原地浸取获得稀土母液, 然后采用碳酸氢铵对稀土母液进行除杂处理, 最后以碳酸氢铵或草酸作为沉淀剂沉淀富集稀土, 从而获得稀土精矿[5, 6].离子型稀土浸矿过程中的关键反应是铵离子在黏土表面的吸附使稀土离子被交换下来.在原子及分子水平上研究铵离子在黏土矿物表面的吸附机理,能为离子型稀土的化学浸矿提供理论解释,并为高效提取技术提供科学依据.
量子化学计算方法可以从原子水平上来研究复杂的反应过程和分子的结构性质.它包括从头算法、半经验方法和密度泛函理论方法[7, 8].相对于前两种量子化学方法, 密度泛函理论方法具有更小的计算量, 适用于大型分子体系和固体的模拟计算, 目前已广泛应用于石油、矿业、化工、材料和生命科学等领域.例如, 对于电解质阳离子在黏土矿物表面上吸附, 已经有大量研究工作采用密度泛函理论的方法从原子水平上解释其吸附模式及机理[9-12].He等[13, 14]采用密度泛函方法研究了不同表面覆盖率对Pb2+、Cd2+、Cu2+、Hg2+和Ni2+等重金属离子在高岭石(001) 表面上吸附结构和能量的影响; Peng等[15]采用密度泛函方法研究了CaOH+在蒙脱石层面和端面的吸附, 发现CaOH+比Ca2+和H2O更容易吸附在蒙脱石表面上.由于高岭石是离子型稀土矿中典型的黏土矿物且高岭石具有不同性质的铝氧面和硅氧面, 研究铵离子在高岭石这些表面上的吸附对离子型稀土浸取具有重要的意义.目前关于NH4+在高岭石表面上的吸附的理论研究较少.本文采用基于密度泛函理论的量子化学方法, 通过前线轨道理论、吸附构型、吸附能和Mulliken电荷探究NH4+在高岭石铝氧面和硅氧面上的吸附机理以及水分子对NH4+吸附的影响.
1 计算方法和模型 1.1 计算方法密度泛函理论计算在Material studios 8.0软件的Castep模块中进行.交换相关泛函采用在广义密度梯度近似(GGA)框架下的PBE泛函.对高岭石的单胞进行优化时, 倒易空间的k点采样为4×2×2;对超表面结构进行几何优化时, k点限制在Γ点.采用Ultrasoft赝势描述价电子和离子实的相互作用.平面波截断能Ecut为400eV.几何优化收敛标准为相邻两步间能量的最大改变量小于1×10-5eV/atom, 最大力改变量小于0.03 eV/ ,最大位移改变量小于0.001 .几何优化时的smearing值取0.1 eV.
吸附能可用于表征铵离子在高岭石表面的吸附稳定性.吸附能为负值, 表示吸附反应放热, 且吸附能越负, 吸附越稳定.吸附能可按式(1)计算:
| ${{E}_{\text{ads}}}={{E}_{\text{system}}}-{{E}_{\text{adsorbate}}}-{{E}_{\text{surface}}}$ | (1) |
式(1)中Eads为吸附能; Esystem为吸附后总体系的能量; Eadsorbate和Esurface分别为吸附前吸附质的能量和高岭石表面的能量.
1.2 计算模型高岭石是一种典型的粘土矿物, 其基本晶体层由一个铝八面体层连接一个硅四面体层而组成, 如图 1所示.高岭石单胞化学式为Al4Si4O10(OH)8, 其晶格中几乎没有取代现象.几何优化后的高岭石的晶胞参数为:a=5.19 , b=9.03 , c=7.47 ;α=91.1 , β=105.3 , γ=89.7 ,与中子散射实验晶胞数据[16]:a=5.15 , b=8.93 , c=7.38 ;α=91.9 , β=105.0 , γ=89.8 相比, 晶胞参数非常接近.对几何优化后的单胞构建两倍a轴的超晶胞并分别切割(001) 面(又称铝氧面), 和(00-1) 面(又称硅氧面), 从而得到(2×1×1) 的超晶胞表面, 最后在表面上方加入15 厚度的真空层, 以防止邻近片层对吸附的影响.
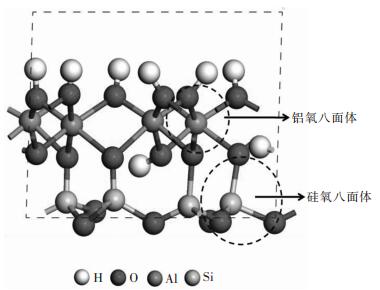 |
| 图 1 高岭石的晶胞结构 Fig. 1 The unit cell of kaolinite |
为了便于区别各种原子, 文中Hn表示NH4+上氢原子; Hw和Ow分别表示水分子的氢原子和氧原子; Hs和Os分别表示高岭石表面上氢原子和氧原子.
2 结果与讨论 2.1 高岭石表面性质由于高岭石的层面可以分为铝氧面和硅氧面.在铝氧面上表面组分为OH, 其中1/3为平躺的OH, 其他2/3为竖立的OH[17]; 在铝氧面上均是饱和的氧原子, 没有H原子.根据前线轨道理论[18, 19], 分子费米面附近分布最高已占据分子轨道(HOMO)和最低未占据分子轨道(LUMO).这些前线轨道具有较高的反应活性, 在分子间相互作用中最易受到微扰, 故决定了物质之间反应.对于NH4+在高岭石表面上的吸附, 表面的HOMO轨道会和NH4+的LUMO轨道产生相互作用.因此通过计算表面的HOMO轨道性质, 可以判断NH4+在表面上的吸附位置.
图 2所示为高岭石表面HOMO轨道等值面图.原子周围的黄色和蓝色区域均表示轨道的范围.在这些HOMO轨道范围处NH4+最容易和表面产生作用.从图 2(a)中可以看出, 在高岭石铝氧面上, HOMO轨道主要位于平躺OH组分中O原子周围(箭头所指部位), 说明NH4+容易吸附在该位置.从图 2(b)中可以看出, 在高岭石硅氧面上, HOMO轨道均位于表面O周围, 且在表面O六元环中心位置, NH4+的LUMO轨道能最大程度地和表面HOMO轨道产生作用, 因此NH4+容易吸附在高岭石硅氧面O六元环的中心处.韩永华等[20]计算了CaOH+在高岭石硅氧面的吸附, 类似地发现CaOH+通过Ca原子吸附在硅氧面O六元环的中心.
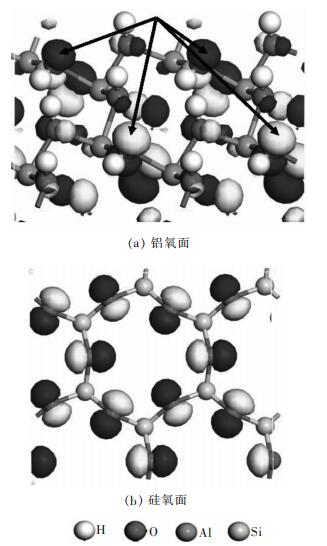 |
| (注:蓝色表示电子自旋向上; 黄色表示电子自旋向下) 图 2 高岭石表面HOMO轨道等值面图 Fig. 2 The isosurface of HOMO orbitals of kaolinite surface |
2.2 在无水表面上吸附
通过几何优化后的最稳定吸附构型可以了解吸附质在表面上的吸附位置、作用方式以及吸附能.NH4+在无水高岭石表面上的最稳定吸附构型如图 3所示.为了方便观察, 在构型图中对表面下方的原子进行了隐藏.在图 3(a)中高岭石铝氧面上, NH4+最佳吸附位置位于平躺的OH周围, 和前面的前线轨道分析结果一致.NH4+的2个H原子和2个表面O原子分别形成2个长度为1.62 和2.15 的Hn…Os氢键, NH4+离子的吸附能为-119.64 kJ/mol(表 1).在图 3(b)高岭石硅氧面上, NH4+最佳吸附位置位于表面O六元环中心处, 同样与前线轨道分析结果一致.NH4+离子的吸附能为-101.31kJ/mol.NH4+的3个H原子和3个表面O原子分别形成3个长度为1.78 、1.82 和1.94 的Hn…Os氢键.
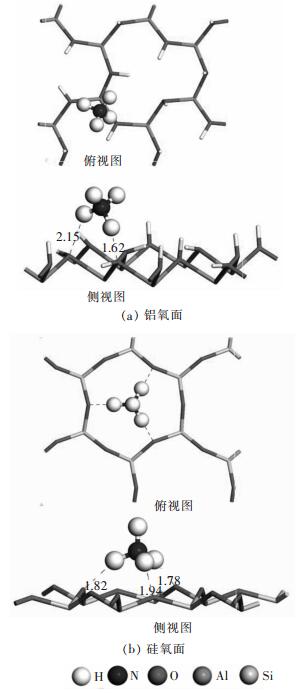 |
| 图 3 NH4+在无水高岭石表面上最佳吸附构型 Fig. 3 The most stable structures of NH4+ on kaolinite surface without water |
| 表1 NH4+在高岭石表面上的吸附能/(kJ·mol-1)及与稀土La3+和H2O的比较 Table 1 The adsorption energis of of NH4+ on kaolinite surface and the comparision with ones of rare earth ions La3+and H2O/(kJ·mol-1) |
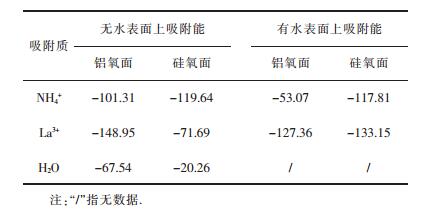 |
| 点击放大 |
根据Mulliken电荷分析[21], 吸附发生后有0.52 e和0.78 e电子分别从NH4+上转移到高岭石铝氧面和硅氧面上.由于吸附后没有化学键的断裂和形成, NH4+和表面间没有发生化学反应, 但是存在氢键作用.虽然氢键作用常被归类为物理作用, 但是氢键既含存在静电作用成分也存在共价成分, 所以吸附后的电荷转移主要由NH4+和表面间形成的氢键作用导致[22].另外NH4+在高岭石硅氧面上比在铝氧面上多形成一个氢键, 且在硅氧面上吸附的NH4+的正电性更强, 即与表面间的静电作用更强, 所以在硅氧面上NH4+的吸附能比在铝氧面上的更大, 即NH4+更容易吸附在硅氧面上.
2.3 在有水表面上吸附由于稀土浸取是在溶液环境中进行的, 高岭石的表面会产生水化作用, 并影响铵离子的吸附.为了模拟表面水化作用对NH4+在高岭石表面吸附的影响, 在高岭石表面加入一个水分子后再计算NH4+的吸附.
图 4所示为水分子在高岭石表面的最稳定吸附构型.在铝氧面上的H2O最稳定吸附构型中(图 4(a)), H2O与表面形成3个氢键作用, 其中水分子H和表面平躺OH中的O原子形成1个Hw…Os氢键, 键长为1.71 ;水分子O分别和表面2个竖立的OH中的H原子形成2个Hs…Ow氢键, 键长分别为1.92 和1.97 .在硅氧面上(图 4(b)), H2O的2个H原子与同一个硅原子上的两个表面O原子形成2个Hw…Os氢键, 键长分别为2.13 和2.30 .如表 1所示, H2O在高岭石铝氧面上的吸附能为-67.54 kJ/mol, 是在硅氧面上的吸附能-20.26 kJ/mol的将近3倍, 表明H2O更容易吸附在高岭石的铝氧面上.另外H2O无论是在高岭石的硅氧面上还是在铝氧面上的吸附能均比La3+和NH4+的吸附能小, 表明H2O很难解吸出高岭石表面上吸附的稀土La3+和NH4+, 这和实验中稀土离子在自然水中不能溶出的情况相一致[23].
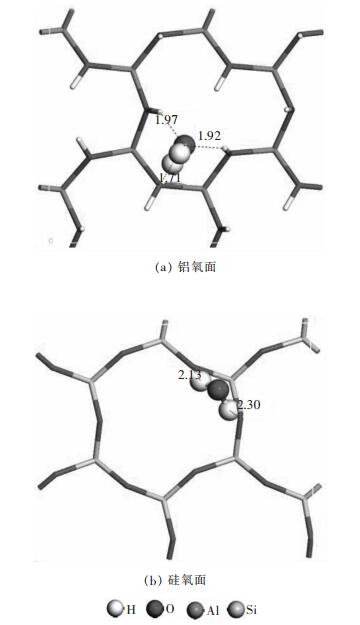 |
| 图 4 水分子在高岭石表面上最佳吸附构型 Fig. 4 Most stable structures of water on kaolinite surface |
NH4+在有水铝氧面上的最稳定吸附构型如图 5(a)所示, 吸附能为-53.07 kJ/mol, 比在无水表面上的吸附能-101.31 kJ/mol要减小大约一半.从构型中可以看出, NH4+同时与表面和水分子发生作用:3个H原子分别和3个表面OH组分中O原子形成3个Hn…Os氢键, 氢键长分别为1.57 、2.18 和2.38 ;其中1个H原子和水分子的O原子形成1个Hn…Ow弱氢键, 氢键长为2.57 .在吸附铵离子后, 水分子偏离初始吸附位置, 仅与表面形成1个1.77 的Hs…Ow氢键.另外根据Mulliken电荷分析, 有水的铝氧表面吸附NH4+后, 0.53e电子从NH4+转移到表面, 和在无水铝氧面上的0.52e的电子转移量接近, 说明在硅氧面上水分子对NH4+与面间的静电作用影响不大.但是由于在有水铝氧面上, NH4+使H2O偏离其最稳定构型位置, H2O与表面间的氢键数目减少, 作用强度减弱, 总体系的能量升高, 最终使NH4+在有水铝氧面上吸附能减小.
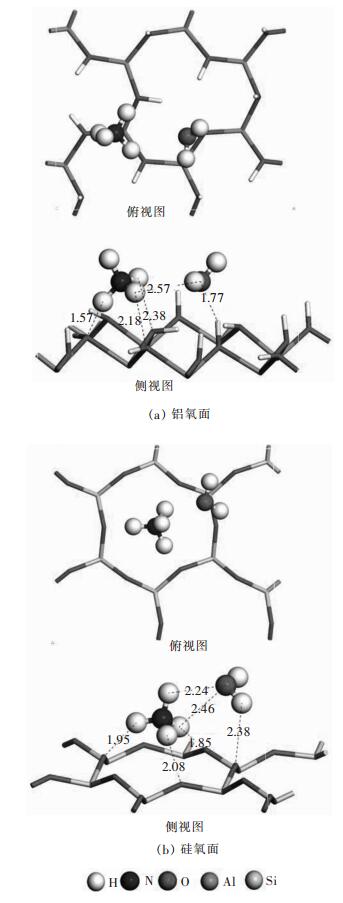 |
| 图 5 NH4+在加入水分子的高岭石表面上最佳吸附构型 Fig. 5 Most stable structures of NH4+ on kaolinite surface with water |
在有水硅氧面上NH4+最稳定吸附构型中(图 5(b)), NH4+的吸附能为-117.81 kJ/mol, 和无水硅氧面上的-119.64 kJ/mol吸附能相比, 变化不大.从构型中可以看出, NH4+仍然和3个硅氧面O形成3个Hn…Os氢键, 但是该氢键的平均键长为1.96 比无水硅氧面上的平均键长1.85 增大了0.11 ,即与表面作用减弱; 且H2O和表面只形成1个2.30 的Hw…Os氢键, 比未加入NH4+时要少1个氢键, H2O与表面间作用减弱.在这种情况下体系能量应该会升高, 但是由于NH4+与H2O之间存在2个Hn…Ow氢键, 键长分别为2.24 和2.46 ,使得体系能量降低, 因此体系总能量基本不变, NH4+的吸附能变化不大.
对于有水情况下不同表面上的吸附, NH4+在硅氧面上的吸附能为-117.81 kJ/mol, 比在铝氧面上的吸附能-53.07 kJ/mol要大接近一倍, 即NH4+容易吸附在硅氧面上.我们同样计算了有水情况下稀土离子La3+的吸附能(表 1), 在硅氧面上为-133.15 kJ/mol; 在铝氧面上为-127.36 kJ/mol, 在两个面上相差不大, 也就是说La3+在两种表面上均能吸附.由于在硅氧面上, NH4+的吸附能比La3+小15.34 kJ/mol, 相差较小, 但是在铝氧面上NH4+的吸附能比La3+小74.29 kJ/mol, 相差较大, NH4+很难取代吸附在黏土表面的稀土La3+.因此在实际生产中为了提高稀土离子的浸取率, 必须提高NH4+的浓度到一定的值以保证在铝氧面上吸附的稀土离子能被交换下来[1].
3 结论1)由前线轨道理论, 高岭石表面的最高占据轨道(HOMO)和铵离子的最低未占据轨道(LUMO)产生作用.在高岭石铝氧面上, 铵离子最容易吸附在表面平躺OH组分周围; 在高岭石硅氧面上, 铵离子最容易吸附在表面氧六元环中心处.
2)由吸附构型和Mulliken电荷分析, 铵离子主要通过静电作用和氢键作用吸附到高岭石表面上; 吸附后分别有0.52 e和0.78 e电子从铵离子转移到高岭石铝氧面和硅氧面上.
3)表面水分子的存在会影响铵离子的吸附.在有水高岭石表面上, 铵离子与表面和水分子同时产生作用.水分子使铵离子在铝氧面上吸附能减小较大, 而在硅氧面上变化不大; 铵离子更易吸附在硅氧面上.
4)在有水的高岭石铝氧面和硅氧面上, 铵离子的吸附能均小于稀土镧离子的吸附能.为了提高稀土离子的浸取率, 必须增加铵离子的浓度到一定的值以保证吸附在铝氧面上的稀土离子可以被铵离子交换下来.
| [1] | 李永绣. 离子型稀土资源与绿色提取[M]. 北京: 化学工业出版社, 2014. |
| [2] | 池汝安, 王淀佐. 稀土矿物加工[M]. 北京: 科学出版社, 2014. |
| [3] | 肖燕飞, 黄小卫, 冯宗玉, 等. 离子吸附型稀土矿绿色提取技术研究进展[J]. 稀土, 2015, 36(3): 109–15. |
| [4] | 田君, 尹敬群, 欧阳克氙, 等. 风化壳淋积型稀土矿提取工艺绿色化学内涵与发展[J]. 稀土, 2006, 27(1): 70–72. |
| [5] | 杨幼明, 王莉, 肖敏, 等. 离子型稀土矿浸出过程主要物质浸出规律研究[J]. 有色金属科学与工程, 2016, 7(3): 125–130. |
| [6] | 黄万抚, 邹志强, 钟祥熙, 等. 不同风化程度离子型稀土矿赋存特征及浸出规律研究[J]. 中国稀土学报, 2017, 35(2): 253–261. |
| [7] | 王宝山, 侯华. 分子模拟实验[M]. 北京: 高等教育出版社, 2010. |
| [8] | 任慧. 量子化学理论在现代化学中应用的研究[D]. 北京化工大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10010-2009260384.htm |
| [9] | 何桂春, 张慧婷, 华亚南, 等. 锂辉石表面环烷酸吸附行为的量子化学[J]. 中国有色金属学报, 2017, 27(4): 833–842. |
| [10] | 王力, 姚旭, 尹东光, 等. 臭氧氧化偏二甲肼生成二甲基亚硝胺的量子化学计算[J]. 火炸药学报, 2017, 02: 79–83. |
| [11] | 于会华, 张静, 杜敏. 量子化学在缓蚀剂研究中的应用[J]. 材料保护, 2010, 43(11): 36–39. |
| [12] | 邵绪新, 郭梦熊, 廖沐真. 量子化学的基本原理及其在矿物工程中的应用[J]. 矿冶工程, 1991, 11(1): 67–70. |
| [13] |
ZHAO J, HE M. Theoretical study of heavy metal Cd, Cu, Hg, and Ni(Ⅱ) adsorption on the kaolinite(001) surface[J].
Applied Surface Science, 2014, 317: 718–23. DOI: 10.1016/j.apsusc.2014.08.162. |
| [14] |
HE M, ZHAO J, WANG S. Adsorption and diffusion of Pb(Ⅱ) on the kaolinite(001) surface: A density-functional theory study[J].
Applied Clay Science, 2013, 85: 74–79. DOI: 10.1016/j.clay.2013.08.045. |
| [15] |
PENG C, MIN F, LIU L, et al. The adsorption of CaOH+ on (001) basal and (010) edge surface of Na-montmorillonite: a DFT study[J].
Surface and Interface Analysis, 2017, 49(4): 267–277. DOI: 10.1002/sia.v49.4. |
| [16] |
YOUNG R A. Verification of the Triclinic Crystal Structure of Kaolinite[J].
Clays & Clay Minerals, 1988, 36(3): 225–32. |
| [17] |
KREMLEVA A, KRUGER S, ROSCH N. Density Functional Model Studies of Uranyl Adsorption on (001) Surfaces of Kaolinite[J].
Langmuir, 2008, 24(17): 9515–9524. DOI: 10.1021/la801278j. |
| [18] | 钟建莲, 陈建华, 李玉琼, 等. 硫铁矿晶体化学及前线轨道研究[J]. 广西大学学报(自然科学版), 2011, 36(3): 404–410. |
| [19] | 孙伟, 杨帆, 胡岳华, 等. 前线轨道在黄铜矿捕收剂开发中的应用[J]. 中国有色金属学报, 2009, 19(8): 1524–1532. |
| [20] | 韩永华, 刘文礼, 陈建华, 等. 羟基钙在高岭石两种(001) 晶面的吸附机理[J]. 煤炭学报, 2016, 41(2): 743–750. |
| [21] |
MULLIKEN R S. Electronic Population Analysis on LCA-MO Molecular Wave Functions[J].
Journal of Chemical Physics, 1995, 23(10): 1833–1840. |
| [22] |
STEINER T. The Hydrogen Bond in the Solid State[J].
Angewandte Chemie International Edition, 2002, 41: 48–76. DOI: 10.1002/1521-3773(20020104)41:1<>1.0.CO;2-5. |
| [23] | 池汝安, 田君. 风化壳淋积型稀土矿化工冶金[M]. 北京: 科学出版社, 2006. |
 2017, Vol. 8
2017, Vol. 8


