| 微波外场辅助液相沉淀法合成立方形Co3O4及前驱体研究 |
Co3O4是一种过渡金属的氧化物因其具有较高的比电容(890 mA·h/g)[1]而被广泛应用于生产锂离子电池的正极材料、大容量电容器、压敏陶瓷等[2-3].Co3O4属立方晶系,具有尖晶石结构,其中三价钴离子占据八面体位,而二价钴离子占据在四面体中心,其他位置则被氧离子所占据,具有较高的晶体场稳定性. Co3O4的物理化学性能受粒度大小及形貌的影响,其粒度及形貌又制约于材料的制备方法.制备Co3O4的方法常见的有室温固相法[4-5]、沉淀-热分解法[6-8]、水热法[9]、雾化氧化法[10-11]、溶胶凝胶法[12]等.研究表明湿法生产的Co3O4的性能更优,在工艺生产中沉淀-热解法在工业化实践中得到广泛应用.在锂电池的生产中Co3O4的纯度、分散性、颗粒大小直接关乎锂电池材料的性能和寿命.因此制备产物纯度高、晶粒发育完整、粒径小且分布均匀、无团聚、分散性好的立方形和球形Co3O4已成为当今的研究热点.近年来由于微波具有清洁、高效、简便、反应时间短、内加热无温度梯度的独特优点,而引起了材料工作者的关注,已被广泛地应用在陶瓷材料、超导材料、纳米材料和催化材料的合成[13-16].本实验研究采用微波加热辅助沉淀法制备Co3O4前驱体及Co3O4纳米材料,考察加热方式、反应物浓度、反应温度和反应时间对前驱体形貌的影响及分解温度对Co3O4形貌的影响.通过改变实验条件实现了立方形Co3O4粒度及形貌的有效控制,并将反应物浓度为0.1 mol/L,CoCl2与(NH4)2C2O4摩尔比为1:1,反应温度80 ℃、反应时间150 min的条件下制得的前驱体,在600 ℃下热分解制得80 nm左右的球状纳米Co3O4.
1 实验 1.1 样品制备以CoCl2·6H2O为钴源、(NH4)2C2O4为沉淀剂,用去离子水配成一定浓度的溶液,取一定量的氯化钴溶液和草酸铵溶液分别倒入A和B分液漏斗中,将A、B分液漏斗分别架在漏斗架上,分液漏斗下端分别用导管连接至微波反应器中的三口烧瓶中.采用并加的方式进行实验,调节分液漏斗,控制好液体的滴速.反应完成后沉淀经陈化、过滤、并用酒精和蒸馏水各洗涤3次后、置于干燥箱中60 ℃下干燥4 h后得前驱体草酸钴.将草酸钴热分解得Co3O4.
1.2 分析表征采用德国卡尔蔡司公司生产的EVO型扫描电子显微镜,在扫描电压20 kV下观察CoC2O4前躯体及热分解产品的形貌特征及分散情况,利用美国PEA公司的Diamond6000型差热-热分析分析仪(TG-DSC)对前驱体的热分解规律进行表征,采用日本理学公司的Miniflex型X-射线衍射仪(Cu-Kα为衍射源,扫描速率ν为10 °/min,步长为0.02°,扫描范围2θ为10°~90°,并与JCPDF标准卡进行对比)对样品进行结构分析测定.
2 结果与讨论 2.1 加热方式对Co3O4前驱体形貌的影响以CoCl2为反应物,(NH4)2C2O4为沉淀剂,反应物浓度为0.1 mol/L,反应温度为80 ℃,反应时间为150 min,采用2种加热方式微波加热、水浴加热制得前驱体的SEM像如图 1所示.
 |
| 图 1 不同加热方式制备的Co3O4前驱体SEM像 Fig. 1 SEM images of Co3O4 precursors prepared by different heating methods |
由图 1可知,恒温水浴加热模式所制得的Co3O4前驱体颗粒大小不一,形貌非常不规则;而微波加热模式所得前驱体形貌规整,颗粒大小保持一致,呈现类立方形的形状,且分散性较好,很好地解决了粉末团聚的问题.
恒温水浴加热通过对外界环境进行热传递和热辐射获得能量的,加热效率非常低.加热过程是由表及里的体系,反应初期存在一定的温度梯度,导致不同区域晶体的形核和长大速度不同,所得到的晶体的粒径较大.而微波加热是一种在分子水平内对反应体系进行加热和搅拌的内加热方式,可使反应物分子获得足够的能量快速达到系统热力学结晶的能量要求,大大提高溶液中晶核的生成速率进而快速地聚集成核生长[17-18],在一定程度上改善了反应体系中温度梯度和浓度差异的影响.微波特有的内加热方式加速了溶液中的Co3+、C2O42-、NH4+和Cl-离子的运动,使得晶体迅速成核并长大,从而得到颗粒饱满,晶型完整,呈立方形的Co3O4前驱体.
2.2 反应物浓度对Co3O4前驱体形貌的影响以CoCl2为原料,(NH4)2C2O4为沉淀剂,控制CoCl2与(NH4)2C2O4的摩尔比为1:1,反应温度为80 ℃,反应时间为120 min,采用CoCl2浓度分别为0.05 mol/L、0.10 mol/L、0.15 mol/L、0.20 mol/L、0.25 mol/L.不同浓度下制备的Co3O4前驱体的SEM像如图 2所示.由图 2可知,前驱体的粒径大小随着浓度的增大有一个先减小后增大的趋势.当浓度为0.05 mol/L时,前驱体表面较粗糙,形状不规则,表面附着许多细小的颗粒,整体粒径D50大小为6 μm左右.当浓度增大到0.1 mol/L时,前驱体为类立方形结构,轮廓清晰,不仅表面光滑,而且粒径较为均一,D50分布在2~3 μm之间.继续增大反应物的浓度,颗粒粒径开始增大,形状改变,不再呈规则的类立方体,变成了四面体结构,且团聚现象较为严重,表面也更粗糙,晶体出现缺陷.随着反应物浓度的增大,一定体积内的反应物增多,反应物来不及扩散,从而团聚在一起形成大颗粒.因此,考虑前驱体的形貌大小以及分散程度,选用0.1 mol/L为最佳浓度.
 |
| 图 2 不同浓度下Co3O4前驱体SEM像 Fig. 2 SEM images of Co3O4 precursors prepared with different reactant solubilities |
2.3 体系温度对Co3O4前驱体形貌的影响
以CoCl2为原料,(NH4)2C2O4为沉淀剂,反应物浓度为0.10 mol/L,反应时间为120 min,控制CoCl2与(NH4)2C2O4的摩尔比为1:1,采用反应温度分别为60 ℃、70 ℃、80 ℃、90 ℃,不同温度条件下制备的Co3O4前驱体的SEM像如图 3所示.从图 3(a)可知60 ℃下制得的前驱体为表面光滑的棒状物,分散性好,大小较为一致,还有一些细小的颗粒生成,但形貌与棒状物相似,这说明在反应过程中有部分的棒状物断裂.可能是由于反应温度不够,晶核长大所需的能量不足导致部分棒状物断裂.当反应温度为70 ℃时,所得前驱体为均匀类立方形结构的颗粒,粒径大小分布不均.当温度升高到80 ℃时,前驱体为单个的类立方形晶体,粒径分布均匀,大小为2~3 μm之间.继续升高温度,此时所得前驱体团聚现象加剧,且粒径大小分布不均匀;此时反应体系温度过高,使得溶液的黏度降低,由于分子的剧烈运动,大大增加了晶核之间碰撞的机率,从而导致融合现象,颗粒变得更大.综合考虑前驱体的粒径大小和颗粒形貌,选择80 ℃为最佳的反应温度.
 |
| 图 3 不同温度条件下制备的Co3O4前驱体SEM像 Fig. 3 SEM images of Co3O4 precursors prepared at different temperature |
2.4 反应时间对Co3O4前驱体形貌的影响
以CoCl2为钴源,(NH4)2C2O4为沉淀剂,反应物浓度为0.1 mol/L,CoCl2与(NH4)2C2O4的摩尔比为1:1,反应温度为80 ℃,控制反应时间分别为60 min、90 min、120 min、150 min、180 min,制得不同前驱体的SEM像如图 4所示.从图 4可以看出,随反应时间的增加,前驱体的形貌发生较大的改变.图 4(a)中,前驱体存在2种大小不同的颗粒:一为不定型的大颗粒,二为细小的类立方形颗粒.此时由于反应时间较短,单位时间内进入反应容器的液体更多,在转速一定的情况下,反应物来不及扩散就参与反应,从而导致颗粒的粒径较大;当反应时间继续增大,前驱体形貌趋于规整,属于类正方体结构,但仍然受反应时间的影响所制得的前驱体存在一定程度的团聚现象.当反应达到150 min时,前驱体的形貌基本固定,不再发生变化,且粒径大小分布均匀,D50分布在3 μm左右.继续增加反应时间到180 min,此时对前驱体的形貌及粒度分布影响不大.因此从节约能源的角度综合考虑前驱体的形貌粒度,反应时间以150 min为最佳.
 |
| 图 4 不同反应时间条件下制备的Co3O4前驱体SEM像 Fig. 4 SEM images of Co3O4 precursors prepared with different reaction time |
2.5 Co3O4前驱体热重/热差分析
为了进一步确定前驱体的物相转变过程,将前驱体进行TG-DTA分析,分别取3.857 mg的Co3O4前驱体和3.210 mg的Al2O3参比样,在N2(100mL/min)气氛下以10 ℃/min的升温速率对样品进行升温,观察各项参数随温度的变化曲线.对数据结果进行分析,得TG-DTA曲线如图 5所示.由图 5中可知,前驱体在150 ℃之前TG曲线没有变化,说明前驱体粉末的干燥效果较好,样品中几乎不存在无定型的自由水.在150~200 ℃之间样品有一个较为明显的失重陡坡,失重率达17.9 %,与理论失重率(19 %)较为吻合,即此时失去2个结晶水.在300~400 ℃时,从TG曲线可以看出,样品迎来了一个最大的失重高峰,此时CoC2O4开始分解成Co3O4,样品失重率达到了43.8 %,与CoC2O4分解的理论失重率一致.温度升高到800 ℃之前,前驱体的TG和DTG曲线都没有变化,样品处于稳定的状态;在800 ℃时,样品迎来一个失重峰,此时Co3O4进一步发生分解反应,Co3O4开始逐步转变为CoO.温度达到1 000 ℃以后,样品的重量不再变化,此时Co3O4已经全部分解为CoO.因此,合理控制不同的热分解温度,可以得到不同的目标产物,若需热分解前驱体得到Co3O4,热分解温度应控制在400~800 ℃,若最终产物为CoO,热分解温度需800 ℃以上.
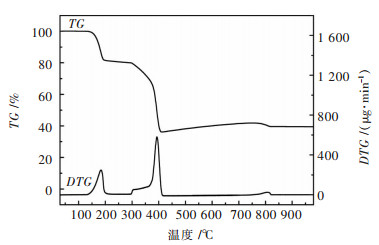 |
| 图 5 前驱体的热重和差热分析曲线 Fig. 5 Thermogravimetric and differential thermal analysis of Co3O4 precursor |
2.6 Co3O4的X-射线衍射(XRD)分析
图 6所示为不同热分解温度下得到Co3O4的X射线衍射(XRD)谱,其中热分解温度分别为500 ℃、600 ℃、700 ℃、800 ℃、900 ℃.从XRD图谱可知,不同温度下热分解的样品具有相同的衍射峰,可以确定5种样品为同一种物质.通过与标准Co3O4的XRD图谱进行对比,热分解后的各衍射峰和标准衍射卡(JACD No.42-1467)基本一致,特征峰(2θ为37 °附近)非常尖锐,没有杂峰,可以确定热分解后的物质为Co3O4,属立方晶系.其中500~800 ℃下热分解的Co3O4的衍射峰区别不大,可见前驱体热分解获得Co3O4具有较大的热分解温度区间.在900 ℃时,各衍射峰开始变弱,特征峰减弱得非常明显,结合前驱体的TG-DTA曲线可知,在850 ℃时,Co3O4开始分解为CoO,所以Co3O4的特征峰开始减弱,而CoO特征峰开始浮现.从X射线衍射(XRD)谱可以看出,热分解温度为500 ℃时,前驱体已经开始分解为Co3O4,因此结合前驱体的TG-DTG曲线可以确定500~ 800 ℃可以作为制备Co3O4的热分解温度.
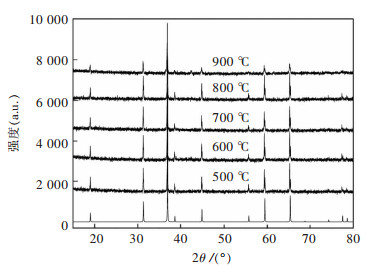 |
| 图 6 不同温度下Co3O4的XRD谱 Fig. 6 XRD Patterns of Co3O4 at different temperatures |
2.7 热分解温度对Co3O4形貌的影响
为讨论热分解温度对四氧化三钴形貌的影响,在马弗炉中分别控制温度为500 ℃、600 ℃、700 ℃、800 ℃进行热分解.如图 7所示,分别为不同温度下热分解的四氧化三钴电镜图. 图 7(a)为500 ℃处理,此时的四氧化三钴呈类正方体形状,上面附着许多蓬松的颗粒. 图 7(b)所示当热分解温度升高到600 ℃时,四氧化三钴的形貌发生了较大的变化,由类正方体开始转变为类球形颗粒,且粒径大小由3 μm减小为80 nm左右.可能是因为蓬松的颗粒由于温度的升高而结合在一起.当温度继续超过600 ℃时,如图 7(c)、图 7(d)四氧化三钴形貌变得混乱,团聚变得严重,这是因为温度过高,导致球形颗粒全部“融化”在一起,出现了较为严重的团聚现象.热分解温度是控制颗粒发生团聚现象的关键因素之一,温度过低,前驱体分解不完全,晶体发育不完整;温度过高,粉体会自发地团聚,甚至出现过烧现象.考虑热分解后粉体的形貌,以600 ℃为较佳的热分解温度.
 |
| 图 7 不同热分解温度下Co3O4的SEM像 Fig. 7 SEM of Co3O4 at different thermal decomposition temperatures |
3 结论
1)微波加热模式效果优于传统加热模式,且反应时间短,加热速度快,温度梯度更均匀,微波加热模式所得前驱体形貌规整,颗粒大小均匀,不仅呈现类立方形的形状,而且分散性好.
2)采用微波辅助制备Co3O4前驱体,其最佳工艺参数为:在以氯化钴为反应物,草酸铵为沉淀剂,反应物浓度为0.1 mol/L,摩尔比为1:1,反应温度为80 ℃,反应时间为150 min,可得到粒径为2~3 μm均匀分散的微米级类立方形Co3O4前驱体.
3)利用XRD和TG-DTA的表征结果可知,前驱体为草酸钴,热分解后的产物为Co3O4,衍射图图谱特征峰明显,没有杂峰.草酸钴在500 ℃下开始分解成Co3O4,在900 ℃时生成CoO.结合不同热分解温度下Co3O4的SEM像,热分解温度选择600 ℃较优.
4)在热分解温度600 ℃下,将制得的前驱体热分解分解,四氧化三钴的形貌发生了较大的变化,由类正方体转变为类球形颗粒,粒径大小由3 μm减小为80 nm左右,制得球形纳米Co3O4.
| [1] | 王兴磊, 欧阳艳, 罗新泽, 等. 四氧化三钴超级电容器电极材料的制备与研究[J]. 无机盐工业, 2009, 41(9): 15–17. |
| [2] | 熊德胜, 秦枫, 徐华龙, 等. 固相法制备纳米Co3O4催化剂及其催化甲苯完全氧化性能[J]. 化学学报, 2012, 70(1): 39–44. |
| [3] | 甘卫平, 马贺然, 李祥. 超级电容器用(RuO2/Co3O4)·nH2O复合薄膜电极的制备及其性能[J]. 无机材料报, 2011, 26(8): 823–828. |
| [4] | 程魁, 杨帆, 闫鹏, 等. Co3O4纳米片的制备及对H2O2电还原反应的催化性能[J]. 高等学校化学学报, 2014, 35(1): 110–114. DOI: 10.7503/cjcu20130504. |
| [5] |
WANG X, CHEN X Y, GAO L S, et al. One-dimensional arrays of Co3O4 nanoparticles:Synthesis, characterization and optical and electrochemical properties[J].
Journal of physical Chemistry B, 2004, 108(42): 16401–16404. DOI: 10.1021/jp048016p. |
| [6] |
NI Y, GE X, ZHANG Z C, et al. A simple resuetion-oxidation route to prepare Co3O4 nanocrystals[J].
Materials Researeh Bulletin, 2001, 36(13): 2383–2387. |
| [7] |
YANG H M, HU Y H, ZHANG X C, et al. Mechano chemical synthesis of cobalt oxide nanoparticles[J].
Materials Letters, 2004, 58: 387–389. DOI: 10.1016/S0167-577X(03)00507-X. |
| [8] | 吕永阁, 李勇, 塔娜, 等. Co3O4纳米立方体的可控合成及其CO氧化反应性能[J]. 物理化学学报, 2014, 30(2): 382–388. DOI: 10.3866/PKU.WHXB201312032. |
| [9] | 张立, 余贤旺, 吴厚平, 等. 高压水热合成法制备纳米Co3O4粉末及其过程机理[J]. 粉末冶金材料科学与工程, 2009, 14(5): 306–309. |
| [10] | 郭学益, 易宇, 田庆华. 溶液雾化氧化法制备Co3O4粉末[J]. 北京科技大学学报, 2012, 34(3): 322–328. |
| [11] | 郭学益, 郭秋松, 冯庆明, 等. 溶液雾化氧化法制备超细Co3O4粒子及其性能表征[J]. 中南大学学报(自然科学版), 2010, 41(1): 60–66. |
| [12] |
CAO J Z, ZHAO Y C, YANG W, et al. Sol-gel preparation and characterization of Co3O4 nanocrystals[J].
Journal of University of Science and Technology Beijing, 2003(1): 54–57. |
| [13] | 韩丹丹, 景晓燕, 徐鹏程, 等. NiO微球的微波辅助合成及电荷传导能力优化[J]. 无机材料学报, 2016, 31(6): 667–672. |
| [14] | 周慧芬, 侯清麟, 衣冉, 等. 微波辅助液相合成花状氧化锌微晶[J]. 中南大学学报(自然科学版), 2011, 42(1): 67–72. |
| [15] | 黄子东, 张海燕, 陈易明, 等. 微波辅助合成石墨烯/氧化镍复合材料及其表征[J]. 无机化学学报, 2014, 30(3): 609–614. |
| [16] | 曾青云, 帅庚未, 张勇, 等. 微波外场对液相合成砂状氧化钇前驱体形貌的影响[J]. 有色金属科学与程, 2014, 5(3): 28–31. |
| [17] | 胡寒梅, 邓崇海, 朱绍峰, 等. 无模板微波辅助合成多孔氧化锌纳米球及其光致发光[J]. 功能材料, 2010, 41(10): 1796–1799. |
| [18] | 杜书青, 袁宇峰, 涂伟霞. 微波水热合成Zn2GeO4纳米带及其光催化活性[J]. 物理化学学报, 2013, 29(9): 2062–2068. |
 2017, Vol. 8
2017, Vol. 8


