| 钼酸钙酸分解热力学分析及其应用 |
1b. 桂林理工大学广西高校有色金属清洁冶炼与综合利用重点实验室,广西 桂林 541004;
2. 中南大学冶金与环境学院,长沙 410083
1b. Guangxi Key Laboratory in Universities of Clean Metallurgy and Comprehensive Utilization for Non-ferrous Metals Resources, Guilin University of Technology, Guilin 541004, China;
2. School of Metallurgy and Environment, Central South University, Changsha 410083, China
钼酸钙在自然界中多存在于辉钼矿床的氧化带,属于辉钼矿的次生矿.在实际的辉钼矿的石灰固硫焙烧料[1]、辉钼矿焙砂的氨浸渣[2-4]以及钼低品位资源和二次资源制备钼酸铵生产过程中钼可能以钼酸钙的形态存在[5-6].钼酸钙结构较为稳定,以钼酸钙为原料制备钼酸盐产品都需通过分解步骤.现有研究表明,碳酸钠、酸均能分解钼酸钙. XIA等[7]研究苏打分解钼酸钙的热力学行为,表明提高碳酸钠浓度有利于钼酸钙的分解.张刚等[8]研究表明,磷酸盐比碳酸钠更有利于钼酸钙的分解.宋建争等[9]采用质量浓度为12 %的碳酸钠溶液,在温度为80 ℃条件下浸出2 h,钼酸钙的浸出率达到99.7 %.盘茂森等[10]采用100 g/L的碳酸钠溶液,在温度为180 ℃,浸出1 h,低品位钼酸钙的分解率达到94 %. Singh等[11]以1~2 mol/L的硫酸溶液为浸出剂,在80~90 ℃浸出焙砂两次,每次2 h,钼的总浸出率达到99 %.邹振球等[12]采用5 %体积浓度的硫酸溶液浸出钼酸钙焙砂,控制液固比L/S=3 mL/g,温度为90 ℃浸出2 h,钼的浸出率达到98.5 %. Ilhan等[13-14]研究草酸分解钼酸钙的机理,发现分解产物CaC2O4对CaMoO4形成包裹,不利于钼酸钙分解的进行.上述研究结果表明:碳酸钠和酸均能够有效地分解钼酸钙,但前者需要采用过量碳酸钠和较高浸出温度才能有效分解钼酸钙,而酸分解钼酸钙可以在常压条件下进行,成本低,且随着从酸性浸出液中直接萃钼工艺的开发[15],使得酸分解工艺更具优势.硫酸分解钼酸钙工艺存在浸出渣量大,反应时间长,温度较高等不足.盐酸分解处理钼酸钙可能能够克服上述不足.因此文中对2种浸出剂分解钼酸钙的行为进行比较.
文中选取298 K时对应的热力学数据,计算硫酸、盐酸分解钼酸钙的热力学,并绘制相应条件下CaMoO4-H2SO4-H2O和CaMoO4-HCl-H2O的lgC-pH图,从热力学角度比较硫酸、盐酸分解钼酸钙的差异性,且通过实验进行验证,最终提出盐酸分解钼酸钙的工艺.
1 计算原理及实验 1.1 热力学数据处理与计算在CaMoO4-H2SO4/HCl-H2O系中,溶液中溶解态物质可能包括H+、OH-、MoO42-、H2MoO4(aq)、HMoO42-、MoO22+、MoO2(OH)+、Ca2+、Ca (OH)+、Ca (OH)2(aq)、H2SO4、HSO4-、SO42-、HCl、Cl-,可能存在的沉淀包括H2MoO4(S)、CaMoO4(S)、CaSO4(S).溶液中可能存在的平衡以及对应在298 K时平衡常数的对数lgK值列于表 1.
| 表1 CaMoO4-H2SO4/HCl-H2O系平衡反应与对应平衡常数 Table 1 Reactions and equilibrium constant of CaMoO4-H2SO4/HCl-H2O system |
 |
| 点击放大 |
设[Ca]T、[Mo]T、[S]T、[Cl]T分别为溶液中游离钙、钼、硫、氯的总浓度,“[]”为溶液中各游离组分的浓度,为了简化研究,过程均采用浓度代替活度.随着条件变化,过程可能产生沉淀体系中物质游离总浓度将变化,为了便于表达,设定溶液中某物质的初始浓度为“初始[A]”,则“初始[A]”=(游离态A物质的量+不溶态A物质的量)/溶液体积.
依据平衡原理,可以得到关系式 (1) ~式 (9).
| ${\left[ {{{\rm{H}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{{\rm{4(aq)}}}}} \right]{\rm{ = }}{{\left[ {{{\rm{H}}^{\rm{ + }}}} \right]}^{\rm{2}}}\left[ {{\rm{Mo}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}} \right]{\rm{/1}}{{\rm{0}}^{{\rm{ - 6}}{\rm{.85}}}}}$ | (1) |
| ${\left[ {{\rm{HMoO}}_4^ - } \right]{\rm{ = }}\left[ {{{\rm{H}}^{\rm{ + }}}} \right]\left[ {{\rm{MoO}}_4^{2 - }} \right]{\rm{/1}}{{\rm{0}}^{{\rm{ - 5}}{\rm{.01}}}}}$ | (2) |
| ${\left[ {{\rm{MoO}}_2^{2 + }} \right]{\rm{ = }}{{\left[ {{{\rm{H}}^{\rm{ + }}}} \right]}^{\rm{4}}}\left[ {{\rm{MoO}}_4^{2 - }} \right]{\rm{/1}}{{\rm{0}}^{{\rm{ - 8}}{\rm{.33}}}}}$ | (3) |
| ${\left[ {{\rm{Mo}}{{\rm{O}}_{\rm{2}}}{{\left( {{\rm{OH}}} \right)}^{\rm{ + }}}} \right]{\rm{ = }}{{\left[ {{{\rm{H}}^{\rm{ + }}}} \right]}^{\rm{3}}}\left[ {{\rm{MoO}}_4^{2 - }} \right]{\rm{/1}}{{\rm{0}}^{{\rm{ - 7}}{\rm{.88}}}}}$ | (4) |
| ${\left[ {{\rm{Ca}}{{\left( {{\rm{OH}}} \right)}_{{\rm{2(aq)}}}}} \right]{\rm{ = }}\left[ {{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}} \right]{{\left[ {{\rm{O}}{{\rm{H}}^{\rm{ - }}}} \right]}^{\rm{2}}}{\rm{\cdot1}}{{\rm{0}}^{{\rm{2}}{\rm{.77}}}}}$ | (5) |
| ${\left[ {{\rm{Ca}}{{\left( {{\rm{OH}}} \right)}^{\rm{ + }}}} \right]{\rm{ = }}\left[ {{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}} \right]\left[ {{\rm{O}}{{\rm{H}}^{\rm{ - }}}} \right]{\rm{\cdot1}}{{\rm{0}}^{{\rm{1}}{\rm{.4}}}}}$ | (6) |
| ${\left[ {{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right]{\rm{ = }}\left[ {{{\rm{H}}^{\rm{ + }}}} \right]\left[ {{\rm{HSO}}_4^ - } \right]{\rm{/1}}{{\rm{0}}^{\rm{3}}}}$ | (7) |
| ${\left[ {{\rm{HSO}}_4^ - } \right]{\rm{ = }}\left[ {{{\rm{H}}^{\rm{ + }}}} \right]\left[ {{\rm{SO}}_4^{2 - }} \right]{\rm{/1}}{{\rm{0}}^{{\rm{ - 1}}{\rm{.92}}}}}$ | (8) |
| ${\left[ {{\rm{HCl}}} \right]{\rm{ = }}\left[ {{{\rm{H}}^{\rm{ + }}}} \right]\left[ {{\rm{C}}{{\rm{l}}^{\rm{ - }}}} \right]{\rm{/1}}{{\rm{0}}^{\rm{8}}}}$ | (9) |
根据H2MoO4(s)、CaMoO4(s)、CaSO4(s)溶度积关系,可以分别得到关系式 (10) ~(12).
| ${{{\left[ {{{\rm{H}}^{\rm{ + }}}} \right]}^{\rm{2}}}\left[ {{\rm{MoO}}_4^{2 - }} \right]{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 13}}{\rm{.33}}}}}$ | (10) |
| ${\left[ {{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}} \right]\left[ {{\rm{MoO}}_4^{2 - }} \right]{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 8}}{\rm{.53}}}}}$ | (11) |
| ${\left[ {{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}} \right]\left[ {{\rm{SO}}_4^{2 - }} \right]{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 5}}{\rm{.04}}}}}$ | (12) |
CaMoO4-H2SO4-H2O系中存在的溶解平衡关系:在CaMoO4(s)稳定区存在[Ca2+]=[MoO42-],且满足式 (11);当CaMoO4(s)电离产生的[MoO42-]高于H2MoO4(s)电离产生的[MoO42-],则说明CaMoO4(s)转化为H2MoO4(s),此时体系[MoO42-]值满足式 (10);CaMoO4分解过程体系可能同时存在CaSO4(s)、CaMoO4(s)、H2MoO4(s),由于CaSO4(s)的溶度积远大于CaMoO4(s),[Ca2+]、[SO42-]关系满足式 (12),且[Ca2+]=[SO42-],据此可以计算出CaMoO4(s)完全被H2SO4分解的pH值.
CaMoO4-HCl-H2O系中存在的溶解平衡关系:CaMoO4(s)未分解时,处于CaMoO4(s)的稳定区,存在[Ca2+]=[MoO42-],且满足式 (11);CaMoO4(s)初始分解时,存在CaMoO4(s)、H2MoO4(s)故[Ca2+]、[MoO42-]、[H+]同时满足式 (10) ~(11),且[Ca2+]=[MoO42-],即可计算得出初始分解pH值和其他数量关系;CaMoO4(s)完全分解时,满足[Ca2+]=初始[CaMoO4],故在设定的初始[CaMoO4]值条件下,存在CaMoO4(s)完全分解时对应的[Ca2+],且[Ca2+]、[MoO42-]、[H+]同时满足式 (10) ~式 (11),且[Ca2+]=初始[CaMoO4],据此可以计算出对应的pH值和其他数值.
通过计算得出体系内各游离物质之间的对应关系,溶液中[Ca]T、[Mo]T、[S]T、[Cl]T值如下:
| $\begin{array}{l} \quad {\left[ {{\rm{Ca}}} \right]_{\rm{T}}}{\rm{ = [C}}{{\rm{a}}^{{\rm{2 + }}}}\left] {\rm{ + }} \right[{\rm{Ca}}{\left( {{\rm{OH}}} \right)^{\rm{ + }}}\left] {\rm{ + }} \right[{\rm{Ca}}{\left( {{\rm{OH}}} \right)_{{\rm{2(aq)}}}}{\rm{]}}\\ {\left[ {{\rm{Mo}}} \right]_{\rm{T}}}{\rm{ = }}\left[ {{\rm{MoO}}_4^{2 - }} \right]{\rm{ + [}}{{\rm{H}}_{\rm{2}}}{\rm{Mo}}{{\rm{O}}_{{\rm{4(aq)}}}}\left] {\rm{ + }} \right[{\rm{HMoO}}_4^ - \left] {\rm{ + }} \right[{\rm{MoO}}_2^{2 + }{\rm{] + }}\\ \quad \quad \quad \quad \quad \quad {\rm{[Mo}}{{\rm{O}}_{\rm{2}}}{\left( {{\rm{OH}}} \right)^{\rm{ + }}}{\rm{]}}\\ \quad \quad \quad \left[ {\rm{S}} \right]{\rm{T = }}\left[ {{\rm{SO}}_4^{2 - }} \right]{\rm{ + }}\left[ {{\rm{HSO}}_4^ - } \right]{\rm{ + [}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{]}}\\ \quad \quad \quad \quad \quad {\left[ {{\rm{Cl}}} \right]_{\rm{T}}}{\rm{ = [C}}{{\rm{l}}^{\rm{ - }}}\left] {\rm{ + }} \right[{\rm{HCl]}} \end{array}$ |
将计算数据绘制成图.
1.2 实验原料与方法浸出原料为某地辉钼矿石灰焙烧料,含水率约为0.05 %,主要化学成分为Mo 17.56 %,Ca 25.58 %,S 12.72 %,Si 2.88 %,Al 1.13 %,Fe 1.14 %.图 1所示为浸出原料XRD分析结果,表明主要物质组成为CaMoO4、CaSO4.浸出原料用于浸出实验的粒径为0.2~0.3 mm.
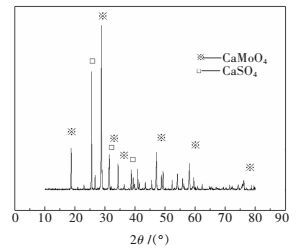 |
| 图 1 原料XRD分析 Fig. 1 XRD pattern of raw material |
实验采用浓酸与水配制成对应浓度的浸出剂,然后在设定的液固比、温度浸出一定时间,然后过滤、洗渣得到滤液和浸出渣.
浸出渣率η为浸出渣干重与原料的质量百分比;钼浸出率η指浸出液中钼质量与原料中钼质量百分比;浸出液中Ca浓度是将滤液中钙的总量除以浸出液体积所对应浓度.
钼分析方法:采用硫氰酸铵比色法;钙分析方法:ICP-AES.
2 结果与讨论 2.1 理论计算图 2表示CaMoO4-H2SO4-H2O系的溶解组分浓度与溶液pH值的关系.结果表明:pH在0~3.5时体系稳定存在为H2MoO4(s)、CaSO4(s),pH在3.5~4.5时为CaMoO4(s)分解区间,pH在4.5~7.0时为CaMoO4(s)稳定区;所研究的整个pH值范围,[Ca]T均保持在较低的值,说明钼酸钙分解过程钙极少进入溶液.从热力学计算过程可知,硫酸分解钼酸钙的过程可能包括CaMoO4(s)、CaSO4(s)、H2MoO4(s)3种物体物质的平衡,而CaSO4(s)、H2MoO4(s)与CaMoO4(s)的摩尔体积比分别为1.142(52.16/45.66)、1.136(51.86/45.66).说明分解过程钼酸钙表面容易被生成的CaSO4(s)、H2MoO4(s)包裹,实际操作时硫酸难以彻底的分解钼酸钙.实际操作时只要通过提高液固比、温度和采用适宜浸出酸度等条件下促进H2MoO4(s)溶解、扩散才能够提高硫酸分解钼酸钙的效率.
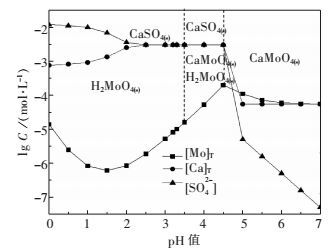 |
| 图 2 CaMoO4-H2SO4-H2O系溶解组分的lgC-pH关系(298 K) Fig. 2 lgC-pH diagram of a CaMoO4-H2SO4-H2O system at 298 K |
图 3表示初始[CaMoO4]为0.1 mol/L条件下,CaMoO4-HCl-H2O系溶解组分的浓度与pH值的关系.结果表明:pH在0~2.9时为H2MoO4(s)稳定区,pH在2.9~4.5时为CaMoO4(s)的分解区,pH在4.5~7.0时为CaMoO4(s)稳定区.图 4表明,随着初始CaMoO4浓度的增加,初始分解pH值不变,而分解终点pH值降低,这是由于对应终点[Ca2+]浓度增加,抑制了钼酸钙的分解.当初始[CaMoO4]浓度分别为0.1 mol/L、0.5 mol/L、1.0 mol/L时,彻底分解pH值分别为2.90、2.60、2.55.随着钼酸钙分解的进行溶液中钙浓度随之升高.盐酸分解钼酸钙只可能形成H2MoO4(s)包裹,通过提高酸度和浸出液固比可显著提高H2MoO4(s)在盐酸中溶解度[18],使得浸出传质阻力明显减少,从而提高钼酸钙的分解效率.
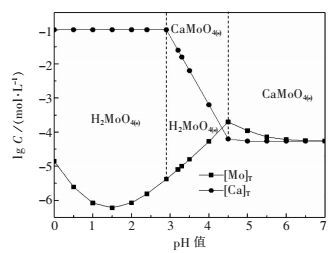 |
| 图 3 CaMoO4-HCl-H2O系溶解组分的lgC-pH关系(初始[CaMoO4]=0.1 mol/L) Fig. 3 lgC-pH diagram of a CaMoO4-HCl-H2O system at 298 K (initial[CaMoO4]=0.1 mol/L) |
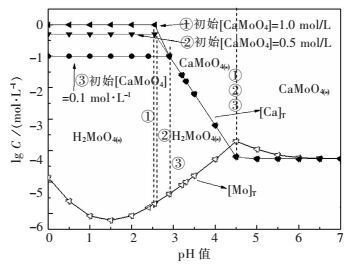 |
| 图 4 初始钼酸钙浓度对盐酸分解的影响 Fig. 4 Effect of initial[CaMoO4] on decomposition of CaMoO4 with HCl |
对CaMoO4-H2SO4/HCl-H2O系分析表明:硫酸、盐酸均能够在较低的酸度下分解钼酸钙;硫酸分解钼酸钙时,钙极少进入浸出液中,虽然通过调整浸出条件促进钼酸溶解,能缓解钼酸包裹,但硫酸钙包裹则难以避免,可能不利于实际操作时钼酸钙的彻底分解;盐酸分解时,通过控制浸出条件将钼酸溶解进入溶液,则可以避免浸出过程存在包裹现象,利于浸出的进行.
2.2 验证实验图 5表示浸出液固比VL /WS=10 mL/g,温度为25 ℃,时间为1 h,含不同氢离子浓度的硫酸或盐酸浸出钼酸钙的区别,实线表示盐酸浸出,虚线表示硫酸浸出数据.实验结果表明,随着浸出剂中氢离子浓度的增加,钼的浸出率均增大;同等酸度下,盐酸对钼的浸出效果优于硫酸;硫酸浸出时,溶液中钙浓度基本保持在2 g/L,盐酸浸出时,溶液中钙的浓度可达到11.945 g/L;硫酸、盐酸浸出的渣率分别为94 %、40 %,说明硫酸浸出时钙基本保留在渣中,而盐酸将部分钙溶解至溶液中,这与热力学分析结论一致.
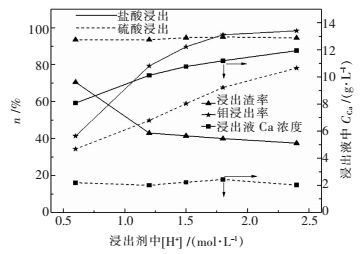 |
| 图 5 浸出剂酸度对浸出的影响 Fig. 5 Effect of acidity on leaching |
图 6表示浸出剂[H+]为2.4 mol/L的稀盐酸或硫酸,VL /WS=10 mL/g,于25 ℃浸出设定的时间.结果表明,硫酸浸出120 min,钼的浸出率为85.38 %;盐酸浸出15 min,钼的浸出率达到92.30 %,45 min时达到98.56 %,说明盐酸浸出钼的速率和浸出率均优于硫酸,与理论分析结论保持一致;硫酸浸出时,随着浸出时间的延长,钙的溶出量减少,而采用盐酸浸出时钙的溶出量随着时间的增大而增多.
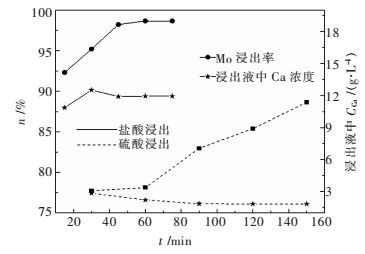 |
| 图 6 反应时间对浸出的影响 Fig. 6 Effect of reaction time on leaching |
验证实验表明,硫酸浸出速度慢于盐酸,同等酸度下浸出率低于盐酸;盐酸浸出钙溶出率高,而硫酸浸出钙溶出量低.验证实验结果与热力学模型推论相符.采用HCl浓度为2.4 mol/L的稀盐酸,VL /WS=10 mL/g,25 ℃浸出45 min,钼的浸出率达到98.56 %,说明盐酸适宜作为钼酸钙的浸出剂.
3 结论1) CaMoO4-H2SO4-H2O系的热力学分析结果表明,pH在0~3.5时为H2MoO4(s)、CaSO4(s)稳定区,pH在3.5~4.5时为H2MoO4(s)、CaSO4(s)、CaMoO4(s)稳定区,pH在4.5~7.0时为CaMoO4(s)稳定区;整个研究pH值范围,[Ca]T浓度较低,说明钼酸钙被分解为钼酸和硫酸钙,钙极少进入溶液.
2) CaMoO4-HCl-H2O系的热力学分析结果表明,pH在0~2.9时为H2MoO4(s)稳定区,pH在2.9~4.5时为CaMoO4(s)的分解区,pH在4.5~7.0时为CaMoO4(s)稳定区;[Ca]T浓度随着钼酸钙分解的进行而升高,最终钙完全进入溶液.
3) 相比于硫酸,盐酸分解钼酸钙产物与原料的摩尔体积值小,产物对钼酸钙包裹较少,有利于浸出.
4) 验证实验表明,硫酸浸出液中钙浓度不随钼浸出率变化,盐酸浸出液中钙浓度随钼浸出率升高而增大;盐酸对钼酸钙的浸出率和浸出速率均优于硫酸,采用HCl浓度为2.4 mol/L的稀盐酸,VL /WS=10 mL/g,25 ℃浸出45 min,钼的浸出率达到98.56 %.
| [1] | 常宝乾, 徐彪, 李营生, 等. 钼精矿固化焙烧-树脂交换法回收铼的工艺研究[J]. 矿产综合利用, 2011(4): 22–25. |
| [2] | 甘敏, 曾金林, 范晓慧, 等. HNO3/NH4NO3预处理工艺强化低钼焙砂浸出[J]. 中国有色金属学报, 2016, 26(2): 471–476. |
| [3] | 甘敏, 范晓慧, 张麟, 等. 低品位钼精矿氧化焙烧过程的反应行为[J]. 中国有色金属学报, 2014, 24(12): 3115–3122. |
| [4] |
JUAN Y U, YANG H Y, CHEN Y J. Extraction of molybdenum from low-grade molybdenum concentrates[J].
Journal of Northeastern University, 2011, 32(8): 1141–1144. |
| [5] | 胡磊, 肖连生, 张贵清, 等. 从高杂质低品位钼焙砂中苏打高压浸出钼的实验研究[J]. 矿冶工程, 2012, 32(6): 66–70. |
| [6] | 秦文峰, 彭金辉, 樊希安, 等. 利用钼酸钙废物制取钼酸铵的新工艺[J]. 矿产综合利用, 2003(1): 46–48. |
| [7] |
XIA W T, ZHAO Z W, LI H G. Thermodynamic analysis on sodium carbonate decomposition of calcium molybdenum[J].
Transactions of Nonferrous Metals Society of China, 2007, 17(3): 622–625. DOI: 10.1016/S1003-6326(07)60145-9. |
| [8] | 张刚, 赵中伟, 曹才放, 等. 磷酸盐分解钼酸钙的热力学[J]. 北京科技大学学报, 2009, 31(11): 1394–1399. DOI: 10.3321/j.issn:1001-053X.2009.11.009. |
| [9] | 宋建争, 张永强. 碳酸钠溶液浸取钼酸钙的实验研究[J]. 河北化工, 2008(10): 14–16. DOI: 10.3969/j.issn.1003-5059.2008.10.006. |
| [10] | 盘茂森, 朱云. 高压浸出钼酸钙中钼的实验研究[J]. 中国钼业, 2005, 29(6): 19–21. |
| [11] |
SINGH S, CHETTY M K, JUNEJA J M, et al. Studies on the processing of a low grade molybdenite concentrate by lime roasting[J].
Minerals Engineering, 1988, 1(4): 337–342. DOI: 10.1016/0892-6875(88)90023-4. |
| [12] | 邹振球, 周勤俭. 钼精矿石灰焙烧-N235萃取工艺提取钼铼[J]. 矿冶工程, 2002, 22(1): 79–84. |
| [13] |
ILHAN S, KALPAKLI A O, KAHRUMAN C, et al. The use of Langmuir-Hinshelwood mechanism to explain the kinetics of calcium molybdate leaching in oxalic acid solution[J].
Hydrome-tallurgy, 2012, 127/128(18): 91–98. |
| [14] |
ILHAN S, KALPAKLI A O, KAHRUMAN C, et al. The use of oxalic acid as a chelating agent in the dissolution reaction of calcium molybdate[J].
Metallurgical & Materials Transactions B, 2013, 44(3): 495–505. |
| [15] |
XIA Y, XIAO L, XIAO C, et al. Direct solvent extraction of molybdenum (VI) from sulfuric acid leach solutions using PC-88A[J].
Hydrometallurgy, 2015(158): 114–118. |
| [16] | KOTRLÝ S, ŠUCHA L. Handbook of chemical equilibria in analytical chemistry[M]. Chichester: Ellis Horwood Limited, 1985. |
| [17] | JOHN A DEAN. LANGE's handbook of chemistry[M]. Fifteenth Edition. New York: McGRAW-HILL, INC, 1999: 1185-1261. |
| [18] |
BAILIN L J, JONASSEN H B. The solubility of molybdenum trioxide in various mineral acids[J].
Journal of Inorganic and Nuclear Chemistry, 1963, 25(1): 99–102. DOI: 10.1016/0022-1902(63)80214-6. |
 2017, Vol. 8
2017, Vol. 8


