| n-NdF3制备、表征及对尿酸的电化学检定 |
尿酸(UA),又名7,9-二氢-2,6,8(3H)三酮-1H-嘌呤,人体血液和尿液中的重要生物分子[1-2],是内嘌呤和核苷酸代谢的产物.健康人血液及尿液中含量的正常值分别为0.24~0.52 mmol/L和1.49~4.46 mmol/L [3],在体内浓度和生物化学性质的异常变化会导致嘌呤代谢紊乱,直接影响着身体机能的好坏,当体内新陈代谢的尿酸过多而排放太少时就会在体内大量聚集,超过一定范围就会引起相应的症状,如痛风、肾功能衰竭、白血病以及Lesch-Nyhan综合征等多种疾病[4],同样当体内UA含量过低时也会引起相应的病症,如恶性贫血等[5].因此,准确分析和检定尿酸的含量以便及时针对病情做出相应诊断具有非常重大意义,现在对体内UA浓度的检定也已成为临床医学检验项目之一[6-7].截至目前检定UA的方法已有多种,如分光光度测定法[8]、高效液相色谱法[9]和电化学分析法等.其中电化学分析法相比其他检定方法具有更简便、易操作和灵敏度高等优点,得到更为广泛的应用[10].但是在电化学分析法测量过程中存在着一个难题,就是生物样品中UA通常会和DA混在一起,UA和DA的氧化峰电位非常接近,共存的情况下会造成相互干扰,循环伏安响应信号会有重叠不利于将UA准确的检定出来[11-12],所以在DA存在的情况下,高灵敏度准确检定UA含量成为生物分析中的一个重要任务,制备一种生物传感器准确分开UA和DA成为当前研究领域的热点[13-16].
氟元素是当前化学元素周期表中电负性最大的元素,除惰性气体He以外几乎能与所有元素发生化学反应,所以制备的氟化物会有多样性的物理化学性质[17].基于氟化物具有这种多样性的物化性质,所以氟化物在多个领域及学科得到广泛应用,比如光学、电学和磁学等领域[18].稀土元素原子结构特殊,内层4f轨道未成对的电子数较多,电子能级丰富,与氟元素一样,几乎也可以与所有元素发生化学反应,具备其他元素所不具备的优良特性,素有“现代工业维生素”等美誉[19-20].纳米材料是晶体颗粒尺寸在100 nm以内的新型材料,具有尺寸小、表面积大和吸附能力强等许多优点[21-23].稀土纳米材料将稀土和纳米材料独特性能融于一体,兼备稀土非纳米材料和非稀土纳米材料的优点.当前稀土纳米材料也已得到应用,如应用到永磁材料、陶瓷和环保材料等多个领域,近年来又将稀土纳米材料应用到生物领域,制备生物传感器,取得较大的研究进展[24].在生物应用领域,相比于其他的纳米材料而言,稀土氟化物纳米材料具有极为突出的优势,将其应用到生物传感器能加快生物分子在电极上的电子传递速率,这在有关文献均有报道[25-26].n-NdF3具有好的光学性能,在光学以及近红外荧光探针等方面有广泛的应用[27].其制备方法主要有水热法、微波法和静电纺丝法等,如Yu等[28]采用微波法合成不同形貌的n-NdF3.但是,对n-NdF3应用于生物传感研究,笔者还未查阅到相关报道.
文章将制备n-NdF3并组装到玻碳电极表面,用于构建一种基于n-NdF3修饰电极的生物传感器.利用扫描电子显微镜(SEM)、X-射线衍射(XRD)以及能谱分析(EDS)对n-NdF3进行表征,同时利用CV和EIS对n-NdF3/GCE固定过程、电化学行为和电催化能力进行研究.研究表明,在DA与UA共存的情况下,出现分离效果较好的2个氧化峰,并未因DA的存在而影响对UA的测定.说明n-NdF3/GCE可以作为高灵敏度和高选择性生物传感器检定UA,峰电流值与UA浓度在0.05~1.0 mmol/L范围内呈现出良好的线性关系.
1 实验 1.1 试剂与仪器实验试剂:Nd2O3(AR, 99.99 %)购于上海同纳环保科技有限公司;盐酸(AR, 37 %)购于广州市东红化工厂;NaF(GR, 99.0 %)购于国药集团工业股份有限公司;Na2HPO4(GR, 99.0 %)、NaH2PO4(GR, 99.0 %)、KCl(GR, 99.8 %)、K3[Fe (CN)6](AR, 99.5 %)和K4[Fe (CN)6](AR, 99.5 %)均购于国药集团工业股份有限公司;无水乙醇(AR, 99.7 %)购于上海展云化工有限公司;多巴胺(DA)和尿酸(UA)均购于Sigma公司;2 mmol/L铁氰化钾溶液由K3[Fe (CN)6]和K4[Fe (CN)6]配制,支持电解质为0.1 mol/L KCl;磷酸缓冲溶液(PBS)由Na2HPO4和NaH2PO4配制,支持电解质为0.1 mol/L KCl;试验中所有溶液的配制均使用超纯水.
实验仪器:粉末X射线衍射仪(Cu靶Kα1辐射的PANalytical X’Pert Pro);扫描电子显微镜(SEM)和电子能谱(EDS)仪(Philips XL30);CHI660D型电化学工作站(上海辰华仪器有限公司);电化学阻抗仪Autolab PGSTAT12 (Ecochemie, BV, 荷兰);电化学测试采用三电极体系,玻碳电极作为工作电极(Φ=4 mm),饱和KCl甘汞电极作为参比电极,铂丝电极为对电极.
1.2 n-NdF3的合成及修饰电极制备n-NdF3的制备[29]如下:称取0.1 mmol的Nd2O3固体粉末加入一定量稀盐酸磁力搅拌使其溶解,然后加入0.6 mmol的NaF固体,待溶液生成胶状沉淀后,加入10 %的NaOH溶液调节pH值约为4至5,30 min小时后将溶液移至50 mL的聚四氟乙烯反应釜,100 ℃下反应20 h.离心水洗干燥备用.
n-NdF3溶液的配制:取上述一定量制备好的n-NdF3用超纯水分散至1 mg/mL溶液,超声30 min,使其完全分散均匀,备用.电极的处理:将玻碳电极分别用0.3 μm、0.05 μm和1.0 μm的α-Al2O3粉末在抛光绒布上抛光,然后依次用超纯水和乙醇洗涤5 min除去电极表面的污物,然后于含有0.1 mol/L KCl的2 mmol/L Fe (CN)63-/4-溶液中在-0.1~0.5 V的电位范围内进行CV扫描数圈后用高纯氮气将表面吹干,移取10 μL的n-NdF3溶液滴到电极表面在室温下过夜干燥,即可得到n-NdF3/GCE生物传感器.
2 结果与讨论 2.1 n-NdF3样品的表征用SEM对n-NdF3样品进行表征,结果如图 1所示.从图 1中可以看出n-NdF3呈现出均匀的球体形状,在高倍率下可以观察到它的直径约为100 nm.
 |
| 图 1 n-NdF3的扫描电镜像 Fig. 1 SEM image of n-NdF3 |
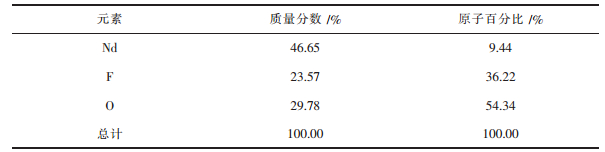
图 2(a)所示为n-NdF3的XRD谱,与标准卡片库01-078-1859衍射峰对应一致,说明该材料为NdF3;图 2(b)为n-NdF3的EDS能谱,利用能谱分析仪对制备的材料进行EDS分析,确定可能存在的化合物及其元素,由图 2(b)和表 1可知,制备的材料存在含有Nd、F和O 3种元素的相且Nd和F元素含量较大,由于空气中较多的有机物存在,导致样品表面吸附一定量的有机物,从而会有O元素存在.综合XRD谱可以推断其中物质为NdF3的相.
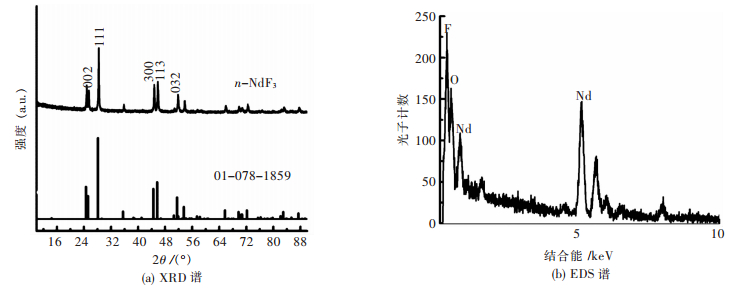 |
| 图 2 n-NdF3样品的表征 Fig. 2 Characterization of n-NdF3 samples |
| 表1 n-NdF3样品的能谱分析数据 Table 1 Energy spectrum analysis results of n-NdF3 samples |
 |
| 点击放大 |
2.2 不同修饰电极CV图及EIS图
分别采用CV和EIS研究不同修饰电极的电化学行为.图 3(a)Fe (CN)63-/4-在裸玻碳电极表面发生可逆的氧化还原反应,出现一对明显的氧化还原峰.当电极表面修饰上n-NdF3后,氧化还原峰降低,电位差值变大.这是因为n-NdF3阻碍了Fe (CN)63-/4-在电极表面电子的转移,说明n-NdF3已成功修饰到玻碳电极表面. EIS是检验电极表面是否修饰成功的一种灵敏的检定技术,EIS曲线可以半圆部分的直径获得阻抗值(Ret)[30].将裸玻碳电极和n-NdF3/GCE在含有0.1 mol/L KCl的2 mmol/L Fe (CN)63-/4-溶液中用EIS进行电化学表征得到的曲线如图 3(b)所示.随着电极表面修饰物的不同,电子传递电阻发生明显变化,裸玻碳电极在Fe (CN)63-/4-溶液中半圆的直径较小,说明Fe (CN)63-/4-在裸玻碳电极表面所受的电子迁移阻力较小,有较好的导电性能.当电极表面修饰n-NdF3之后,半径增大即电阻增大,电阻值约为400 Ω,说明Fe (CN)63-/4-在该电极上的电子迁移能力受到抑制,阻碍Fe (CN)63-/4-的电子在该修饰电极上的电子转移.进一步证明n-NdF3已经成功修饰到玻碳电极表面,n-NdF3可以应用到生物传感器的构建中. 2.3 n-NdF3/GCE的电化学行为
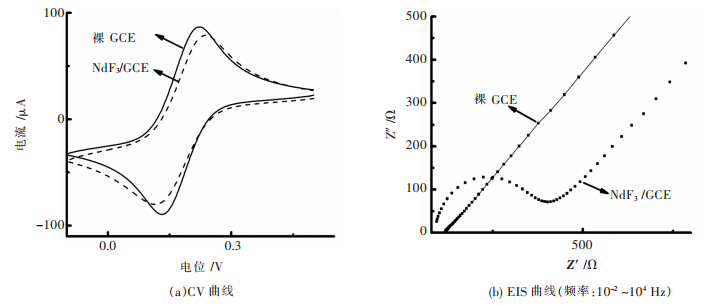 |
| 图 3 含有0.1 mol/L KCl的2 mmol/L Fe (CN)63-/4-电解质溶液不同修饰电极电化学行为 Fig. 3 Electrochemical behaviors of different modified electrodes. Supporting electrolyte solution: 2 mmol/L Fe (CN)63-/4- aqueous solution containing 0.1 mol/L KCl |
2.3.1 扫描速率对修饰电极的电化学影响
为探究n-NdF3/GCE氧化还原过程中的动力学特征,在含有0.1 mol/L KCl的2 mmol/L Fe (CN)63-/4-溶液中对该电极通过改变扫描速度的方法对其进行循环伏安实验,结果如图 4(a)所示.n-NdF3/GCE在-0.1 V到0.5 V之间出现的一对明显的氧化还原峰,并且是随着v的不断增大,Ip也在不断增加,氧化峰电位向电位正方向移动.当v < 300 mV/s时,Ip与v成正相关,结果如图 4(b)所示,其中氧化峰Ip=0.003v + 0.516,相关系数R=0.98;还原峰Ip=-0.003v -0.492,相关系数R=0.978(两式中Ip单位为μA,v单位为mV/s).因此这是一个表面控制过程,并且n-NdF3在电极表面上电子转移速度很快.
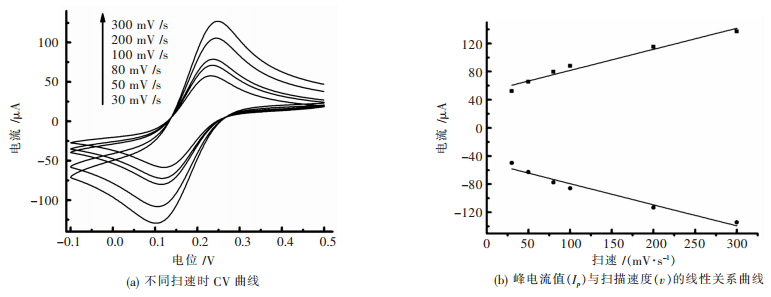 |
| 图 4 含有0.1 mol/L KCl的2 mmol/L Fe (CN)63-/4-电解质溶液n-NdF3/GCE的循环伏安电化学行为 Fig. 4 Cyclic voltammograms of n-NdF3/GCE. Supporting electrolyte solution: 2 mmol/L Fe (CN)63-/4- aqueous solution containing 0.1 mol/L KCl |
2.3.2 UA在不同电极上的电化学响应
据文献[31-32]报道,UA在不同电极上存在电化学响应.将制备好的n-NdF3/GCE和裸玻碳电极分别放入含有0.5 mmol/L UA的PBS缓冲溶液中进行CV测定,结果如图 5(a)所示.可以看出在含有0.5 mmol/L UA的PBS溶液中n-NdF3/GCE背景电流高于裸玻碳电极,裸玻碳电极只有较小的氧化峰出现,而n-NdF3/GCE则表现出一个较大峰电流的氧化峰.说明n-NdF3具有良好的电催化性能,可以有效提高UA在电极表面的电子迁移能力.为了考查制备的该生物传感器对UA的灵敏性,配制不同浓度的UA溶液,采用CV对其检定,结果如图 5(b)所示.随着UA浓度从0~1.0 mmol/L依次增加时,UA的氧化峰电流不断增大,峰电流与其浓度呈现较好的线性关系.线性方程如下:Ip=24.34CUA-0.87(其中Ip单位为μA,CUA单位为mmol/L),氧化峰电流相关系数R=0.992 2.
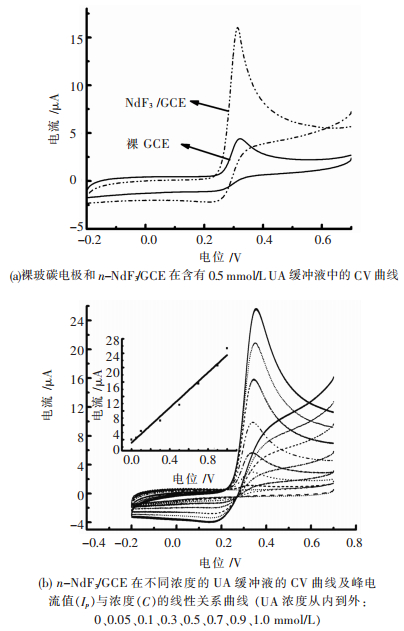 |
| 图 5 UA在不同电极上的电化学响应(缓冲液:0.1 mol/L PBS,pH=7.0,扫速:100 mV/s) Fig. 5 Cyclic voltammograms of UA on different electrodes. Supporting electrolyte solution: 0.1 mol/L PBS solution, pH=7.0, scan rate: 100 mV/s |
2.3.3 DA存在下n-NdF3/GCE对UA的电化学检定
干扰UA电化学信号的主要是DA,因此对于n-NdF3/GCE检定UA需要避免DA的干扰.基于此,配制不同浓度的DA和UA标准溶液,采用CV利用制备好的n-NdF3/GCE对UA进行干扰测定,结果如图 6所示.随着DA和UA浓度的不断增加,UA和DA相对应的氧化峰电流也呈现出增加的趋势,并且两者的氧化峰电位也在不断加大,出现分离效果较好的2个氧化峰,能够将两者很好的分离.不会因为DA浓度的增加而影响UA在n-NdF3/GCE上电化学响应信号,实验结果表明制备的n-NdF3/GCE生物传感器能在DA和UA共存的情况下不影响对UA的测定.
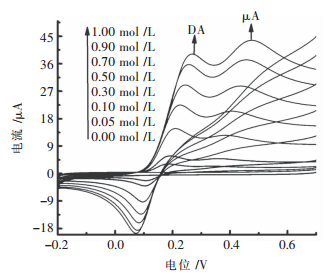 |
| 图 6 n-NdF3/GCE含有不同浓度UA和DA缓冲液中的CV曲线(缓冲液:0.1 mol/L PBS,pH=7.0,扫速:100 mV/s) Fig. 6 Cyclic voltammograms of the n-NdF3/GCE on different concentrations of UA and DA. Supporting electrolyte solution: 0.1 mol/L PBS solution, pH=7.0, scan rates: 100 mV/s |
3 结论
通过水热方法制备n-NdF3并将其修饰到玻碳电极用于对UA的电化学检定.实验证明当n-NdF3修饰的玻碳电极与裸电极比较时,对UA氧化催化具有较好的电催化能力.n-NdF3修饰的玻碳电极在UA是具有线性范围广和响应速度快等优点.此外,将该电极作为一种生物传感器用于在DA共存的情况下检定UA,不会影响对UA的测定,可用于在两者共存的情况下很好地检定UA,并且能明显的区分开来.实验为生物分子UA电化学生物传感器的研制提供一种简单可靠的方法,有望今后应用到实际样品的检定中.
| [1] |
KANNAN P, ABRAHAM JOHN S. Determination of nanomolar uric and ascorbic acids using enlarged gold nanoparticles modified electrode[J].
Analytical Biochemistry, 2009, 386(1): 65–72. DOI: 10.1016/j.ab.2008.11.043. |
| [2] |
ZOU H L, LI B L, LUO H Q, et al. A novel electrochemical biosensor based on hemin functionalized graphene oxide sheets for simultaneous determination of ascorbic acid, dopamine and uric acid[J].
Sensors and Actuators B: Chemical, 2015, 207(part A): 535–541. |
| [3] |
PRAKASH S, CHAKRABARTY T, MICHAEL RAJESH A, et al. Investigation of polyelectrolyte for electrochemical detection of uric acid in presence of ascorbic acid[J].
Measurement, 2012, 45(3): 500–506. DOI: 10.1016/j.measurement.2011.10.022. |
| [4] |
ZHAO Y F, GAO Y Q, ZHAN D P, et al. Selective detection of dopamine in the presence of ascorbic acid and uric acid by a carbon nanotubes-ionic liquid gel modified electrode[J].
Talanta, 2005, 66(1): 51–57. DOI: 10.1016/j.talanta.2004.09.019. |
| [5] |
MALLESHA M, MANJUNATHA R, NETHRAVATHI C, et al. Functionalized-graphene modified graphite electrode for the selective determination of dopamine in presence of uric acid and ascorbic acid[J].
Bioelectrochemistry, 2011, 81(2): 104–108. DOI: 10.1016/j.bioelechem.2011.03.004. |
| [6] |
HUANG S H, LIAO H H, CHEN D H. Simultaneous determination of norepinephrine, uric acid, and ascorbic acid at a screen printed carbon electrode modified with polyacrylic acid-coated multi-wall carbon nanotubes[J].
Biosensors and Bioelectronics, 2010, 25(10): 2351–2355. DOI: 10.1016/j.bios.2010.03.028. |
| [7] |
DU J, YUE R R, YAO Z Q, et al. Nonenzymatic uric acid electrochemical sensor based on graphene-modified carbon fiber electrode[J].
Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 419(20): 94–99. |
| [8] |
YAMAGUCHI T, HASEGAWA K, KAMINO S, et al. Spectrophotometric determination of uric acid based on fading of o-hydroxyhydroquinonephthalein-palladium (Ⅱ)-hexadecyltrimethyl-ammonium complex[J].
Analytical Sciences, 2007, 23(2): 223–226. DOI: 10.2116/analsci.23.223. |
| [9] |
COOPER N, KHOSRAVAN R, ERDMANN C, et al. Quantification of uric acid, xanthine and hypoxanthine in human serum by HPLC for pharmacodynamic studies[J].
Journal of Chromatography B, 2006, 837(1-2): 1–10. DOI: 10.1016/j.jchromb.2006.02.060. |
| [10] |
LI Q Z, QIN X Y, LUO Y L, et al. One-pot synthesis of Ag nanoparticles/reduced graphene oxide nanocomposites and their application for nonenzymatic H2O2 detection[J].
Electrochimica Acta, 2012, 83: 283–287. DOI: 10.1016/j.electacta.2012.08.007. |
| [11] |
ZHANG X, MA L X, ZHANG Y C. Electrodeposition of platinum nanosheets on C60 decorated glassy carbon electrode as a stable electrochemical biosensor for simultaneous detection of ascorbic acid, dopamine and uric acid[J].
Electrochimica Acta, 2015, 177: 118–127. DOI: 10.1016/j.electacta.2015.01.202. |
| [12] |
XIAO C H, CHU X C, YANG Y, et al. Hollow nitrogen-doped carbon microspheres pyrolyzed from self-polymerized dopamine and its application in simultaneous electrochemical determination of uric acid, ascorbic acid and dopamine[J].
Biosensors and Bioelectronics, 2011, 26(6): 2934–2939. DOI: 10.1016/j.bios.2010.11.041. |
| [13] | 刘晓颖, 兰国华, 曾宪冬, 等. DNA-碳纳米管/聚苯胺复合膜选择性测定多巴胺[J]. 化学传感器, 2009, 29(4): 44–47. |
| [14] |
WANG C, LI J, SHI K Y, et al. Graphene coated by polydopamine/multi-walled carbon nanotubesmodified electrode for highly selective detection of dopamine and uric acid in the presence of ascorbic acid[J].
Journal of Electroanalytical Chemistry, 2016, 770: 56–61. DOI: 10.1016/j.jelechem.2016.03.038. |
| [15] |
SUN J Y, LI L B, ZHANG X P, et al. Simultaneous determination of ascorbic acid, dopamine and uric acid at a nitrogen-doped carbon nanofiber modified electrode[J].
RSC Advances, 2015(5): 11925–11932. |
| [16] |
ZHAO D Y, YU G L, TIAN K L, et al. A highly sensitive and stable electrochemical sensor for simultaneous detection towards ascorbic acid, dopamine, and uric acid based on the hierarchical nanoporous PtTi alloy[J].
Biosensors and Bioelectronics, 2016, 82: 119–126. DOI: 10.1016/j.bios.2016.03.074. |
| [17] | 程时远, 陈艳军, 王康丽. 含氟丙烯酸酯三元共聚物乳液的研究[J]. 高分子学报, 2002(5): 560–565. |
| [18] |
LI C X, LIN J. Rare earth fluoride nano-/microcrystals: synthesis, surface modification and application[J].
Journal of Materials Chemistry, 2010, 20: 6831–6847. DOI: 10.1039/c0jm00031k. |
| [19] | 曹铁平, 李跃军. 稀土纳米材料的特性与应用[J]. 长春师范大学学报, 2007, 26(3): 54–57. |
| [20] | 董飘平, 谢欣荣, 梁福永, 等. 稀土有机框架材料(Ln-MOFs) 的合成及应用[J]. 有色金属科学与工程, 2016, 7(3): 137–150. |
| [21] | 周颖, 王成云. 稀土纳米材料研究进展[J]. 深圳大学学报, 2000, 17(4): 68–73. |
| [22] |
HUANG S G, LI L, VLEUGELS J, et al. Thermodynamic prediction of the nonstoichiometric phase Zr1-zCezO2-x in the ZrO2-CeO1.5-CeO2 system[J].
Journal of the European Ceramic Society, 2003, 23(1): 99–106. DOI: 10.1016/S0955-2219(02)00073-0. |
| [23] |
WILLNER I, WILLNER B, KATZ E. Biomolecule-nanoparticle hybrid systems for bioelectronic applications[J].
Bioelectroche-mistry, 2007, 70(1): 2–11. DOI: 10.1016/j.bioelechem.2006.03.013. |
| [24] |
DONG X, QU X, HONG G, et al. Preparation and application in electrochemistry of nanocrystalline CeO2[J].
Chinese Science Bulletin, 1996, 41(16): 1396–1401. |
| [25] |
LI F, LI C, LIU X, et al. Microwave-assisted synthesis and updown conversion luminescent properties of multicolor hydrophilic La F3:Ln3+ nanocrystals[J].
Dalton Transactions, 2013, 42(6): 2015–2022. DOI: 10.1039/C2DT32295A. |
| [26] |
WONG H T, VETRONE F, NACCACHE R, et al. Water dispersible ultra-small multifunctional KGd F4:Tm3+, Yb3+ nanop-articles with near-infrared to near-infrared upconversion[J].
Journal of Materials Chemistry, 2011, 21(41): 16589–16596. DOI: 10.1039/c1jm12796a. |
| [27] | 刘龙平, 李东永. 氟化稀土制备技术及市场分析[J]. 化工生产与技术, 2013, 20(6): 15–19. |
| [28] |
YU S X, CAO R J, LI J, et al. Controlled synthesis of NdF3 and NaNdF4 micro-or nanocrystals by one-pot microwave-assisted hydrothermal reaction[J].
Journal of Fluorine Chemistry, 2015, 178: 286–290. DOI: 10.1016/j.jfluchem.2015.08.009. |
| [29] | 侯远, 董相廷, 王进贤, 等. 稀土氟化物微纳米材料制备方法的研究进展[J]. 中国稀土学报, 2010, 28(5): 515–524. |
| [30] | 岳伟超, 蔡摇卓, 蒋翠文, 等. 生物合成纳米金与MWCNTs/L-Cys复合修饰玻碳电极测定左旋多巴[J]. 高等学校化学学报, 2014, 35(2): 250–256. |
| [31] |
SUN C L, LEE H H, YANG J M, et al. The simultaneous electrochemical detection of ascorbic acid, dopamine, and uric acid using graphene/size-selected Pt nanocomposites[J].
Biosensors and Bioelectronics, 2011, 26(8): 3450–3455. DOI: 10.1016/j.bios.2011.01.023. |
| [32] |
LI F H, CHAI J, YANG H F, et al. Synthesis of Pt/ionic liquid/graphene nanocomposite and its simultaneous determination of ascorbic acid and dopamine[J].
Talanta, 2010, 81(3): 1063–1068. DOI: 10.1016/j.talanta.2010.01.061. |
 2017, Vol. 8
2017, Vol. 8


