| 溶胶-凝胶制备ZnTiO3粉体及其表征 |
随着移动通信和卫星通信技术的迅猛发展,高性能微波介质陶瓷已成为当今材料领域的研究重点之一.钛酸锌是一种重要的钛铁矿微波介质材料,曾被作为颜料、吸附剂、催化剂以及发光材料等使用[1-3].在钛酸锌(ZnO-TiO2) 体系中,一般认为存在3种相:立方Zn2TiO4相,立方ZnTiO3相和六方ZnTiO3相[4].Zn2TiO4是面心立方尖晶石结构,为热力学最稳定相,制备容易.立方ZnTiO3在很多文献中以Zn2Ti3O8形式出现,是六方ZnTiO3的低温(820 ℃以下) 存在形式,在高温下会转变为六方ZnTiO3相.事实上,国际衍射数据中心(ICDD) 的Zn2Ti3O8的谱图(ICDD PDF 13-0471) 在1987年已被Yamaguchi等[5]测定的立方ZnTiO3谱图(ICDD PDF 39-0190) 取代,其晶体结构同Zn2TiO4非常相似,不易区分. ZnTiO3属于钛铁矿型六方晶体结构,具有优良的介电性能,使其在微波介质材料方面具有广阔的应用前景[6-8].但六方ZnTiO3相在945 ℃左右易分解为立方Zn2TiO4和金红石型TiO2,极大地影响了陶瓷的微波介电性能.随着微波电路集成化、小型化的要求,加之三相之间转变复杂[9-10],使得纯六方钛铁矿相ZnTiO3粉体的制备成为人们研究的热点.
传统的陶瓷粉体一般采用固相法高温煅烧制备,该法工艺简单,生产成本低[11-12].但该法合成六方ZnTiO3相极易分解,且存在组分不均匀,粒度分布宽,粉体纯度低等缺点,难以满足微波介质陶瓷的质量要求,因此该法不适合该复杂氧化物体系陶瓷粉体的制备.熔盐法[13-15]、化学沉淀法[16-17]、水热合成法[18]以及溶胶-凝胶法等[4-5]由于前驱体实现了分子水平的混合,制备出的粉体纯度高、化学成分均一而被广泛应用.近年来,溶胶-凝胶法在制备ZnTiO3粉体上显示出明显的优势,相对研究也较多,但对于其合成机理及相变过程研究不多.为了获得单一纯净的ZnTiO3粉体,实验采用溶胶-凝胶法制备ZnTiO3粉体,对其形貌进行表征,探讨溶胶反应温度及煅烧工艺对ZnTiO3粉体的合成及形貌的影响.
1 实验方法实验原料均为分析纯试剂,主要原料为钛酸丁酯(Ti (OC4H9)4)、六水合硝酸锌(Zn (NO3)2·6H2O)、无水乙醇(CH3CH2OH) 和冰醋酸(CH3COOH).称取一定量的钛酸丁酯溶入同摩尔量的冰醋酸中,并不断搅拌获得淡黄色透明的钛酸丁酯-醋酸溶液;按照(Zn:Ti) 摩尔比1:1称取硝酸锌溶入适量无水乙醇中,获得无色透明的硝酸锌-无水乙醇溶液,然后将硝酸锌-无水乙醇溶液缓慢倒入钛酸丁酯-醋酸溶液中,并不断搅拌获得浅黄色透明前驱体溶液.前驱体溶液在60 ℃水浴加热搅拌后获得浅黄色透明溶胶,静置陈化24 h后溶胶转变为凝胶,凝胶经80 ℃干燥后获得钛酸锌前驱体干凝胶.钛酸锌前驱体干凝胶经400~900 ℃煅烧,煅烧时间为2~8 h,获得不同晶型结构的钛酸锌粉体.
粉体相结构利用日本Rigaku D/Max2500型X射线衍射仪(XRD) 进行分析,辐射源为Cu Kα射线,λ=0.154 06 nm,扫描速度10°/min,测量范围20°~80°.形貌采用美国FEI公司的Quanta-650-FEG场发射扫描电镜(FE-SEM) 进行表征.前驱体干凝胶热分析(TG-DTA) 采用北京恒久综合热分析仪HCT-1进行,测试条件:升温速率为10 ℃/min,温度范围:室温至980 ℃,氩气气氛,刚玉坩埚,参比物为光谱纯α-Al2O3.
2 结果与讨论 2.1 前驱体热稳定性分析图 1所示为ZnTiO3凝胶前驱体在室温至980 ℃的热重-差热(TG-DTA) 曲线.由图 1可以看出前驱体的整个热分解过程主要分为3个阶段,它表明了干凝胶在不同温度下的相变及反应过程.室温至262 ℃为第1阶段,此阶段3个明显的吸热峰且失重迅速,总失重量为53 %.在61 ℃附近吸热峰可归因于干凝胶中残余有机溶剂乙醇的挥发过程;在240 ℃和262 ℃附近的吸热峰主要对应于凝胶中吸附的水和残余有机溶剂的挥发以及NO3-的分解过程. 262~700 ℃为第2阶段,此阶段失重缓慢,总失重量为12 %,在393 ℃附近有一弱的吸热峰,表明在该温度下有新相开始生成,所以煅烧最低温度定在400 ℃.从700 ℃开始为第3阶段,此阶段前驱体重量基本保持不变,说明此时前驱体有机物已经分解完毕.在792 ℃附近有一弱的放热峰出现,说明此时ZnTiO3晶体相完全生成.温度继续升高未出现ZnTiO3分解或相变峰,这是由于分解反应热效应较小,仪器精度不足所致.该结果同时也表明溶胶-凝胶前驱体在实验温度范围内煅烧可以获得单一纯净六方ZnTiO3陶瓷粉体,粉体的热稳定性较高.
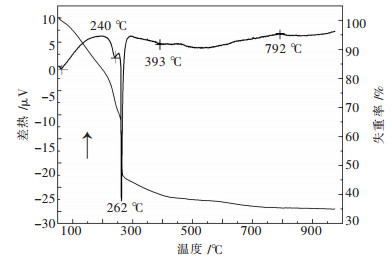 |
| 图 1 ZnTiO3前驱体凝胶TG-DTA曲线 Fig. 1 TG-DTA curves of ZnTiO3 precursor xerogel |
2.2 物相分析 2.2.1 煅烧温度对物相的影响
图 2所示为前驱体凝胶在400~900 ℃煅烧2 h后的产物XRD图谱.由图 2可以看出,随着煅烧温度的升高,前驱体凝胶在煅烧过程中发生了从非晶态到晶态以及一种晶型到另一种晶型的转变.在400~500 ℃范围内煅烧产物以非晶态立方ZnTiO3相和锐钛矿相为主,但衍射峰强度不高,同时产物中有少量的有机物残余,说明前驱体凝胶在400 ℃开始发生化学反应,结晶过程正在进行,还没有完全结束,这和TG-DTA分析结果一致.该温度范围内随温度升高立方ZnTiO3相增多,锐钛矿相减少,说明温度升高有利于立方ZnTiO3相的生成.这是因为前驱体首先要经过Ti-OH的脱羟基作用和硝酸锌的分解产生TiO2和ZnO,然后生成的氧化物在一定温度下发生化学反应才能生成钛酸锌粉体[4].温度继续升高到500 ℃时,XRD图谱上已有对应于六方ZnTiO3(104) 晶面的衍射峰出现,但此时峰值较弱,说明其晶粒细小.当煅烧温度升高到600 ℃时,主晶相转变峰型尖锐的六方ZnTiO3相和痕迹量的立方ZnTiO3相,非晶态锐钛矿相消失.当煅烧温度继续升高至700 ℃,产物峰型变得更加尖锐,此时立方ZnTiO3相完全消失,仅有晶型发育良好六方ZnTiO3相存在.上述分析表明在500~700 ℃范围内,ZnTiO3粉体发生了由立方(cubic) 到六方(hexagonal) 相的转变,而热分析曲线未发现明显的热效应峰与之对应,可能是由于晶型转变温度范围较宽,热效应相对较弱导致仪器灵敏度降低有关.温度继续升高,除主晶相衍射峰强度更强之外,产物XRD图谱未发现明显变化,说明晶粒发育完全,晶型趋于完整,这和TG-DTA分析结果一致.因此在该实验条件下,为了获得纯净的六方ZnTiO3粉体,需在700~900 ℃范围内进行煅烧.这和许多科研工作者在900 ℃煅烧会出现立方Zn2TiO4相的结果不同[4, 19],这是由于实验原料以及煅烧工艺不同引起的.整个煅烧过程中发生化学反应如下:
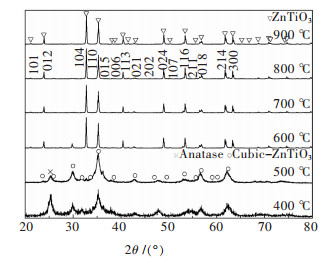 |
| 图 2 ZnTiO3前驱体在不同温度煅烧产物XRD谱 Fig. 2 XRD patterns of ZnTiO3 precursor calcined at different temperatures |
| $ \begin{align} & \text{ZnO}+\text{Ti}{{\text{O}}_{2}}\xrightarrow{400\tilde{\ }500\text{ }\!\!{}^\circ\!\!\text{ C}}\text{ZnTi}{{\text{O}}_{3}}\left( \text{cubic} \right)+ \\ & \text{Ti}{{\text{O}}_{2}}\left( \text{anatase} \right)\xrightarrow{500\tilde{\ }700\text{ }\!\!{}^\circ\!\!\text{ C}}\text{ZnTi}{{\text{O}}_{3}}\left( \text{hexagonal} \right)+ \\ & \text{Ti}{{\text{O}}_{2}}\left( \text{anatase} \right)\xrightarrow{700\tilde{\ }900\text{ }\!\!{}^\circ\!\!\text{ C}}\text{ZnTi}{{\text{O}}_{3}}\left( \text{hexagonal} \right) \\ \end{align} $ |
溶胶形成过程中,反应温度影响着溶胶质量,进而最终影响获得产物物相.一般认为溶胶水解温度过高,溶胶黏度随时间增加的太快,溶胶越不稳定.而水解温度过低时,水解缩聚反应发生动力学条件不足,反应缓慢且不利于粉体的制备[20].为了对比溶胶温度对产物的影响,实验选用30 ℃和60 ℃作为溶胶温度进行对比.
图 2、图 3所示分别为60 ℃和30 ℃不同水浴温度下获得凝胶前驱体不同温度煅烧产物XRD图谱.由图 2和图 3可以看出,凝胶前驱体在煅烧过程中均发生了从非晶态到晶态的转变.在400 ℃煅烧2种前驱体时,XRD图谱在30.03°和35.38°均出现对应于立方ZnTiO3(PDF 39-0190) 的(220) 和(311) 峰,同时伴随少量的锐钛矿相.但是30 ℃溶胶产物以立方ZnTiO3相为主,而60 ℃溶胶产物锐钛矿含量较高(图 2).随着煅烧温度的提高,立方ZnTiO3相强度逐步增强的同时,在23.92°和32.79°出现了明显的衍射峰,35.31°的衍射峰强度开始减弱,这与六方ZnTiO3(PDF 26-1500) 相的(012)、(104) 和(110) 晶面衍射强度一致.但60 ℃溶胶前驱体在700~900 ℃获得了单一钛铁矿相ZnTiO3相(图 2),而30 ℃溶胶产物获得了钛铁矿相ZnTiO3相和少量立方ZnTiO3和金红石相.这是由于温度升高,钛酸丁酯与硝酸锌水解速率增大,胶粒动能增大,相互之间碰撞几率增大,缩聚反应增加,溶胶更加均匀,促进了溶胶反应的进行.前驱体中钛酸丁酯遇水后迅速分解,为使其在水解过程中形成稳定溶胶,使用冰醋酸作为溶剂降低其水解速率.钛酸丁酯和冰醋酸发生反应生成配合物后,再发生水解缩聚反应,起到控制水解的作用,具体反应过程如下:
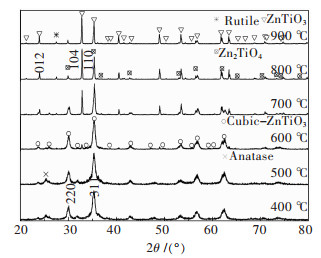 |
| 图 3 30 ℃溶胶前驱体不同温度煅烧产物XRD谱 Fig. 3 XRD patterns of 30 ℃ sol precursor calcined at different temperatures |
| $ \begin{align} & \text{Ti}{{\left( \text{O}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}} \right)}_{4}}+\text{C}{{\text{H}}_{\text{3}}}\text{COOH}\to \\ & \text{Ti}{{\left( \text{O}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}} \right)}_{3}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COO} \right)\text{+}{{\text{C}}_{\text{4}}}{{\text{H}}_{9}}\text{OH} \\ & \text{Ti}{{\left( \text{O}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}} \right)}_{3}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COO} \right)\text{+}{{\text{H}}_{\text{2}}}\text{O}\to \\ & \text{Ti}\left[ {{\left( \text{O}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}} \right)}_{\text{2}}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COO} \right) \right]\left( \text{OH} \right)+{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}}\text{OH} \\ & \text{Ti}{{\left( \text{O}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}} \right)}_{3}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COO} \right)+\text{Ti}\left[ {{\left( \text{O}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}} \right)}_{2}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COO} \right) \right]\left( \text{OH} \right)\to \\ & \left( \text{C}{{\text{H}}_{\text{3}}}\text{COO} \right){{\left( \text{O}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}} \right)}_{2}}\text{Ti}-\text{O}-\text{Ti}{{\left( \text{O}{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}} \right)}_{2}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COO} \right)+{{\text{C}}_{\text{4}}}{{\text{H}}_{\text{9}}}\text{OH} \\ \end{align} $ |
而低温溶胶反应动力不足,反应缓慢,钛酸丁酯和空气接触发生分解生成部分非晶态二氧化钛导致化学计量比偏移所致.值得注意的是30 ℃溶胶获得前驱体在800 ℃和900 ℃煅烧时,出现了Zn2TiO4和金红石型TiO2,这和60 ℃溶胶获得产物完全不同.由于立方ZnTiO3和Zn2TiO4同为尖晶石型立方晶体结构,衍射峰很相似且不易区分,这种晶体结构的相似性导致了高温下部分立方ZnTiO3直接转化为Zn2TiO4和TiO2[21].对比图 2、图 3可以看出,60 ℃溶胶时六方ZnTiO3相的稳定存在温度为600~900 ℃,而30 ℃溶胶时六方ZnTiO3相在的稳定存在温度为700~900 ℃,这说明较高的溶胶温度不仅促进溶胶反应的发生,同时有利于六方ZnTiO3相的生成.因此,采用溶胶-凝胶制备ZnTiO3粉体时,选用溶胶温度为60 ℃,这样既缩短了反应时间,同时又有利于ZnTiO3粉体的制备.
2.2.3 保温时间对物相的影响图 4所示为前驱体凝胶在800 ℃进行煅烧1~4 h后获得产物XRD图谱.由图 4可以看出,随着保温时间的延长,前驱体在煅烧后物相发生了明显的变化.前驱体凝胶在800 ℃煅烧1 h后,粉体为结晶良好的六方ZnTiO3相和少量立方ZnTiO3相,这说明立方ZnTiO3相的存在温度范围较宽,这可能是由于工艺条件不同所致.随着保温时间的延长,立方ZnTiO3相消失,获得了单一的六方ZnTiO3相.当保温时间达到4 h后,六方ZnTiO3相含量降低,立方Zn2TiO4相开始出现.煅烧过程是一个先升温后保温的过程,因此首先生成低温稳定立方ZnTiO3相,当温度达到800 ℃进行保温时,晶体会向该温度下热力学更稳定的晶型转变,因此保温1 h会出现六方ZnTiO3相和少量残余未转换完全的立方ZnTiO3相.随着保温时间的延长,六方ZnTiO3在高温下活性增强,会发生部分分解,整个过程中ZnTiO3会发生如下变化:
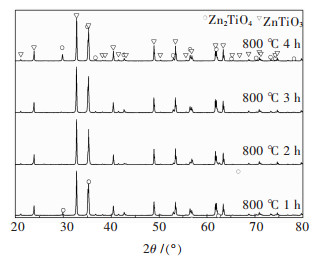 |
| 图 4 前驱体800 ℃下煅烧不同时间产物XRD谱 Fig. 4 XRD patterns of precursor calcined at 800 ℃ for different times |
| $ \begin{align} & \text{ZnO+Ti}{{\text{O}}_{\text{2}}}\to \text{ZnTi}{{\text{O}}_{3}}\left( \text{cubic} \right)\to \text{ZnTi}{{\text{O}}_{3}}\left( \text{hexagonal} \right)\to \\ & \text{ZnTi}{{\text{O}}_{3}}\left( \text{hexagonal} \right)+\text{Z}{{\text{n}}_{\text{2}}}\text{Ti}{{\text{O}}_{4}}+\text{Ti}{{\text{O}}_{\text{2}}} \\ \end{align} $ |
在800 ℃进行煅烧4 h的产物XRD图谱中未发现TiO2出现,这可能是其含量过低所致.因此,在该工艺制备ZnTiO3粉体过程中以煅烧时间2 h为宜.
2.3 形貌分析溶胶-凝胶合成ZnTiO3前驱体在煅烧过程中发生了从非晶态到晶态、立方到六方晶相的转变过程,故而粉体形貌也发生了相应转变. 图 5所示为凝胶前驱体于500 ℃煅烧2 h获得立方ZnTiO3粉体扫描电镜照片.由图 5可知立方ZnTiO3粉体发生了明显的团聚现象,团聚体尺寸可达3~5 μm,这是由于煅烧温度较低,样品中还存在少量的有机物残余导致.随着煅烧温度的升高,粉体物相发生转变,同时粉体形貌发生了很大变化,如图 6所示.
 |
| 图 5 500 ℃煅烧获得立方ZnTiO3粉体FE-SEM显微照片 Fig. 5 FE-SEM micrograph of cubic ZnTiO3 powders calcined at 500 ℃ |
 |
| 图 6 不同温度煅烧获得ZnTiO3粉体显微形貌 Fig. 6 FE-SEM micrographs of ZnTiO3 powders calcined at different temperatures |
图 6所示为前驱体在600~900 ℃煅烧获得六方ZnTiO3粉体SEM照片.由图 6可以看出,随着煅烧温度提高到600 ℃以后,粉体形貌由大的团聚体转变为300 nm左右的六边形片状颗粒团聚在一起,不易分开.此时的晶体结构已经由立方相转变成了六方相,且产物中有少量无有机物残余.根据晶体生长理论可知,粉体颗粒发育成球形为扩散机制控制,而颗粒按一定取向生长则为界面反应控制.这说明随着煅烧温度的提高,晶体不仅发生了物相的转变,同时晶体生长过程也由扩散控制机制转向界面反应控制机制.随着温度继续升高,粉体尺寸略有增大,900 ℃中有晶粒异常长大现象.这说明随着温度的升高,晶粒逐渐发育完全,晶型不断趋于完整,这与XRD检测结果一致.
3 结论采用溶胶-凝胶法在700~900 ℃保温2 h获得了纯六方相ZnTiO3粉体,粉体为六方片状颗粒团聚在一起,六方片状颗粒尺寸大小均匀.溶胶反应温度对产物的物相具有较大的影响,适宜的溶胶温度为60 ℃.凝胶前驱体在低于600 ℃煅烧时生成立方ZnTiO3粉体,该粉体发生了明显的团聚现象,该立方ZnTiO3相可存在的温度范围可达到800 ℃.随着煅烧温度的升高,立方相逐渐向六方相转变,同时晶体生长过程也由扩散控制机制转向界面反应控制机制.在800 ℃保温2 h获得了纯净的六方ZnTiO3相,保温时间过长,会导致部分六方相分解为立方Zn2TiO4相和TiO2.
| [1] |
SURENDAR T, KUMAR S, SHAKER V. Influence of La-doping on phase transformation and photocatalytic properties of ZnTiO3 nanoparticles synthesized via modified sol-gel method[J].
Physical Chemistry Chemical Physics, 2014, 16: 728–735. DOI: 10.1039/C3CP53855A. |
| [2] | 李文虎. 钛酸锌粉体制备方法研究进展[J]. 中国陶瓷, 2014, 50(5): 1–4. |
| [3] |
BUDIGI L, NASINA M R, SHAIK K, et al. Structural and optical properties of zinc titanates synthesized by precipitation method[J].
Journal of Chemical Sciences, 2015, 127(3): 509–518. DOI: 10.1007/s12039-015-0802-5. |
| [4] | 喻佑华, 夏萌, 吴伟杰. 纯六方相钛酸锌粉体的制备与表征[J]. 中国陶瓷, 2012, 48(7): 51–53. |
| [5] |
OSAMU Y, MASAMI M, HIDENAO K, et al. Formation and transformation of ZnTiO3[J].
Journal of the American Ceramic Society, 1987, 70(5): 97–98. |
| [6] |
LI E, ZHANG P, DUAN S., et al. Low temperature sintering of lowloss ZnTiO3 microwave dielectric ceramics with Zn-B-Si glass[J].
Journal of Alloys and Compounds, 2015, 647: 866–872. DOI: 10.1016/j.jallcom.2015.06.172. |
| [7] |
HYO T K, YOONHO K. Titanium incorporation in Zn2TiO4 spinel ceramics[J].
Journal of the American Ceramic Society, 2001, 84(5): 1081–1086. DOI: 10.1111/jace.2001.84.issue-5. |
| [8] | 喻佑华, 杨俊瑞, 王相惠, 等. ZnO-xTiO2系微波介质陶瓷的合成和介电性能[J]. 中国陶瓷, 2008, 44(5): 42–45. |
| [9] |
STANLEY F B, RICHARD A S. Compound formation and crystal structure in the system ZnO-TiO2[J].
Journal of the American Ceramic Society, 1961, 44(10): 493–499. DOI: 10.1111/jace.1961.44.issue-10. |
| [10] |
LABIB S, REFAI H S, IIMAIL S M. Effect of heat treatment on structure evolution and properties of nano zinc titanate ceramics[J].
Materialwissenschaft and Werkstofftechnik, 2014, 45(3): 169–176. DOI: 10.1002/mawe.v45.3. |
| [11] | 刘向春, 谢述峰, 陈晓龙, 等. ZnO-TiO2系微波介质陶瓷的相结构及研究进展[J]. 电子元件与材料, 2005, 24(6): 47–50. |
| [12] |
NINA O, NEBOJSA M, VLADIMIR P. Structural and electrical properties of sintered zinc-titanate ceramics[J].
Ceramics International, 2009, 35: 35–37. DOI: 10.1016/j.ceramint.2007.09.020. |
| [13] | 喻佑华, 李海南, 夏萌. 熔盐法制备ZnTiO3粉体的研究[J]. 电子元件与材料, 2011, 30(4): 10–12. |
| [14] | 文小强, 王玉香, 周健, 等. 熔盐法制备(La, Ce, Tb) PO4的工艺研究[J]. 有色金属科学与工程, 2013, 4(4): 111–116. |
| [15] | 钟盛文, 封志芳, 谢敏. 熔盐法合成LiMn1/3Ni1/3Co1/3O2及AA电池的电化学性能[J]. 有色金属科学与工程, 2011, 2(1): 9–13. |
| [16] | 曾东, 刘晓林, 陈建峰, 等. 沉淀法制备纳米钛酸锌粉体的研究[J]. 北京化工大学学报, 2005, 32(5): 39–42. |
| [17] | 徐静, 朱秀慧, 王开明, 等. 纳米ZnTiO3粉体的制备[J]. 鞍山科技大学学报, 2007, 30(5): 453–455. |
| [18] |
WANG C, CHU H, KO H, et al. Phase formation mechanism of the zinc titanate precursor powders prepared at various pH using a hydrothermal process[J].
Ceramics International, 2015, 41: 2028–2041. DOI: 10.1016/j.ceramint.2014.09.131. |
| [19] |
CHAI Y, CHANG Y, CHEN G, et al. The effects of heat-treatment on the structure evolution and crystallinity of ZnTiO3 nano-crystals prepared by Pechini process[J].
Materials Research Bulletin, 2008, 43: 1066–1073. DOI: 10.1016/j.materresbull.2007.06.002. |
| [20] | 余丽芳, 喻佑华, 袁玲玲, 等. 溶胶-凝胶法制备钛酸锌微波介质陶瓷粉体影响因素的研究[J]. 陶瓷学报, 2011, 32(4): 519–522. |
| [21] | 李哲, 张萍, 赵子琪, 等. 沉淀法制备纯立方相偏钛酸锌纳米粉及表征[J]. 稀有金属材料与工程, 2008, 37(增刊1): 303–306. |
 2017, Vol. 8
2017, Vol. 8


