| 富锂材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2的ZrO2包覆及电化学性能 |
随着时代的发展,新能源汽车的普及,对电池放电比容量的要求越来越高.富锂材料由于较高的放电比容量,放电电压以及低成本,越来越受到人们的关注[1].但是富锂材料同样面临很大的问题导致其还不能满足商业化的要求,主要有:①首圈不可逆容量大,首圈充放电效率低;②循环性能差;③倍率性能差;④电压降这4个方面[2].
针对以上的方面,人们做了大量的研究,主要有表面包覆,体相掺杂以及表面处理.表面包覆是一种简单有效的改性方法,包覆物质可以有效的阻止电解液对富锂材料表面的侵蚀,优化界面反应电化学,降低界面反应电化学电阻.主要的包覆物质有:①导电物质的包覆,如L. N. CONG等[3];②氧化物包覆,如MgO, Al2O3等[4];③磷酸盐,如AlPO4、MgPO4等[5];④锂盐,如Li4Ti12O5、LiMnPO4、LiNiPO4等[6].
文中的创新点在于使用一种简单的方法对富锂材料进行氧化物包覆,同时以1C的放电倍率循环100圈之后的放电比容量为标准,确定最佳的ZrO2包覆量.先用液相共沉淀法制备富锂锰基固溶体正极材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2.由于ZrO2极强的稳定性,能够很好的保护富锂材料表面免受电解液分解所产生的HF的侵蚀.采用硝酸锆在高温下分解的方法来包覆富锂材料,一方面价格低廉,另一方面,ZrO2高温下可以与富锂表面离子相互迁移,增强ZrO2与富锂材料表面的结合力,防止循环过程中包覆层的脱落.综上,通过富锂材料的ZrO2表面包覆,增强富锂材料的电化学性能.
1 实验方法采用液相共沉淀法制备富锂材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2.首先用MnSO4·H2O、NiSO4·6H2O和CoSO4·7H2O配置浓度为2 mol/L的硫酸盐溶液(nMn:nNi:nCo=0.54:0.13:0.13),沉淀剂以及络合剂选用强碱KOH和氨水配成浓度为4 mol/L的碱液.将硫酸盐溶液和碱液逐滴滴加到反应器中,同时控制pH保持在12左右,反应温度为60 ℃,实验过程用氩气气氛保护.沉淀完全后,用二次水清洗,用以去除沉淀物中残留的硫酸根离子,将沉淀物在120 ℃下真空干燥12 h.而后按化学计量比将干燥后的产物与LiOH·H2O充分研磨(配锂过量5%).最后将配锂之后的前驱体置于马弗炉中焙烧,烧结机制是10 ℃/min加热至450 ℃下预处理1 h,之后以5 ℃/min加热至950 ℃下煅烧24 h,并用液氮进行冷却.
按化学计量比分别称取质量百分比为1%,2%,4%的相对应的硝酸锆溶于40 mL无水乙醇中,称取相对质量的富锂材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2与相应的无水乙醇溶液混合,超声1 h使富锂材料充分分散,之后置于60 ℃下搅拌蒸干,将蒸干后的材料与450 ℃下焙烧5 h,得到质量百分比为1%,2%,4% ZrO2包覆的富锂材料.
检测所制备正极材料的物相组成使用日本理学公司TTRⅢ型XRD分析设备,选用德国卡莱尔蔡司公司的SUPARTM55型FESEM测试系统进行表面形貌和表面元素观察.电感耦合等离子体原子发射光谱(ICP~AES) 成分分析使用的是OPTIMA 7000DV型电感耦合等离子体原子发射光谱仪.正极材料的电化学阻抗普测试使用VMP2电化学工作站(VersaSTAT3,美国普林斯顿仪器公司),频率范围为1 MHz~10 mHz,交变电压振幅为5 mV,测试温度为室温.恒流充放电测试使用的蓝点测试系统LANHE CT2001A.
2 结果与讨论 2.1 成分分析表 1所示为不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2的ICP测试结果,从表 1中可以看出,Li:Mn:Co:Ni:Zr的实验摩尔比与Li:Mn:Co:Ni:Zr的理论摩尔比基本相等,可以认为实验所制备富锂材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2的ZrO2包覆量与设计值相同.
| 表1 不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2 ICP成分分析 Table 1 Composition of electrode materials Li[Li0.2Mn0.54Co0.13Ni0.13]O2 with different different amount of ZrO2 coating, based on ICP analysis. |
 |
| 点击放大 |
2.2 晶体机构分析
图 1所示为Li[Li0.2Mn0.54Co0.13Ni0.13]O2包覆不同量ZrO2的XRD衍射图谱,通过物相检索没有发现明显的ZrO2衍射峰,是由于ZrO2的量太少导致的.除2θ在20°~30°之间的2个衍射峰外,其余衍射峰均与α-NaFeO2层状结构的衍射峰吻合,属R-3m型对称空间群.(020) 和(110) 衍射峰,是固溶体相中超晶格结构Li2MnO3的特殊衍射峰. Li2MnO3由立方密堆积的氧骨架层和八面体顶端的Li与[Li1/3Mn2/3]构成,Li+和Mn4+近程有序的排列方式构成超晶格结构,属C/2m空间群.图谱中的衍射谱峰尖锐,峰宽较窄,这说明液相共沉淀法制备的Li[Li0.2Mn0.54Co0.13Ni0.13]O2具有较好的结晶度.此外,衍射峰的强度比I(003)/(104) >1.2说明实验制备的富锂材料,Li+和Ni2+混排程度较小,这有利于正极材料在充放电循环过程中结构稳定[7-8].
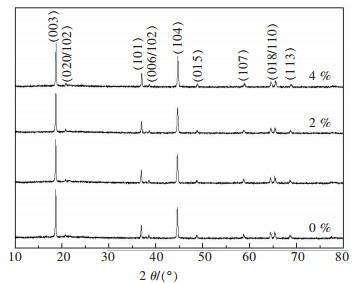 |
| 图 1 不同ZrO2包覆量的XRD谱 Fig. 1 XRD patterns of different amount of ZrO2 coatings |
2.3 表面形貌及元素分析
图 2所示为ZrO2包覆前后富锂锰基固溶体正极材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2的FESEM像,从图 2中可以看出,颗粒的粒径均匀分布在100~200 nm之间,少量ZrO2包覆对颗粒形貌及颗粒尺寸影响较小,颗粒表面光滑,颗粒棱界清晰[9-11].随着包覆量的增加,大量的ZrO2在富锂材料颗粒间不断聚合,形成不连续的ZrO2残片.颗粒表面逐渐变得粗糙甚至出现相互粘连团聚.采用EDS能谱分析2% ZrO2包覆Li[Li0.2Mn0.54Co0.13Ni0.13]O2试样表面元素分布(图 3),从图 3中Ni、Co、Mn、Zr的均匀分布可以定性地认为ZrO2包覆对Li[Li0.2Mn0.54Co0.13Ni0.13]O2颗粒表面的过渡金属并未造成损伤.同时,分布均匀的Zr元素也说明ZrO2成功包覆到Li[Li0.2Mn0.54Co0.13Ni0.13]O2的颗粒表面.
 |
| 图 2 不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2试样的FESEM像 Fig. 2 FESEM images of prepared Li[Li0.2Mn0.54Co0.13Ni0.13]O2 |
 |
| 图 3 ZrO2包覆量为2 %的Li[Li0.2Mn0.54Co0.13Ni0.13]O2表面各元素的面分布像 Fig. 3 Elemental mapping of prepared Li[Li0.2Mn0.54Co0.13Ni0.13]O2 with 2 % ZrO2 coating |
2.4 电化学性能
对于富锂材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2,首次充放电对其电化学性能有着重要的影响.为了研究ZrO2包覆对富锂材料首次充放电性能的影响,在低倍率0.05 C下对所制备的试样进行首圈性能的研究,充放电电压范围为2~4.8 V vs Li/Li+,结果见表 2.未包覆的试样的首次充电容量为358.1 mAh/g,包覆后试样的首次充电容量相较于未包覆的试样有降低,但是包覆量为1%和2%的首圈放电比容量分别为301.9 mAh/g和297.0 mAh/g,相较于未包覆试样的286.5 mAh/g有较大的提升.同时包覆量为1%和2%的首圈充放电效率分别为84.72%和84.87%,比未包覆试样的80.01%有很大的提高. ZrO2包覆可以抑制富锂锰基固溶体正极材料首圈不可逆容量的损失[12-13]见图 4.
| 表2 不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2首圈充放电数据 Table 2 First charge-discharge date of Li[Li0.2Mn0.54Co0.13Ni0.13]O2 with different amount of ZrO2 coating |
 |
| 点击放大 |
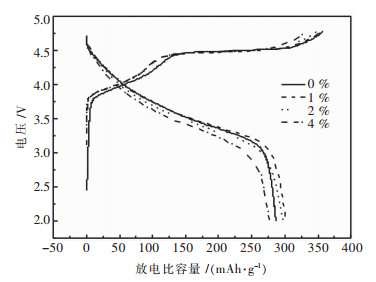 |
| 图 4 不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2首圈充放电曲线 Fig. 4 Initial charge-discharge curves of Li[Li0.2Mn0.54Co0.13Ni0.13]O2 electrodes with different amount of ZrO2 coating |
图 5所示为不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2在1 C循环性能图,前3圈在小倍率0.05 C下活化. 100圈后,包覆量为0%、1%、2%、4%的放电比容量分别为173.4 mAh/g、189.7 mAh/g、228.2 mAh/g、156.5 mAh/g,容量保持率分别为60.52%、62.8%、76.8%、45.7%.包覆量为2%的试样在首圈放电比容量和容量保持率方面比未包覆的试样有很大的提高.对于富锂材料,ZrO2包覆能够阻止电解液对富锂材料表面的侵蚀[14-16],保持富锂材料的表面结构,提高富锂材料的结构稳定性,使富锂锰基固溶体正极材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2的循环性能得到很大的提升[17-20].
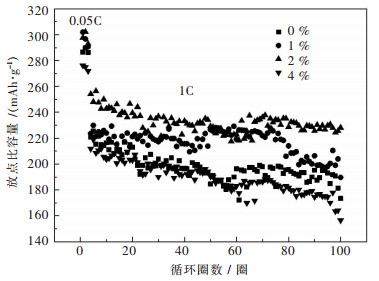 |
| 图 5 不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2在1 C循环性能 Fig. 5 Cycle abilities of Li[Li0.2Mn0.54Co0.13Ni0.13]O2 electrodes with different amount of ZrO2 coating at 1 C |
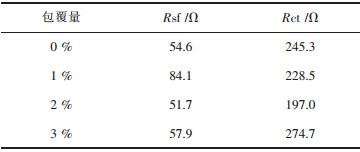
图 6所示为倍率1 C循环100圈之后不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2的交流阻抗图及等效电路图.等效电路图中Rct、Rsf、Rs分别代表表面电化学反应的电荷转移电阻、电极表面膜电阻(固体电解质膜) 和参比电极与工作电极之间电解液的溶液电阻. Zw和CPEs分别代表瓦伯格(Warburg) 阻抗和相关的相位角原件[21-23]. 表 3为不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2交流阻抗值.从表中可以看出,在1 C下循环100圈之后的电化学反应电阻,包覆量为2%的电阻值为197.0 Ω,相对于未包覆ZrO2的试样的245.3 Ω有很大的降低.对于富锂锰基固溶体正极材料,ZrO2包覆能够优化电化学界面,降低界面电化学反应电阻.
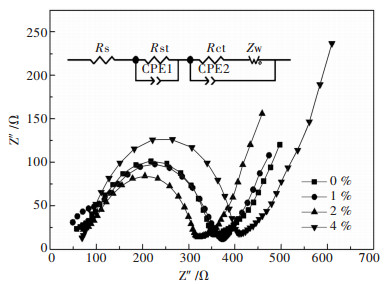 |
| 图 6 1 C循环100圈之后不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2的交流阻抗谱及等效电路 Fig. 6 Nyquist plots of Li[Li0.2Mn0.54Co0.13Ni0.13]O2 electrodes with different amount of ZrO2 coating after 100 cycles at 1 C and equivalent circuit. |
| 表3 不同ZrO2包覆量的Li[Li0.2Mn0.54Co0.13Ni0.13]O2交流阻抗值 Table 3 Parameters of EIS for Li[Li0.2Mn0.54Co0.13Ni0.13]O2 electrodes with different amount of ZrO2 coating |
 |
| 点击放大 |
3 结论
通过液相法对富锂锰基固溶体正极材料Li[Li0.2Mn0.54Co0.13Ni0.13]O2进行ZrO2包覆处理. ZrO2包覆能够显著提高富锂锰基固溶体正极材料的首圈充放电效率,降低首圈不可逆容量.同时阻止电解液对富锂材料表面的侵蚀.优化电化学反应界面,降低电化学反应电阻.当ZrO2包覆量为2%时,富锂材料的循环性能最好,在放电倍率为1 C下,100圈之后,放电比容量和容量保持率分别为228.2 mAh/g和76.8%,相较于未包覆试样的173.4 mAh/g和60.52%有很大提升.对于富锂材料来说,ZrO2包覆是一个比较高效低成本的表面处理方法.
| [1] |
GOODENOUGH J B, KIM Y. Challenges for rechargeable Li batteries[J].
Chemistry of Materials, 2010, 22(3): 587–603. DOI: 10.1021/cm901452z. |
| [2] |
DENG Y, LIU S, LIANG X. Study of carbon surface-modified Li[Li0.2Mn0.54Ni0.13Co0.13]O2 for high-capacity lithium ion battery cathode[J].
Journal of Solid State Electrochemistry, 2013, 17: 1067–1075. DOI: 10.1007/s10008-012-1970-6. |
| [3] |
CONG L N, GAO X G, MA S C, et al. Enhancement of electrochemical performance of Li[Li0.2Mn0.54Ni0.13Co0.13]O2 by surface modi cation with Li4Ti5O12[J].
Electrochimica Acta, 2014, 115: 399–406. DOI: 10.1016/j.electacta.2013.10.117. |
| [4] |
LIU J, MANTHIRAM A. Understanding the improvement in the electrochemical properties of surface modified 5 V LiMn1.42Ni0.42Co0.16O4 spinel cathodes in lithium-ion cells[J].
Chemistry of Materials, 2009, 21: 1695–1707. DOI: 10.1021/cm9000043. |
| [5] | 李金辉, 郑顺, 熊道陵, 等. 废旧锂离子电池正极材料有价资源回收方法[J]. 有色金属科学与工程, 2013, 4(4): 29–35. |
| [6] | 段剑锋. 20Ah富锂锰动力电池的性能研究[J]. 有色金属科学与工程, 2013, 4(2): 37–40. |
| [7] | 胡伟, 钟文胜. 富锂锰基正极材料的改性及电化学性能研究[J]. 有色金属科学与工程, 2014, 5(4): 32–36. |
| [8] |
KIM J S, JOHNSON C S, VAUGHEY J T, et al. Pre-conditioned layered electrodes for lithium batteries[J].
Journal of Power Sources, 2006, 153: 258–264. DOI: 10.1016/j.jpowsour.2005.05.081. |
| [9] |
LUO S Q, WALID A D. Recent progress in organic-inorganic halide perovskite solar cells: Mechanisms and material design[J].
Journal of Materials Chemistry A, 2015, 3(17): 8992–9010. DOI: 10.1039/C4TA04953E. |
| [10] |
CHEN Y, XU G, LI J, et al. High capacity 0.5Li2MnO3·0.5Li Ni0.33Co0.33Mn0.33O2 cathode material via a fast co-precipitation method[J].
Electrochimica Acta, 2013, 87: 686–692. DOI: 10.1016/j.electacta.2012.09.024. |
| [11] | 徐宝和, 吴甜甜, 钟盛文, 等. Si4+掺杂对富锂Li[Li0.15Mn0.575Ni0.275]O2的研究[J]. 有色金属科学与工程, 2012, 3(2): 24–27. |
| [12] | 钟胜文, 黎明旭, 张骞, 等. 富锂锰基正极材料的高温储存性能研究[J]. 有色金属科学与工程, 2013, 4(3): 46–49. |
| [13] |
JO Y N, PRASANNA K, PARK S J, et al. Characterization of Li-rich xLi2MnO3·(1-x) Li[MnyNizCo1-y-z]O2 as cathode active materials for Li-ion batteries[J].
Electrochimica Acta, 2013, 108: 32–38. DOI: 10.1016/j.electacta.2013.06.062. |
| [14] |
IDEMOTO Y, NARAI H, KOURA N. Crystal structure and cathode performance on oxygen content of LiMn1.5Ni0.5O4 as a cathode material for secondary lithium batteries[J].
Journal of Power Sources, 2003, 119/120/121: 125–129. |
| [15] |
CHO J, KIM Y J, PARK B. Novel LiCoO2 cathode material with Al2O3 coating for a Li ion cell[J].
Chemistry of Materials, 2000, 12: 3788–3791. DOI: 10.1021/cm000511k. |
| [16] |
WANG G X, BEWLAY S, YAO J, et al. Multiple-ion-doped lithium nickel oxides as cathode materials for lithium-ion batteries[J].
Journal of Power Sources, 2003, 119: 189–194. |
| [17] | 钟盛文, 钟凤娣, 张骞. 锂离子正极材料LiNi0.5Mn0.3Co0.2]O2的合成与掺杂Al的性能研究[J]. 有色金属科学与工程, 2013, 4(4): 11–16. |
| [18] | 宋晋阳, 叶红齐, 董虹, 等. 正极材料LiNi1/3Co1/3Mn1/3]O2的Mg掺杂及电化学性能[J]. 有色金属科学与工程, 2013, 4(3): 30–33. |
| [19] |
JANG Y Ⅱ, CHIANG Y M. Stability of the monoclinic and orthorhombic, phases of LiMnO2 with temperature, oxygen partial pressure and Al doping[J].
Solid State Ionics, 2000, 130: 53–59. DOI: 10.1016/S0167-2738(00)00310-6. |
| [20] |
WANG G X, BEWLAY S, YAO J, et al. Multiple-ion-doped lithium nickel oxides as cathode materials for lithium-ion batteries[J].
Journal of Power Sources, 2003, 119: 189–194. |
| [21] |
SHI S R, IZUMI N, TOSHIO T. Effect of the elevated temperature on the local structure of lithium manganese oxide studied by in situ XAFS analysis[J].
Journal of Power Sources, 1999, 81-82: 571–574. DOI: 10.1016/S0378-7753(99)00222-0. |
| [22] |
LIU Y J, LI X H, GUO H J, et al. Electrochemical performance and capacity fading reason of LiMn2O4/graphite batteries stored at room temperature[J].
Journal of Power Sources, 2009, 189(1): 721–725. DOI: 10.1016/j.jpowsour.2008.08.044. |
| [23] |
IDEMOTO Y, NARAI H, KOURA N. Crystal structure and cathode performance on oxygen content of LiMn1.5Ni0.5O4 as a cathode material for secondary lithium batteries[J].
Journal of Power Sources, 2003, 119/120/121: 125–129. |
 2017, Vol. 8
2017, Vol. 8


