| 流水线镁电解熔盐体系密度的研究 |
密度是熔盐的一个重要的物理化学性质, 无论在生产实践和理论研究中都有重要的意义.在熔盐电解过程中, 熔盐与金属液体及槽渣的分离, 都与熔盐密度有关[1-3].
镁电解是海绵钛生产过程建立镁氯循环的核心工艺, 当前比较盛行的是流水线镁电解技术和多极槽技术, 其生产使用的熔盐体系主要是由MgCl2、NaCl、KCl和CaCl2等组成的多元体系.不同类型的电解槽选择不同的熔盐体系, 如:多级槽采用MgCl2-NaCl-CaCl2体系, 流水线镁电解采用MgCl2-NaCl-KCl体系等[4-7].
流水线镁电解技术因对原料要求相对较低, 使能其与多极槽技术相媲美, 在镁电解工艺中具有竞争力和吸引力.国内某海绵钛厂采用该技术, 由于缺乏理论基础和实践经验, 导致运行效果不理想[8-11].已有文献对同种熔盐体系的密度进行研究, 文献[1]中对MgCl2-NaCl-KCl体系的密度进行了研究, 笔者用已知密度的MgCl2进行标定, 其误差较大, 不利于准确指导生产, 且其中未对熔盐密度的变化规律进行较深入的分析和缺乏不同温度和不同氧化镁浓度下的密度值.笔者研究不同熔盐组分、不同熔盐温度和不同氧化镁浓度下的MgCl2-KCl-NaCl熔盐体系密度变化规律, 旨在确定适合于流水线镁电解熔盐的最佳控制参数, 为生产提供指导, 为同行提供理论参考.
1 实验 1.1 实验原理采用流体力学称量法测试熔盐的密度.流体静力学称量法是利用阿基米德原理测量浸在液体中的浮子所受的浮力, 求得熔盐密度的方法.
1.2 实验试剂实验中采用的试剂:分析纯MgCl2(天津化学试剂厂), 分析纯NaCl (天津化学试剂厂), 分析纯KCl (天津化学试剂厂), 分析纯MgO (上海埃彼化学试剂有限公司).
1.3 实验装置实验用的加热炉配置(如图 1) 液压升降系统, 升降精度为10 μm, 用控温箱控温, 控温精度为±1 ℃.采用的细丝、重锤均为钼材质.实验用的测量装置为拉力计, 与计算机连接进行数据记录, 测量精度为1 mN.用已知密度的MgCl2进行标定, 结果表明, 误差不大于±0.2 %.
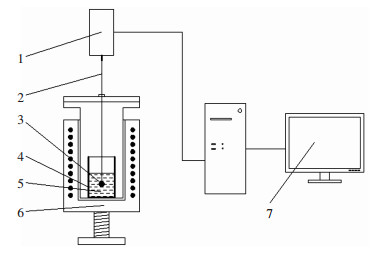 |
| 1.拉力计; 2.钼丝; 3.钼重锤; 4.刚玉坩埚; 5.熔盐; 6.可升降加热炉; 7.计算机. 图 1 实验装置 Fig. 1 Experimental equipment |
1.4 实验方法
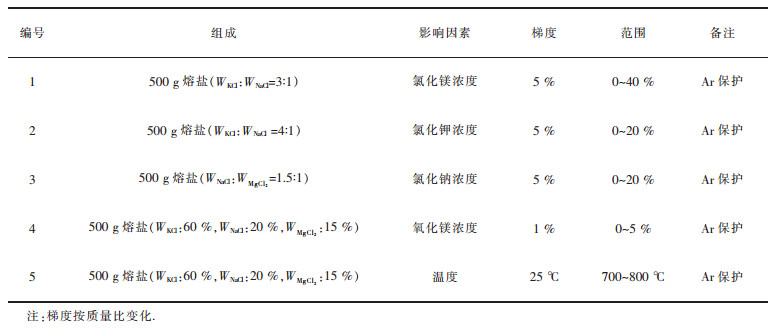
实验前, 将实验所用的氯化镁、氯化钾和氯化钠在150 ℃的条件下烘干12 h.按照表 1中的实验样品分别称取各组元, 研磨混匀后放入刚玉坩埚, 在加热炉中在300 ℃下脱水4 h后继续升温, 使样品充分熔化后开始实验.其中, 表 1中编号1~4的温度为恒温700 ℃, 而编号5的初始温度为700 ℃, 在实验中根据实验条件进行升温, 升温速率为10 ℃/min.
| 表1 实验样品 Table 1 Experimental sample |
 |
| 点击放大 |
采用阿基米德原理先在水中测定重锤的体积为V, 由于由温度引起的吊锤体积变化远远小于实验精度的要求, 所以体积随温度的变化可以忽略不计.将重锤用细丝吊起完全置于液面上, 此时拉力计的读数即为重锤的重力G, 缓慢升高升降炉至重锤完全置于液面下, 待液面稳定后, 读出拉力计的读数为F, 此时浮子所受的重力和浮力的合力与拉力平衡.设熔盐的密度为ρ, 则通过ρ=(G-F) /gV即可求得熔盐的密度[12-13].
2 结果与讨论在900 ℃以下, 金属镁的密度与温度的关系可以用式(1) 表示[14]:
| $ {\rho _{{\rm{Mg}}}}{\rm{ = 1}}{\rm{.548-0}}{\rm{.000 234(}}T{\rm{-700)}} $ | (1) |
由式(1) 可以计算出, 在700 ℃时, 熔融金属镁的密度为1.548 g/cm3.
在现行的镁电解槽中, 镁是浮在熔盐表面上的.为使镁更好上浮, 以便镁与熔盐充分分离, 镁与熔盐之间需要有一定的密度差, 此时镁呈近似球状浮在熔盐表面上, 但露出熔盐表面不多.若密度差太大, 镁成薄层, 且露出熔盐表面过多, 燃烧损失严重.
在实际生产中, 通过对某厂流水线镁电解槽的长期研究发现, 为了更好的保护熔融镁, 镁与熔盐的密度差选0.05~0.08 g/cm3, 因此, 熔盐体系的密度在1.598~1.628 g/cm3之间为宜.
2.1 不同熔盐组分的熔盐密度密度是物质质量与其体积的比值, 所以熔盐的密度由其本身的质量与体积决定.在多元系的熔融体系中, 熔盐组分的变化会引起熔盐密度发生变化.若多元系组元形成简单低熔共晶或连续固溶体, 则相应熔体的密度变化服从加和规则, 即密度与浓度呈直线关系.当体系形成化合物时, 密度-浓度关系曲线上常出现最高点或拐点[1-3].研究中的熔盐体系所涉及的单体熔盐密度与温度的关系为[15]:
| $ {\rho _{{\rm{KCl}}}}{\rm{ = 2}}{\rm{.135 9-0}}{\rm{.5831}} \times {\rm{1}}{{\rm{0}}^{-3}}T $ | (2) |
| $ {\rho _{{\rm{NaCl}}}}{\rm{ = 2}}{\rm{.139 3-0}}{\rm{.543 0}} \times {\rm{1}}{{\rm{0}}^{-3}}T $ | (3) |
| $ {\rho _{{\rm{MgC}}{{\rm{l}}_2}}}{\rm{ = 1}}{\rm{.976 0-0}}{\rm{.302 0}} \times {\rm{1}}{{\rm{0}}^{-3}}T $ | (4) |
从式(2)、式(3)、式(4) 可以看出, 在同一温度下, ρMgCl2>ρNaCl>ρKCl.
在MgCl2-NaCl-KCl三元体系中, KCl和MgCl2是以络合物的形式存在, 不同质量比的存在形式不同.当KCl和MgCl2的质量比大于1.57时, 形成不稳定化合物K2MgCl4, 当KCl和MgCl2的质量比小于0.78时, 形成稳定化合物KMgCl3[16].
2.1.1 不同氯化镁浓度的熔盐密度在固定氯化钾和氯化钠质量比条件下, 不同氯化镁浓度下熔盐密度的变化规律如图 2所示.
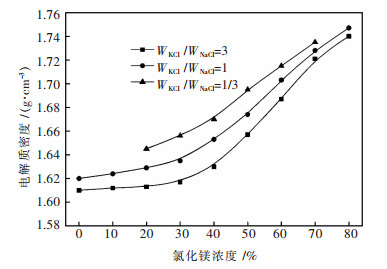 |
| 图 2 氯化镁浓度对熔盐密度的影响 Fig. 2 Molten salt density affected by MgCl2 |
由图 2结果可知, 在固定氯化钾和氯化钠质量比条件下, 随着氯化镁浓度增大, 熔盐密度增大, 当氯化镁浓度大于40 %时, 由于此处形成稳定化合物KMgCl3, 熔盐密度增幅加大.在固定氯化镁浓度条件下, 随着氯化钾和氯化钠质量比增大, 熔盐密度减小.因此, 流水线镁电解熔盐体系熔盐组分的较优控制范围为: WKCl /WNaCl=3, WMgCl2:0 %~40 %.
2.1.2 不同氯化钠浓度的熔盐密度在固定氯化钾和氯化镁质量比条件下, 不同氯化钠浓度下熔盐密度的变化规律如图 3所示.
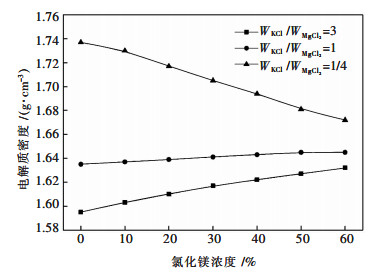 |
| 图 3 氯化钠浓度对熔盐密度的影响 Fig. 3 Molten salt density affected by NaCl |
由图 3结果可知, 随着氯化钠浓度增大, 在WKCl/WMgCl2=4条件下, 熔盐密度增大; 在WKCl/WMgCl2=1条件下, 熔盐的密度变化不大; 在WKCl/WMgCl2=1/4条件下, 熔盐的密度减小.在固定氯化钠浓度条件下, 随着氯化钾和氯化镁质量比增大, 熔盐密度减小.因此, 流水线镁电解熔盐体系熔盐组分的较优控制范围为: WKCl/WMgCl2=4, WNaCl:10 %~40 %.
2.1.3 不同氯化钾浓度的熔盐密度在固定氯化钠和氯化镁质量比条件下, 不同氯化钠浓度下熔盐密度的变化规律如图 4所示.
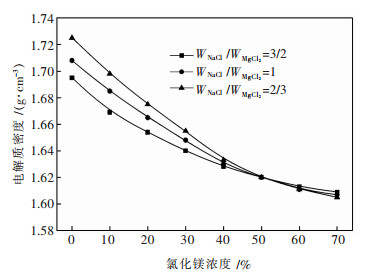 |
| 图 4 氯化钾浓度对熔盐密度的影响 Fig. 4 Molten salt density affected by KCl |
由图 4结果可知, 在固定氯化钠和氯化镁质量比条件下, 随着氯化钾浓度增大, 熔盐密度减小, 当氯化钾浓度大于40 %时, 由于此时熔盐体系中形成不稳定化合物K2MgCl4, 熔盐密度减幅变小.在固定氯化钾浓度条件下, 随着氯化钠和氯化镁质量比增大, 当氯化钾浓度小于50 %时, 由于在此过程中有不稳定化合物K2MgCl4产生, 熔盐密度减小; 当氯化钾浓度大于50 %时, 由于此过程中有稳定化合物KMgCl3产生, 熔盐密度增大.因此, 流水线镁电解熔盐体系熔盐组分的较优控制范围为: WKCl: 50 %~70 %.
综合以上分析可知, 在流水线镁电解所用的MgCl2-KCl-NaCl熔盐体系中, 熔盐组分较优的控制范围为: WKCl: 50 %~70 %, WNaCl: 18 %~23 %, WMgCl2: 12 %~18 %.
2.2 不同熔盐温度的熔盐密度在MgCl2-NaCl-KCl三元熔盐体系中, 控制氯化钾浓度65 %, 氯化钠浓度20 %, 氯化镁浓度15 %的条件下, 不同温度下熔盐密度的变化规律如图 5所示.
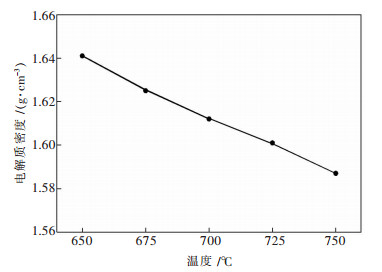 |
| 图 5 熔盐温度对熔盐密度的影响 Fig. 5 Molten salt density affected by temperature |
由图 5结果可知, 在固定熔盐各组分浓度条件下, 随着熔盐温度升高, 熔盐离子间的运动动能增加, 离子间键力减弱, 熔盐体积增大, 熔盐密度随之减小.因此, 流水线镁电解熔盐体系温度的较优控制范围: 680~700 ℃
2.3 不同氧化镁浓度的熔盐密度在MgCl2-NaCl-KCl三元熔盐体系中, 控制氯化钾浓度65 %, 氯化钠浓度20 %, 氯化镁浓度为15 %, 控制温度700 ℃的条件下, 不同氧化镁浓度下电解质密度的变化规律如图 6所示.
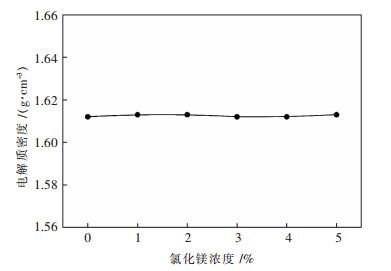 |
| 图 6 氧化镁浓度对电解质密度的影响 Fig. 6 Molten salt density affected by MgO |
由图 6结果可知, 随着氧化镁浓度增大, 由于氧化镁在熔盐中的溶解度很小, 大颗粒的氧化镁沉降到槽底, 小颗粒的氧化镁浮在熔盐表面[17], 熔盐密度变化不大.可见, 氧化镁浓度对熔盐密度影响不明显.
3 结论1) 在MgCl2-KCl-NaCl熔盐体系中, 随着氯化镁浓度增加, 熔盐密度增大; 随着氯化钾浓度增加, 熔盐密度减小; 随着氯化钠浓度增加, 高钾含量的熔盐密度增大, 高镁含量的熔盐密度减小.当体系中出现KMgCl3时, 熔盐密度急剧增大; 当体系中出现K2MgCl4时, 熔盐密度急剧减小.
2) 在MgCl2-KCl-NaCl熔盐体系中, 随着温度升高, 熔盐密度减小.
3) 在生产中, 在流水线镁电解所用的MgCl2-KCl-NaCl熔盐体系中, 熔盐组分的较优控制范围为: WKCl: 50 %~70 %, WNaCl: 18 %~23 %, WMgCl2: 12 %~18 %; 温度较优的控制范围为: 680~700 ℃.
| [1] | 张永健. 镁电解生产工艺学[M]. 长沙: 中南大学出版社, 2006. |
| [2] | 别列耶夫AM. 熔盐物理化学[M]. 北京: 中国工业出版社, 1963. |
| [3] | 沈时英, 胡方华. 熔盐电化学理论基础[M]. 北京: 中国工业出版社, 1965. |
| [4] |
SUN Z, LIU C L, LU G M, et al. Effects of operational and structural parameters on cell voltage of industrial magnesium electrolysis cells[J].
Frontiers of Chemical Science and Engineering, 2015, 9(4): 522–531. DOI: 10.1007/s11705-015-1539-x. |
| [5] |
LIU C L, SUN Z, LU G M, et al. 3D and 2D experimental views on the flow field of gas-evolving electrode cold model for electrolysis magnesium[J].
Flow Measurement & Instrumentation, 2015, 45(1): 59–66. |
| [6] |
DUHAIME P, MERCILLE P, PINEAU M. Electrolytic process technologies for the production of primary magnesium[J].
Transactions of the Institution of Mining and Metallurgy, 2002, 111(5/6/7/8): 53–55. |
| [7] |
CHEN Z Y, WANG L J, CHOU K C, et al. Comparison of different calculation methods of the new generation geometric model in the predicting density of the NaCl-MgCl2-CaCl2[J].
Journal of Solution Chemistry, 2013, 43: 577. |
| [8] | 张建安, 周云英, 石玉英. 多极镁电解槽电流效率的影响因素探讨[J]. 四川冶金, 2013(5): 26–29. |
| [9] | 姜宝伟, 蔡增新, 翁启钢. 海绵钛生产工艺中几种镁电解槽技术的对比分析[J]. 轻金属, 2014(9): 65–67. |
| [10] | 朱福兴, 程晓哲, 马尚润, 等. 影响流水线镁电解稳定运行关键因素研究[J]. 轻金属, 2014(10): 53–57. |
| [11] | 朱福兴, 马尚润, 郑权, 等. 提高流水线镁电解电流效率的研究[J]. 有色金属(冶炼部分), 2015(2): 12–16. |
| [12] | 刘奎仁, 陈建设, 魏绪钧, 等. NdF3-LiF-Nd2O3系熔盐密度的研究[J]. 有色金属(冶炼部分), 2010(1): 26–28. |
| [13] | 高爱民, 李运刚, 李智慧, 等. NaCl-KCl-NaF-(SiO2) 熔盐体系密度[J]. 稀有金属, 2010(1): 26–28. |
| [14] | 谢刚. 熔融盐理论与应用[M]. 北京: 冶金工业出版社, 1998. |
| [15] | 赵飞, 陈志远, 陈洪智, 等. 1090 K下MgCl2-KCl-CaCl2三元熔盐体系的密度预测[J]. 有色金属科学与工程, 2014, 5(4): 44–48. |
| [16] | 马尚润, 朱福兴, 穆天柱, 等. 流水线镁电解槽电解质导电性研究[J]. 有色金属(冶炼部分), 2015(6): 31–35. |
| [17] | 杨宝刚, 于佩志, 李冰, 等. MgO在氯化镁电解过程中的电泳行为[J]. 轻金属, 2000(10): 43–45. |
 2017, Vol. 8
2017, Vol. 8


