| 甲醇/乙醇-氢气还原铁矿石制备Fe3C研究 |
b. 北京科技大学, 高效钢铁冶金国家重点实验室, 北京 100083
b. State Key Lab of Advanced Metallurgy, University of Science and Technology Beijing, Beijing 100083, China
Fe3C作为优质废钢的替代物之一, 在冶金界有着广泛的应用[1]. Fe3C是直接还原铁的一种, 杂质元素含量低, 炼钢过程中作为炉料加入, 具有稀释钢中有害元素、降低气体和夹杂物含量的作用[2-6]. Fe3C在电炉炼钢中表现出极大的优越性, 生产工艺简单, 投资少、成本低、环境污染小, 还可以作为储氢材料, 在相关领域具有较大的应用前景[7-9].当前, Fe3C的生产和应用已进入商业化实用阶段, 但还存在不少问题[10].
传统的碳化铁生产工艺对资源的要求较高, 目前碳化铁的生产流程尚未摆脱对天然气的依赖, 然而在天然气匮乏的地区碳化铁的生产将受到很大的限制.武汉科技大学李光强等[11]采用固定床法使用CH4-H2混合气体成功制备Fe3C.该生产工艺存在固有的不足:受地区条件的制约, CH4-H2混合气体生产碳化铁的工艺难以形成大规模的产业化.另外, 固定床试验表明, 即使还原反应进行到相当长的时间, 矿石还原度、金属化率、碳化铁率仍较低, 化学反应距离热力学平衡状态很远, 反应时间过长意味着消耗更多的还原气体, 成本显著增加, 必须通过改善或强化动力学条件来促进反应在短时间内达到平衡, 因此碳化铁的生产需要向利用流化床设备的方向发展.
到目前为止, 各种煤气都不能很好地提供合格的还原气氛, 煤制气产生大量的粉尘, 脱除设备复杂, 热量损失大; 煤制气制出的还原气CH4含量偏高; 某些方法间歇式操作, 煤气成分波动大; 煤制气要求提供具有一定强度和粒度的煤块, 成本较高; 煤制气生成能力不足.经济、廉价、环保的还原气源是实现碳化铁工业化的前提, 碳化铁的生产需遵循可持续发展的原则, 明确研究方向, 有针对性的开展工作.
甲醇是当前一碳化工产品中最受重视的品种, 常常被称为一碳化学的突破口.作为清洁的液体能源, 甲醇具有广阔的发展前景. CO-H2常作为还原铁矿石制备碳化铁的气体, 高温下的CO和H2在催化剂条件下可以合成甲醇气体.甲醇含有碳、氢元素, 可以考虑作为CO、H2气体的合成气使用.现提出利用甲醇还原铁矿石制备Fe3C的新方法, 将无水甲醇制备的甲醇蒸汽和恒定流速的N2通入高温管式炉内, 探究其还原、碳化性能, 通过控制不同的实验参数条件, 找到制备Fe3C合适的温度、甲醇用量以及氢还原时间.反应结束后, 对还原产物进行X射线衍射分析、电镜扫描(SEM) 表征, 分析其微观形态, 测试物相组成, 并进行化学分析确定各组分含量, 根据产物情况改进反应的参数, 寻找甲醇的替代品, 以进一步优化还原工艺, 提高反应效率、降低生产成本.
1 实验 1.1 原料分析试验原料为进口的巴西球团矿, 采用日本理学SmartLab型X射线衍射仪(Cu射线, ε=0.154 06 nm, 扫描速度20 °/min, 测试范围10°~90°) 测试球团的晶体结构.该球团成分的XRD分析结果如图 1所示, 它与氧化铁的标准卡相比, 两者的衍射峰位置和强度近似完全相同, 该试样衍射峰强度大, 半宽度小, 无杂质峰, 表明氧化铁粉体纯度高, 晶型完整, 主要构成为赤铁矿Fe2O3.
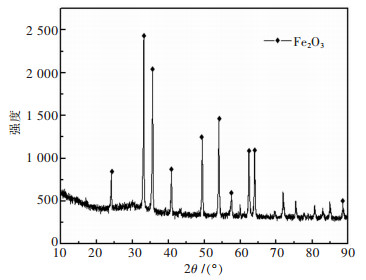 |
| 图 1 巴西矿的X射线衍射谱 Fig. 1 X-ray diffraction pattern of Brazilian ore |
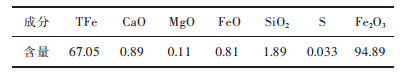
该球团矿从化学成分、物理性能到冶金性能都比较优良, 称得上是全面优质球团矿[12-13], 主要化学成分如表 1所列.从表 1可以看出巴西矿品位较高, 杂质元素硫磷含量少, 符合还原工艺所要求的原料标准.
| 表1 巴西矿化学成分/(质量分数, %) Table 1 Composition of Brazilian ore/ (mass fraction, %) |
 |
| 点击放大 |
1.2 实验方法
试验中的还原设备是KTL1600真空管式炉, SZCL-2A恒温磁力搅拌器为加热装置, QL-500氢气发生器为持续供氢系统, 用BS124S精密电子天平对试样称重.试验用化学试剂为无水甲醇, 实验在真空管式炉中进行, 还原装置如图 2所示.采用X射线衍射仪(日本理学SmartLab型) 对产品做XRD晶相结构分析, 采用美国FEI公司的Quanta-650-FEG场发射扫描电镜(FE-SEM) 对产物的表面形貌进行分析, 并做能谱分析.
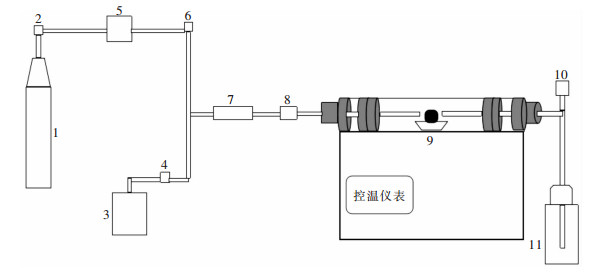 |
| 1.混合气体瓶; 2.流量计; 3.氢气发生器; 4.流量计; 5.磁力搅拌器; 6.流量计; 7.混气阀; 8.流量计; 9.氧化铝坩埚; 10.流量计; 11.集气瓶. 图 2 还原试验装置 Fig. 2 Experimental reduction device |
实验时, 用精密电子天平称量试验球团矿, 记质量为m0.将试样置于刚玉坩埚中, 推至管式炉恒温区.安装好炉塞及法兰, 检测装置的气密性.通入N2, 排尽反应装置内的气体.将真空管式炉升温到700 ℃, 恒温后停止N2通入.以500 mL/min的流量向反应管内通入H2进行还原, 持续120 min.将100 mL的无水甲醇封装于密闭的蓝盖瓶中, 密闭容器置于恒温磁力搅拌器内, 启动磁力搅拌装置加热, 升温至73 ℃保持恒定, 开启气体瓶减压阀, 以恒定压力的N2将甲醇蒸汽压入混气阀, 混匀后由混气阀注入管式炉中.甲醇气体输入完毕, 关闭磁力搅拌器, 改通N2保护, 待管式炉降至室温, 停止N2通入.取出刚玉坩埚, 称量反应后的球团, 记质量为m∞.还原后, 取试样粉体适量, 进行X射线衍射分析、扫描电镜观测以及化学分析.
2 结果与讨论 2.1 反应进程的表征Alberto和Martin[14]在823~923 K下, 利用CO-H2气体结合热重-差热分析法研究由铁矿石制备Fe3C的过程.结果表明, 铁氧化物向Fe3C转变分两个步骤, 分别是Fe2O3→Fe和Fe →Fe3C.假定氢气-甲醇还原球团的过程与上述步骤类似, 主要分2个环节:铁氧化物的还原; 金属铁的碳化.
为保证足够的铁发生碳化, 必须控制试样在氢还原阶段达到较高的还原度.试样在整个过程中, 先后发生还原和碳化反应.在不同的反应阶段, 反应进度表达式不同, 假设还原阶段参与反应的氧化物全部为Fe2O3, 碳化阶段反应生成的铁碳化物全部为Fe3C[15-16].
还原阶段发生的反应:
| $ {\rm{F}}{{\rm{e}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}\left( {\rm{s}} \right){\rm{ + 3}}{{\rm{H}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ = 2Fe}}\left( {\rm{s}} \right){\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\left( {\rm{g}} \right) $ |
试样在还原过程中, 还原进度可由质量变化来测定, 主要物相Fe2O3在还原反应的t时刻, 其还原进度a用式(1) 表示:
| $ a = \frac{{\left( {{m_0}-{m_t}} \right)}}{{{m_{{\rm{F}}{{\rm{e}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}}} \times \frac{{16 \times 3}}{{160}}}} = \frac{{10\left( {{m_0}-{m_t}} \right)}}{{3{m_{{\rm{F}}{{\rm{e}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}}}}} $ | (1) |
式(1) 中, m0为试样在还原初始时的质量; mt为试样在还原进行到t时刻的质量; mFe2O3为试样还原前内含的氧化铁质量.
碳化阶段发生的反应为:
| $ {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{OH(g) + 3Fe(s) = F}}{{\rm{e}}_{\rm{3}}}{\rm{C(s) + }}{{\rm{H}}_{\rm{2}}}{\rm{(g) + }}{{\rm{H}}_{\rm{2}}}{\rm{O(g)}} $ |
其碳化进度x用式(2) 表示:
| $ \begin{array}{l} x = \frac{{碳化曾重量}}{{理论完全碳化的曾重量}} = \\ \frac{{\Delta {m_C}}}{{{m_{{\rm{F}}{{\rm{e}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}}} \times \frac{{56 \times 2}}{{160}} \times \frac{{12}}{{56 \times 3}}}} = \frac{{20\Delta {m_C}}}{{{m_{{\rm{F}}{{\rm{e}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}}}}} \end{array} $ | (2) |
式(2) 中, mFe2O3为球团试样中Fe2O3的质量; ΔmC为碳化过程中增加的质量.
两个阶段不可割裂, 还原度的表征需要统一起来.实际上, 铁氧化物还原尚未终止, 碳化已开始, 因而第2个阶段的碳化增重量难以确定.最终定量分析以矿石在反应流程中的失氧率来衡量还原度R, 用式(3) 表示:
| $ R = \frac{{{O_{{\rm{Loss}}}}}}{{{O_t}}} \times 100\% $ | (3) |
式(3) 中, Ot为还原前矿石中的总氧量; OLoss为还原前后矿石的失氧量.
设产物中的化合碳以Fe3C的形式存在, 碳化铁率MC定义为Fe3C中的铁占全铁中的比率, 用式(4) 表示:
| $ {M_C} = \frac{{14 \times {C_{\rm{h}}}}}{{T{\rm{Fe}}}} \times 100\% $ | (4) |
式(4) 中, Ch为还原产物中的化合碳量; TFe为反应后矿石全铁含量.
2.2 碳化铁的生成 2.2.1 还原时间对还原度的影响在700 ℃的不同时间下进行氢还原实验, 实验分5组进行.考察还原时间为40 min、80 min、120 min、160 min、200 min的条件下, 还原时间对还原度的影响.实验结果表明, 当还原时间为40 min时, 还原度为42 %; 当还原时间为80 min时, 还原度为54 %; 当还原时间为120 min时, 还原度为82 %; 当还原进行到160 min时, 反应已基本完成, 此时还原度为92.5 %.还原初始时, 速率较快, 此后速率转而变慢, 继而又经历加快的过程, 此后, 还原的速率又逐渐降低.反应时间达120 min时, 还原度超过80 %.
要达到较高的还原度, 必须尽可能保证还原时间充分, 然而氢还原时间过长不仅会造成还原度和金属化率过高, 产生黏结现象, 还会使还原产物的比表面积迅速减小, 对随后的金属铁向Fe3C的转化不利, 因此还原时间不宜过长, 设定第1阶段氢还原的时间为120 min.
2.2.2 反应温度的选择相关研究表明[17]:随着反应温度的提高, 试样还原速率将明显加快, 同反应气氛相比, 反应温度对还原度的影响更大.在较高的温度条件下, 试样能在较短的时间内达到开始碳化所要求的还原度.反应温度的提高, 也为碳化铁形核创造良好条件, 在较高反应温度下, 碳化铁能较早的生成, 并在前期保持较高的碳化铁转化速度.
但是在过高的温度下, 反应过程中试样的比表面积急剧减少, 这对碳化铁的形核与长大非常不利, 使得反应中后期不能保持较高的碳化铁转化速率, 影响碳化反应效率.温度过高不仅会使球团发生黏结, 还可能加剧析碳, 因此对温度必须加以控制.而采用过低的反应温度又会使还原阶段用时大幅度的增加, 而且不利于碳化发生.根据Jianqiang Zhang等[18]的研究, 碳化铁在低于1 023K时不容易发生分解, 这有利于碳化铁的稳定.综合考虑, 实验选择在700 ℃下进行.
2.2.3 产物的物相分析在700 ℃的H2-CH3OH气氛下, 还原质量为6.71 g的球团矿, 球团经H2还原120 min后, 再通入100 mL无水甲醇蒸馏制得的气体还原, 反应后的球团质量为5.37 g.还原后, 球团表层有碳黑积聚, 剖开球团, 内部晶粒呈灰白色, 疑似为Fe3C.为确定其物相组成, 用玛瑙研钵细磨至0.074 mm以下, 用X射线粉末衍射仪分析, 结果如图 3所示.
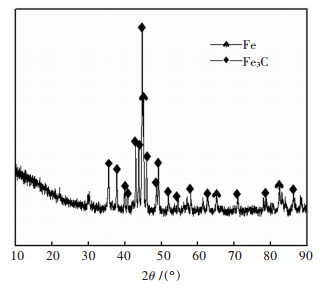 |
| 图 3 氢气和甲醇还原后的球团成分XRD分析 Fig. 3 XRD patterns of pellets after hydrogen and methanol reduction |
产物主要成分为Fe和Fe3C, 产物中Fe3C的相对衍射强度最高, 为产物的主晶相. Fe3C是碳化铁的一种, 铁的碳化物通常存在4种类型: ε-碳化物、ε-碳化物、θ-碳化物和立方晶系的碳化物[19].实验主要产物为θ-碳化物, 即斜方结构的Fe3C, 未见其他类型的碳化铁出现.还原后的球团内依然存在一部分尚未碳化的金属铁, 根据化学分析结果, 碳化铁率达到85 %, Fe3C占较高的比例, 同XRD分析结果中Fe3C为产物主要组成的结论一致.结果表明, 在700 ℃的H2-CH3OH气氛下, 运用两步法还原可制备Fe3C, Fe3C和Fe在700 ℃下共存.
2.3 甲醇还原性的研究在700 ℃下进行第1组实验, 无水甲醇用量60 mL, 甲醇汽化50 min.球团初始质量9.23 g, 反应后为8.82 g, 未经氢气还原过程.相同温度下, 再进行第2组实验, 氢还原持续120 min, 无水甲醇用量60 mL, 甲醇汽化50 min, 球团初始质量6.71 g, 还原后为4.74 g.
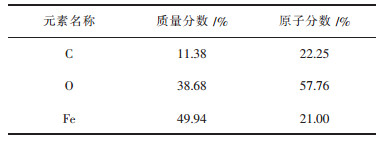
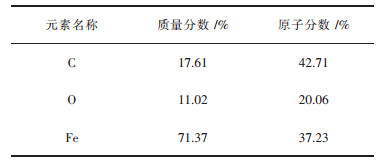
反应结束, 对产物进行XRD分析.第一组实验结束, 球团外观呈现深灰色, 表面出现裂纹, 有碳黑聚集于表层.依据XRD分析结果, 物相主要为Fe3O4、FeO, 还含少量的C, 但无Fe3C产生.将还原后的产物在SEM下观察, 如图 4(a)所示, 产物晶体结构致密, 大部分片块状的Fe3O4.对产物进行面扫描, 得表 2的能谱数据, 知产物氧含量高, 还原度低.第二组实验结束, 球团外出现析碳现象, 球团内外分两层, 外层显黑色, 内部为灰白色晶粒.在SEM下观察产物的形貌如图 4(b)所示, 根据形貌主要分为两部分, 深灰色块状的是金属Fe晶相, 周围灰白色斜方结构的晶相是Fe3C, Fe3C分布在Fe的外部, 形状不规则, 易知碳化是从外向内进行的.结合XRD分析结果, 确定主要产物为Fe3C、Fe、Fe3O4, 按表 3的能谱数据, 碳的质量比为17.61 %, 铁的质量分数为71.37 %, 氧的质量分数为11.02 %, 此时还原度较高, 氧含量较低, 还原度为66.45 %, 碳化铁率为62.5 %.
 |
| 图 4 还原后的产物扫描电镜像 Fig. 4 SEM image of products after reduction |
| 表2 甲醇还原后产物的能谱数据 Table 2 EDS data of products after methanol reduction |
 |
| 点击放大 |
| 表3 氢气-甲醇还原后的产物能谱数据 Table 3 EDS data of products after hydrogen and methanol reduction |
 |
| 点击放大 |
两组实验产物的XRD对比结果如图 5所示.结果表明, 700 ℃下, 氢气是制备Fe3C的必要条件.该温度下, 与氮气混合通入的甲醇气体不具有还原铁矿石制备Fe3C的性能.第1步还原时, 铁矿石需达到多高的还原度才能进行碳化反应, 尚待探究.
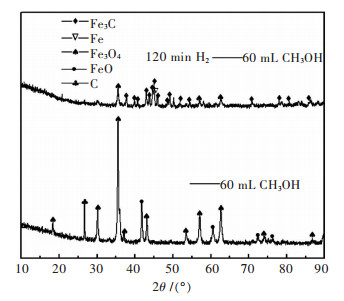 |
| 图 5 实验结果的XRD对照 Fig. 5 X-ray powder diffraction patterns of experiment results |
2.4 甲醇量对碳化铁生成的影响
由于甲醇量对碳化铁生成有很大的影响, 因此考察无水甲醇的用量对碳化铁率的影响.在700 ℃下进行还原, 第1阶段还原时间为120 min, 第2阶段分别选择15 mL、30 mL、45 mL、60 mL和75 mL作为甲醇试剂的用量.对产物进行SEM分析, 进行扫描做能谱分析, 通过化学分析得碳化铁率与甲醇量的关系如图 6所示.结果表明, 随着无水甲醇试剂的增多, 碳化铁率逐渐增大, 这是因为甲醇量的增大保证了产物中自由碳的增多, 达到饱和的自由碳也增多, 形成的碳化铁也足够多.甲醇用量低于45 mL, 碳化铁转化率较低; 甲醇量在60 mL、75 mL时, 碳化铁率超过60 %.欲达到较高的碳化铁率, 无水甲醇试剂用量不低于60 mL.
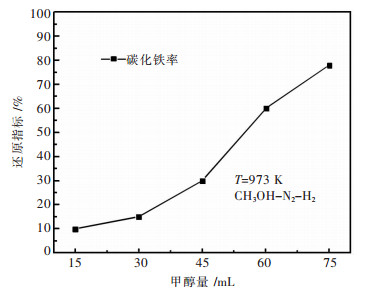 |
| 图 6 973 K下碳化铁率与甲醇量之间的关系 Fig. 6 Relationship of between iron carbide ratio and methanol content at 973 K |
2.5 反应温度对碳化铁生成的影响
反应温度是影响Fe3C制备的重要因素, 图 7所示为120 min氢还原时间、60 mL甲醇用量的不同温度条件下气体还原铁矿石的实验结果.对质量相近的球团进行还原, 探究温度对Fe3C生成的影响.
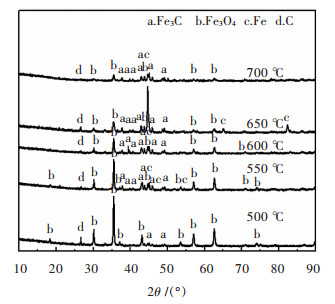 |
| 图 7 不同反应温度下样品的XRD谱 Fig. 7 XRD patterns of samples treated at different temperature |
从不同温度下样品粉末的XRD图谱可以看出, 在500 ℃下, 大部分是Fe3O4峰, Fe3C的衍射峰较低, 未见明显的Fe的衍射峰出现, 碳元素以单质形式存在, 其峰强度高于Fe3C.随着反应温度的升高, 到550 ℃时, 开始出现明显的Fe3C衍射峰, Fe3O4衍射峰变弱, Fe的衍射峰也开始出现.随着温度的升高, Fe3C衍射峰的强度逐渐增大, Fe3O4衍射峰变弱. 650 ℃下, 产物中的Fe和C的衍射峰都处最强状态.700 ℃时, Fe衍射峰变弱, Fe3C衍射峰最强, Fe3O4衍射峰最弱.可推知, 650 ℃下还原出的Fe达到很高的比重, 随着温度的升高, 部分Fe发生碳化, Fe含量转而降低, Fe3C含量变高.反应温度选择在550 ℃以上为宜, 碳化铁率随温度的升高而逐渐增大, 700 ℃是制备Fe3C的最优反应温度.
2.6 氢还原时间对碳化铁生成的影响在恒定的温度、甲醇量条件下, 探究氢还原时间对Fe3C生成的影响.实验在700 ℃、甲醇用量60 mL的条件下进行.
不同氢还原时间下, 样品的XRD谱如图 8所示.结果表明, 氢气未参与、氢气还原为30 min时, 均无Fe3C衍射峰出现.氢气还原60 min时, 开始出现微弱的Fe3C衍射峰. 90 min及120 min时, 产物中的Fe3C峰明显增强, 90 min时, 产物中的C含量最多. 120 min时的Fe3C的衍射峰强度明显高于90 min时, 而Fe的峰强度低于90 min时.理论上, 纯氢气还原下, 120 min还原度最高对应的Fe的衍射峰应最高, 而在此实验气氛条件下, 由于伴随着碳化过程, 因而Fe3C衍射峰增强, 120 min对应的Fe的峰值不增反减.由此可知, 还原度影响碳化铁率.在恒定的温度以及甲醇试剂用量条件下, 矿石达到较高的还原度, 碳化程度也随之加剧, 进而影响Fe的百分含量.氢还原时间直接影响还原度的大小, 通过还原度影响Fe3C的转化率, 对碳化铁制备的影响显著.
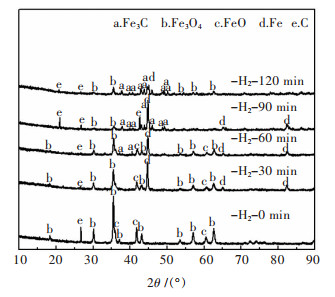 |
| 图 8 不同氢还原时间下样品的XRD谱 Fig. 8 XRD patterns of samples treated at different hydrogen reduction time |
2.7 球团表面析碳现象分析
实验中出现大量游离碳吸附在球团表面的析碳现象.甲醇量足够多、高温持续时间足够长时, 游离碳愈多.碳来源于甲醇, 测试结果显示甲醇中的碳最终以石墨碳和组成碳化铁的形式存在.
500 ℃下还原的球团表面未见游离碳聚集, 其他温度的情形下均出现析碳现象.可见在足够高的温度下, 析碳现象就能够发生.表明温度越高, 析碳程度越高.在氢气未参与还原, 甲醇气体还原铁矿石情形下, 也伴有析碳现象, 表明析碳现象的出现与氢气是否参与还原无关.
研究表明, 析碳反应的产生是生成Fe3C的前提条件, 但过量的析碳反应产生的碳黑将堵塞还原气体进入反应物内部的通道, 使外部气体进入反应物内部的扩散成为生成Fe3C的限制环节, 降低Fe3C的生成速度.在碳沉积层, Fe3C量较少; 在析碳层包覆着的内部, Fe3C含量则相当高.甲醇量越多, 碳沉积越剧烈, 故甲醇量需控制在合理的范围内.
因此, 可考虑在还原气体中配加少量H2S气体, 通过控制气相硫活度来实现对析碳反应的有效抑制[20], 以提高Fe3C的转化率.具体抑制碳沉积到何程度, 还需进一步明确.
2.8 乙醇代替甲醇的可行性探究甲醇具有毒性, 价格成本高, 因而寻找经济、低廉的还原剂是开发还原工艺的新方向.现采用乙醇代替甲醇, 探究其还原矿石制备Fe3C的性能.
实验分两组进行.第一组在700 ℃下进行, 无水乙醇用量100 mL, 水浴温度设置为82 ℃, 乙醇汽化80 min, 未经氢还原流程.球团初始质量7.01 g, 反应后为7.46 g.在相同温度下, 再进行第二组实验.球团初始质量7.73 g, 还原后为6.70 g.通氢环节持续120 min, 无水乙醇用量100 mL.水浴温度设为82 ℃, 乙醇汽化80 min.
第一组实验后, 球团外层出现裂纹, 伴有析碳现象.根据产物粉体的XRD分析结果, Fe3C衍射峰较低, Fe3O4衍射峰最高, Fe的衍射峰仅次于Fe3O4峰, 还原度低, 析碳使球团增重.第二组实验, 球团外层也出现析碳现象, 根据SEM分析结果, 外层主要物相是Fe和C, O含量较低.能谱分析数据表明外层的C含量高达85 %.球团内部为灰白色晶粒体, 经XRD分析, 可确定主要产物是Fe3C和Fe.
由实验结果可知, 700 ℃下的纯乙醇气体还原铁矿石制得的Fe3C量较少, 纯乙醇能够还原铁矿石制得Fe3C.为进一步确定乙醇较于甲醇的还原效果, 在700 ℃下进行新实验, 通氢流程持续120 min, 无水乙醇用量60 mL, 将产物的XRD分析结果和相同参数条件下甲醇对应的还原产物相比较.
图 9所示为XRD对比结果.相同温度条件下, 乙醇和氢气混合气按两步法, 在较高还原度基础上还原铁矿石制备Fe3C的效果较好, 产物中Fe3C含量高.从衍射峰的强度对比能够判定, 乙醇参与还原制备Fe3C的性能优于甲醇.综上, 乙醇能够代替甲醇作为碳源制备Fe3C.
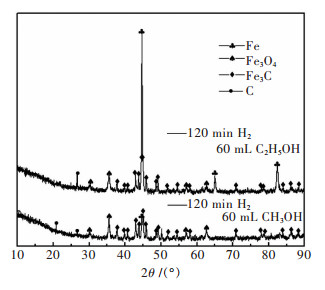 |
| 图 9 不同试剂条件下产物的XRD谱 Fig. 9 XRD patterns of samples treated at different reagents |
3 结论
1) 实验结果表明, 在一定的温度条件下, 可以利用氢气-甲醇混合气按两步法制备Fe3C.
2) 纯甲醇还原球团矿制备Fe3C的性能较弱, 铁氧化物达到一定的还原度是制备Fe3C的必要条件.
3) 氢气-甲醇气氛下制备Fe3C选择在550 ℃以上进行为宜, 700 ℃下制备Fe3C的效果较好.
4) 乙醇可以作为甲醇的替代品用于制备Fe3C, 还原效果优于甲醇.
5) 两步法制备Fe3C工艺, 第一阶段还原时间较之于反应的温度影响碳化铁率更为显著; 第二阶段, 足够的无水甲醇试剂量才能保证较高的Fe3C生成率.甲醇量过多, 析碳现象加剧, 甲醇用量需得到控制.
| [1] | 李光强, 杨剑, 王恒辉, 等. 矿粉粒度及反应温度对高磷鲕状赤铁矿制备碳化铁的影响[J]. 重庆大学学报, 2015, 38(6): 1–10. |
| [2] | 刘润藻.大型超高功率电弧炉炼钢综合节能技术研究[D].沈阳:东北大学, 2006. |
| [3] | 张玲娜, 陶金慧, 纪开吉, 等. 碳/碳化铁复合介孔材料的合成及储氢性能[J]. 高等学校化学学报, 2014(6): 1318–1322. |
| [4] | 王德永, 闵义, 刘承军, 等. 利用CO-CO2-H2混合气体生产碳化铁的实验研究[J]. 过程工程学报, 2007, 7(2): 332–336. |
| [5] | 李金波, 吕庆. 转炉煤气制备碳化铁的基础研究[J]. 河北理工大学学报(自然科学版), 2008(1): 26–29. |
| [6] | 何强, 李光强, 吴仕慈, 等. V2O3、Al2O3添加剂对碳化铁生成的影响[J]. 钢铁钒钛, 2008(2): 27–31. |
| [7] | 王晓明.氧化物添加剂促进碳化铁生成的作用机理研究[D].武汉:武汉科技大学, 2010. |
| [8] | 易凌云.铁矿球团CO-H2混合气体气基直接还原基础研究[D].长沙:中南大学, 2013. |
| [9] | 马江华.碳化铁制备过程中原料微观结构和氧化物添加剂的影响[D].武汉:武汉科技大学, 2006. |
| [10] | 倪红卫, 章奉山, 苍大强, 等. 二步法制备碳化铁的基础研究[J]. 钢铁研究学报, 2001(4): 1–5. |
| [11] |
LI G Q, MA J H, NI H W, et al. Influences of oxide additions on formation reaction of iron carbide at 1023 K[J].
ISIJ International, 2006, 46(7): 981–986. DOI: 10.2355/isijinternational.46.981. |
| [12] | 温力士.强化巴西赤铁矿链篦机-回转窑球团焙烧技术及其在中国的工业应用[D].长沙:中南大学, 2012. |
| [13] | 李献辉.基于混合模型的球团矿化学成分预报的研究[D].沈阳:东北大学, 2009. |
| [14] |
ALBERTO N, MARTINS P. Conversion of hematite to iron carbides by gas phase carburization[J].
ISIJ International, 2004, 44(6): 992–998. DOI: 10.2355/isijinternational.44.992. |
| [15] |
KIM J H, KIM J, PARK J, et al. Synthesis is of carbon-encap-sulated iron carbide nanoparticles on a polyimide thin film[J].
Nanotechnology, 2007, 18(11): 115609. DOI: 10.1088/0957-4484/18/11/115609. |
| [16] |
BAHGAT M. Technology of iron carbide synthesis[J].
Journal of Materials Science & Technology, 2006, 22(3): 423–432. |
| [17] | 王德永, 惠银安, 闵义, 等. 利用催化剂促进碳化铁生成速度的基础性研究[J]. 东北大学学报, 2001, 22(1): 87–90. |
| [18] |
ZHANG J Q, OSTROVSK O. Cementite formation in CH4-H2-Ar gas mixture and cementite stability[J].
ISIJ International, 2001, 41(4): 33–339. |
| [19] |
YANG K Y, XU W, ZHANG Y, et al. Synthesis and characteristics of Fe3C nanoparticles embeded in amorphous carbon matrix[J].
Chemical Research in Chinese Universities, 2010, 26(3): 348. |
| [20] | 王德永, 刘承军, 姜茂发. 炼钢新原料-碳化铁的表征与制备技术[M]. 北京: 科学出版社, 2012. |
 2017, Vol. 8
2017, Vol. 8


