| 选择性磷酸沉淀分离铬铁的新工艺 |
2. 北京科技大学 冶金与生态工程学院, 北京 100083;
3. 北京矿冶研究总院 冶金研究设计所, 北京100070
2. School of Metallurgical and Ecological Engineering, University of Science and Technology Beijing, Beijing 100083, China;
3. Institute ofMetallurgical Research and Design, Beijing General Research Institute of Mining and Metallurgy, Beijing 100070, China
铬、铁化学性质相近,在酸性水溶液中,铬铁分离是一大难题。目前,自酸性溶液中分离铬铁,方法主要有溶剂萃取法[1-2]和化学沉淀法[3],多是基于优先除铁的思想。以溶剂萃取法为例,以膦酸类萃取剂P204萃取除铁时,在水相料液pH值为1.5条件下,铁萃取率虽可达99%以上,但铬会发生明显共萃,铬损失率约25%[4]。当化学沉淀法应用于酸性水溶液除铁时,也存在铬损失明显的问题。比如,中和水解法形成的Fe(OH)3沉淀往往以无定形胶体形态存在,难以过滤而且会大量吸附铬及其他有价金属,由此导致铬损失;采用黄钾铁矾法除铁时,在形成铁矾的同时还会形成铬矾,因此,铬损失也再所难免,而针铁矿法除铁时铬损失率也达到15%左右[5];草酸亚铁沉淀法[6]是一种有效分离铬铁的方法,该法利用草酸亚铁溶度积较低(ksp=2.1×10-7,25 ℃)的性质,在pH值为4.0和H2C2O4/Fe摩尔比1.2条件下,除铁率可达98.5%[7],但该法需严格控制草酸加入量以防止草酸亚铁返溶,而且对溶液中和提出较高要求;相对而言,莫尔盐结晶法[8]溶液中和负荷轻,通过往溶液中加入一定量的硫酸铵,使铬、铁分别生成铬铵矾和亚铁铵矾(莫尔盐),进而利用0 ℃时铬铵矾和亚铁铵矾的溶解度差异(铬铵矾,70 g/L;亚铁铵矾,0.4 g/L),在溶液快速冷却并结晶24 h条件下,使亚铁铵矾结晶析出,而铬则保留在溶液中,铁脱除率可达96%以上,铬损失率低至1.85%,但该法的缺点是蒸发耗时长、冷却操作不易。
除上述外,也有尝试直接自溶液中分离铬。例如,采用溶剂萃取法直接分离提取铬时,酸性膦类萃取剂(P204、P507)虽然可以实现铬镍的初步分离,但铬萃取率不高[9-10]。伯胺N1923可以在pH值为4.0条件下萃取Cr(Ⅵ)[11],而且提取率可达95%以上;中性磷类萃取剂TBP可以自盐酸体系中萃取Cr(Ⅵ)[12],但N1923与TBP能否实现铬铁分离,结果不详。还有研究提出采用磷酸沉淀方法脱除硫酸溶液中的铬[13-14]。在溶液pH值为3.0和90 ℃条件下,按理论用量1.4倍投入磷酸钠,虽然铬脱除效果理想(高达99%),但由于溶液中铁主要以Fe(Ⅲ)形态存在,伴随铬沉淀,铁也大量沉淀,沉淀率也高达99%,几乎不能分离铬铁。
以铬铁分离为目标,基于铬优先分离的思想,本文在溶液中Fe3+还原预处理的基础上,提出一种选择性磷酸沉淀以深度分离铬铁的新方法[15-17],该方法既适用于电镀污泥酸浸液中铬的分离回收[18],也为其他含铬物料的铬分离提取提供了一条新的可选途径。
1 实验配制Cr3+/Fe2+混合溶液([Cr3+]初始=6.0 g/L,[Fe2+]初始=3.0~8.0 g/L),在磷酸沉淀实验前调入少量还原剂(Na2SO3),以保证溶液中的铁完全以Fe2+形态存在。调整溶液pH至一定值,升温至设定温度,按PO43-/Cr3+一定摩尔比的量加入Na3PO4作沉淀剂,保温一定时间,搅拌过程中保持400 r/min转速恒定。反应结束后液固分离,计量滤液体积并送分析。对于Cr3+/Fe2+/Zn2+混合溶液、Cr3+/Fe2+/Ni2+混合溶液、Cr3+/Fe2+/Cu2+混合溶液以及Cr3+/Fe2+/Ni2+/Zn2+多离子混合溶液的沉淀反应,操作同前。
金属沉淀率计算按下式:
| $Me\% = \frac{{{C_0} \times {V_0} - {C_1} \times {V_1}}}{{{C_0} \times {V_0}}} \times 100\% $ |
式中,C0为沉淀前溶液中金属元素的浓度(g/L),V0为沉淀前溶液体积(L),C1为沉淀后液中金属元素的浓度(g/L),V1为沉淀后溶液体积(L)。
实验所用硫酸铬、硫酸亚铁、硫酸镍、硫酸锌、硫酸铜等试剂均为分析纯。
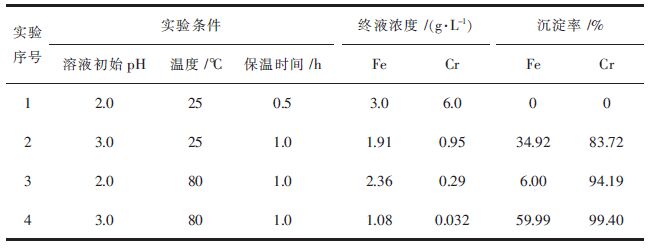
2 结果与讨论 2.1 探索性实验以含[Cr3+]初始=6.0 g/L、[Fe2+]初始=3.0 g/L的溶液作实验料液,经调整溶液初始pH后,按PO43-/Cr3+摩尔比0.375的量加入Na3PO4,保温一定时间,实验结果如表 1所示。
| 表1 磷酸沉淀分离铬铁的探索性实验 Table 1 Exploration tests of phosphate precipitation for Cr/Fe separation |
 |
| 点击放大 |
由表 1可见,在常温及溶液初始pH值为2.0条件下几乎未生成任何沉淀。随溶液初始pH值或温度升高,铬、铁出现或多或少的沉淀。对于实验3而言,在溶液初始pH值为2.0和80 ℃条件下保温1.0 h,铬沉淀率达到了94.19%,而铁沉淀率仅6.0%,铬铁分离系数达到15.7;在温度及保温时间不变情况下,随溶液初始pH值提高至3.0,铬沉淀率略增至99.40%,铁沉淀率则明显提高至59.99%,铬铁分离系数显著降低。
由上述可见,在调整溶液初始pH值、反应温度及保温时间等条件下,有可能实现铬的选择性沉淀以及理想的铬铁分离结果。
2.2 工艺条件的影响 2.2.1 Na3PO4用量的影响基于Cr3+/Fe2+混合溶液([Cr3+]初始=6.0 g/L,[Fe2+]初始=3.0 g/L),在溶液初始pH值为2.0、80 ℃保温60 min等条件下,考察沉淀剂Na3PO4的用量对铬铁分离的影响。Na3PO4用量按PO43-/Cr3+摩尔比计。实验结果如图 1所示。
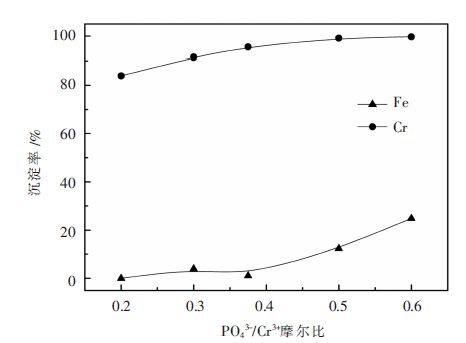 |
| 图 1 Na3PO4用量对铬铁分离的影响 Fig. 1 Effect of Na3PO4 dosage on Cr/Fe separation |
由图 1可见,随PO43-/Cr3+摩尔比在0.2~0.375范围内变化时,铁沉淀微乎其微,而铬沉淀率最高可达95.56%。随PO43-/Cr3+摩尔比进一步提高至0.5,铬沉淀率可增大至99%以上,但同时铁也发生明显沉淀。因此,Na3PO4用量按PO43-/Cr3+摩尔比0.375计为宜,在该条件下,铬沉淀率高达95.56%,铁沉淀率低至1.08%,沉淀终液中铬浓度降至0.25 g/L,铁浓度略降至2.80 g/L。
2.2.2 溶液初始pH的影响基于Cr3+/Fe2+混合溶液([Cr3+]初始=6.0 g/L,[Fe2+]初始=3.0 g/L),Na3PO4用量按PO43-/Cr3+摩尔比0.375计,80 ℃保温60 min,考察沉铬反应开始时的pH值条件,实验结果如图 2所示。
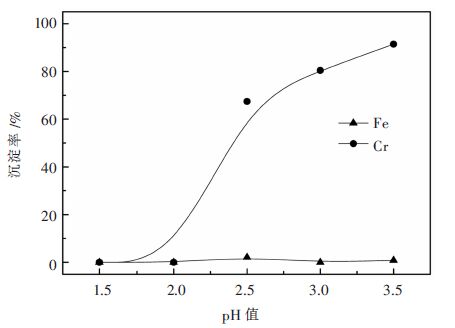 |
| 图 2 加入Na3PO4后溶液pH对铬铁分离的影响 Fig. 2 Effect of solution pH after addition of Na3PO4 on Cr/Fe separation |
由图 2可见,在加入Na3PO4后,当溶液pH值为1.5或2.0时,几乎没有铬沉淀生成,当pH升高至2.5时,铬出现明显沉淀。由此可以判断,铬开始发生磷酸沉淀的pH值介于2.0~2.5之间,溶液中的Fe2+离子在本实验pH范围内不发生沉淀。
实验中还发现,随Na3PO4缓慢引入,溶液体系pH有增大趋势,这可能是由于PO43-水解之故,而随沉淀反应进行,PO43-不断被消耗,体系pH又呈降低趋势。为方便沉淀操作,拟对Na3PO4引入前的溶液初始pH值进行合理控制,沉淀过程中不再调整pH值,其他实验条件同前。溶液初始pH值对铬铁分离的影响如图 3所示。
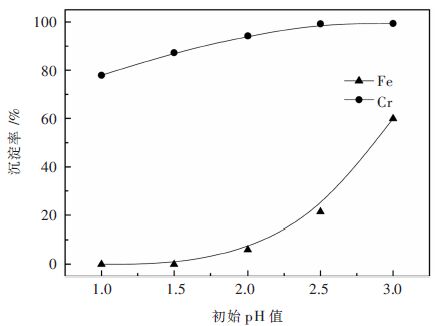 |
| 图 3 Na3PO4加入前溶液初始pH对铬铁分离的影响 Fig. 3 Effect of initial pH of solution before addition of Na3PO4 on Cr/Fe separation |
由图 3可见,随溶液初始pH值由1.0提高至2.0时,铁沉淀微乎其微,而铬沉淀率则由77.92%提高至95.56%,沉淀终液中铬浓度由1.34 g/L降至0.25 g/L。随初始pH值进一步提高,虽然铬沉淀趋于完全,但是铁也发生明显沉淀,当初始pH值为3.0时,铁沉淀率高达60%。为保证铬铁有效分离,溶液初始pH值选择2.0为宜。
2.2.3 温度的影响设定溶液初始pH值为2.0,随后加热至实验温度,按PO43-/Cr3+摩尔比0.375的量加入Na3PO4并保温60 min。在上述条件下,考察温度对铬铁分离的影响。
由图 4可见,温度对铬沉淀的影响还是比较明显的。随温度升高至60 ℃,铬沉淀率由69.63%增大至89.67%,沉淀终液中铬浓度由1.69 g/L降至0.59 g/L;随温度进一步升高至80 ℃和90 ℃,铬沉淀率分别提高至95.56%和98.53%,沉淀终液中铬浓度分别降至0.25 g/L和0.086 g/L。自始至终,铁沉淀微乎其微,铬铁分离效果理想。因此,温度可在80~90 ℃之间选择。
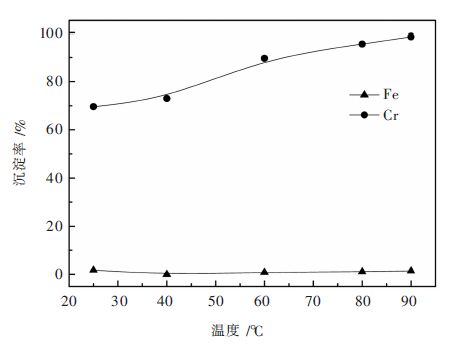 |
| 图 4 反应温度对铬铁沉淀分离的影响 Fig. 4 Effect of reaction temperature on Cr/Fe separation |
2.2.4 保温时间的影响
基于2.2.3实验结果,分别在T=80 ℃、溶液初始pH值为1.5和T=90 ℃、溶液初始pH值为2.0条件下考察保温时间对铬铁分离的影响。Na3PO4加入量按PO43-/Cr3+摩尔比0.375计,实验结果分别如图 5、图 6所示。
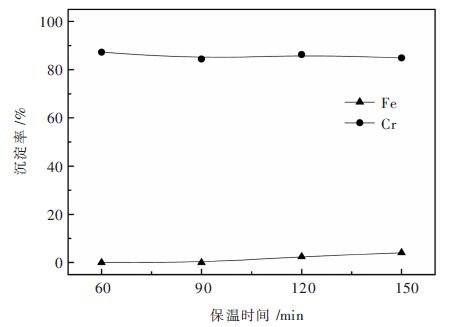 |
| 图 5 溶液初始pH值为1.5和80 ℃条件下保温时间对铬铁分离的影响 Fig. 5 Effect of precipitation time on Cr/Fe separation at initial pH of 1.5 of solution and T=80 ℃ |
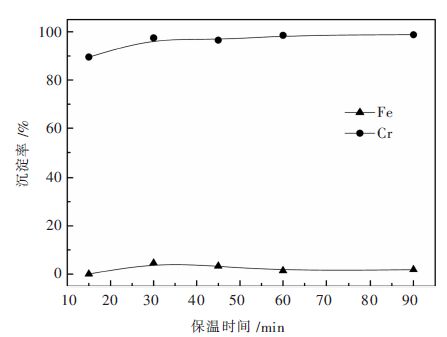 |
| 图 6 溶液初始pH值为2.0和90 ℃条件下保温时间对铬铁分离的影响 Fig. 6 Effect of reaction time on Cr/Fe separation at initial pH of 2.0 of solution and T=90 ℃ |
由图 5可见,在T=80 ℃和溶液初始pH值为1.5条件下,在1.5~2.5 h实验范围内,保温时间对铬沉淀无明显影响,保温1 h,沉淀反应就已大量发生,沉淀终液中铬浓度低至0.71 g/L。进一步由图 6可见,在T=90 ℃和溶液初始pH值为2.0条件下,保温时间对铬沉淀也无明显影响,保温仅15 min,铬沉淀率即达89.51%,随保温时间延长至30 min,铬沉淀率提高至97.43%,沉淀终液中铬浓度低至0.71 g/L。在上述两组实验条件下,铁沉淀自始至终甚微,铬铁分离效果理想。
鉴于铬沉淀相对迅速而且保温时间对铬沉淀无明显影响,因此,在T=90 ℃和溶液初始pH值为2.0条件下,保温时间选择30~60 min为宜。
2.3 杂质离子的影响基于2.2实验结果,磷酸选择性沉淀分离Cr/Fe的较优工艺条件可初步确定如下:设定溶液初始pH值为2.0,按PO43-/Cr3+摩尔比0.375的量加入Na3PO4,90 ℃保温60 min。在上述条件下,铬沉淀率可达98.53%,铁沉淀率仅1.42%,沉淀后液中铬浓度可降至0.086 g/L,铬铁分离效果理想。
考察Fe2+、Zn2+、Ni2+、Cu2+等杂质离子对选择性沉铬的影响,实验结果见图 7。
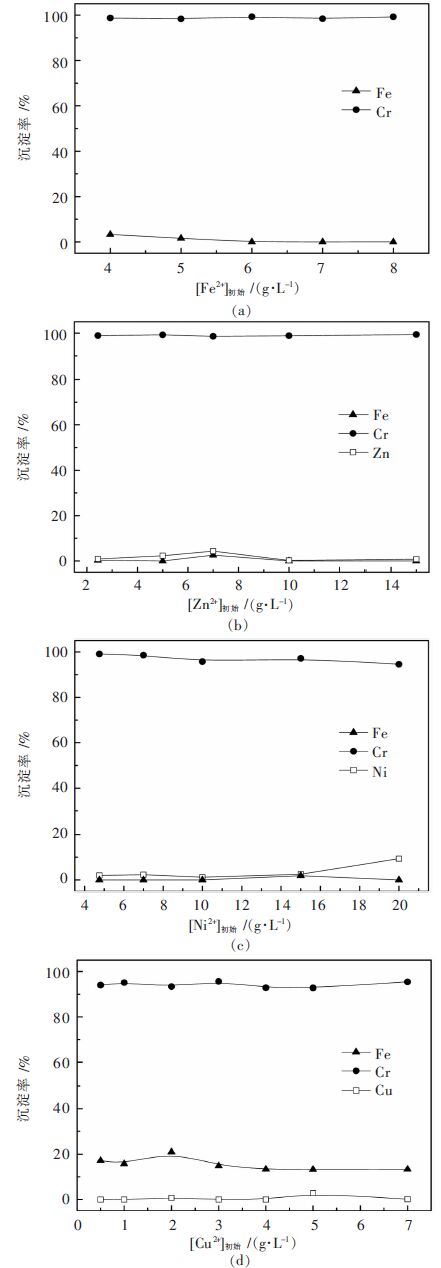 |
| 图 7 金属杂质离子对选择性沉铬的影响 Fig. 7 Effect of impurity metal ions on selective precipitation of Cr |
溶液中的铁保持Fe2+形态,在4.0~8.0 g/L范围内,考察Fe2+浓度变化对铬铁分离的影响。可见,在实验浓度范围内,Fe2+对选择性沉铬无明显影响,即使Fe2+浓度高至8.0 g/L,亦能取得理想的铬铁分离效果。
此外,Zn2+、Ni2+、Cu2+等杂质对选择性沉铬也无明显影响。即使Zn2+浓度高至15.0 g/L,也未见明显的Zn2+或Fe2+沉淀或两者共沉淀,铬沉淀率高达99.35%,在铬沉淀过程中,Zn2+损失率仅0.74%,这可能是沉淀夹带所致;对于Ni2+而言,在4.75~20.0 g/L范围内,铁沉淀率始终保持在一很低水平,铬沉淀率则随Ni2+浓度升高略有降低,特别是当Ni2+浓度高于15.0 g/L后,Ni2+出现一定量共沉淀(沉淀率9.38%)。虽然Ni2+不会对铬铁分离产生明显影响,但为保证有价金属收率,溶液中的Ni2+浓度不宜高于15.0 g/L;对于Cu2+而言,在0.5~7.0 g/L范围内,其对选择性沉铬无明显影响,铬沉淀率在92.75%~95.59%范围内波动,Cu2+几乎未发生任何沉淀,但在Cr3+、Fe2+、Cu2+混合溶液中,铁沉淀率在15%左右波动,这可能是由于溶液中少量Fe2+氧化进而发生沉淀之故。因此,在对实际复杂含铬溶液进行选择性磷酸沉淀分离铬前,最好将溶液中Cu2+预先脱除,并尽可能保持溶液中铁全部以Fe2+形态存在。
在考察金属阳离子杂质对选择性沉铬影响的基础上,进一步考察了阴离子(主要如氯离子)的影响。在1.0~15.0 g/L范围内,Cl-对铬铁分离的影响见图 8。由图 8可见,在实验浓度范围内,Cl-对铬铁分离几乎无影响,铬沉淀率介于95.22%与96.58%之间,沉淀后液中铬浓度约0.25 g/L,铁沉淀微乎其微,铬铁分离效果理想。
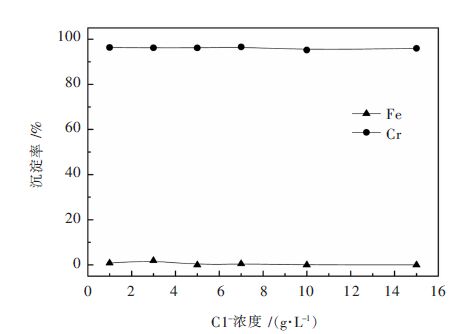 |
| 图 8 氯离子对铬铁分离的影响 Fig. 8 Effect of chloride ion on Cr/Fe separation |
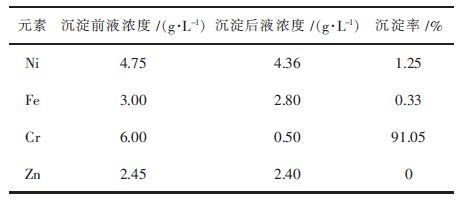
为考察各金属杂质离子之间的交互作用,参照混合电镀污泥实际浸出液(溶剂萃取提铜后)成份配制了Cr3+/Fe2+/Ni2+/Zn2+多离子混合溶液,磷酸沉淀分离铬的实验条件同前,结果见表 2。可见,Ni2+、Fe2+及Zn2+沉淀微乎其微,铬沉淀率则达到91.05%,沉淀后液中铬浓度降至0.5 g/L。混合离子溶液实验结果表明,磷酸沉淀方法可以实现酸性溶液中选择性沉铬的目的。
| 表2 混合离子溶液磷酸沉淀实验结果 Table 2 Phosphate precipitation results of mixed ions solution |
 |
| 点击放大 |
3 结论
1) 选择性磷酸沉淀方法可以实现酸性溶液中铬优先沉淀与铬铁高效分离。
2) 选择性磷酸沉淀分离铬铁的较优工艺为:将溶液中Fe还原成Fe2+,设定溶液初始pH值为2.0,按PO43-/Cr3+摩尔比0.375的量加入Na3PO4,90 ℃保温60 min。在上述条件下,铬沉淀率可达98.53%,铁沉淀率仅1.42%,沉淀后液中铬浓度可降至0.086 g/L,铬铁分离效果理想。
3) 选择性磷酸沉淀方法适用于较宽的铁浓度范围,而且Cu2+、Zn2+、Ni2+及Cl-等杂质离子对选择性沉铬无明显干扰。为保证有价金属收率,溶液中的Ni2+浓度不宜高于15.0 g/L,但Cu2+宜在磷酸沉铬之前预先脱除。
| [1] | 祝万鹏, 杨志华, 关晶, 等. 多组分电镀污泥酸浸出液中铁的分离[J]. 化工环保, 1997, 17(1): 6–11. |
| [2] | 谢梦芹, 牛冬杰, 赵由才. 含铬污泥中铬、铁分离研究[J]. 黑龙江科技学院学报, 2003, 13(4): 9–12. |
| [3] | 胡明成. 制革工业污泥中Cr3+的回收试验[J]. 工业用水与废水, 2003, 34(2): 40–42. |
| [4] | 李雪飞. 电镀污泥中铬的分离工艺研究[D]. 武汉: 华中科技大学, 2006. http://cn.bing.com/academic/profile?id=2687562794&encoded=0&v=paper_preview&mkt=zh-cn |
| [5] | 胡国荣, 李国, 邓新荣, 等. 针铁矿法从铬铁合金硫酸浸出液中除铁[J]. 湿法冶金, 2006, 25(4): 198–200. |
| [6] | 胡国华. 一种从碳素铬铁中生产三氧化二铬和草酸亚铁的方法[P]. 中国专利: 200710034327, 2007-09-26. |
| [7] | 王亲猛. 碳素铬铁中元素有效分离及综合利用研究[D]. 长沙: 中南大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10533-1011179759.htm |
| [8] | 邬建辉, 阳庄伦, 湛菁, 等. 铬铁合金中铬、铁分离研究[J]. 湿法冶金, 2011, 30(1): 51–55. |
| [9] | 范进军. 铬(Ⅲ)的萃取及其碱反萃试验研究[D]. 赣州: 江西理工大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10407-1011043086.htm |
| [10] | 薛亚卓. 酸性磷氧类萃取剂、季铵盐萃取Cr(Ⅲ)的特性[D]. 北京: 清华大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10003-2010215427.htm |
| [11] | 郭玉凤, 崔建升, 李景印. 伯胺N1923反应萃取含Cr6+废水的研究[J]. 环境科学与技术, 2003, 26(5): 15–18. |
| [12] | 谭雄文, 杨运泉, 段正康. 盐酸介质中磷酸三丁酯萃取分离铬(Ⅵ)[J]. 化工进展, 2003, 22(12): 1323–1326. |
| [13] | 周毅. 磷酸盐沉淀法治理含铬废水应用研究[C]. 中国环境科学学会学术年会论文集, 2009: 298~302. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-HJKP200906002061.htm |
| [14] | 陈家镛. 湿法冶金手册[M]. 北京: 冶金工业出版社 , 2005: 79-80. |
| [15] | 月日辉. 电镀污泥硫酸浸出液铬铁分离研究[D]. 赣州: 江西理工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10407-1015502271.htm |
| [16] | 王成彦, 徐志峰, 袁文辉, 等. 一种从硫酸体系溶液中铬和铁的选择性分离方法[P]. 中国专利: 201310008199.8, 2014-06-15. |
| [17] | 王成彦, 徐志峰, 袁文辉, 等. 一种从盐酸体系溶液中的铬和铁选择性分离方法[P]. 中国专利: 201310008212.X, 2014-07-09. |
| [18] | 徐志峰, 赵洪兴, 王成彦, 等. 由混合电镀污泥硫酸浸出液选择性沉淀分离铬的研究[J]. 有色金属科学与工程, 2015, 6(5): 7–11. |
 2016, Vol. 7
2016, Vol. 7

