| LiF-SrF2-SrO熔盐体系中Sr2+的电化学行为 |
锶是一种性质极为活泼的碱土金属,可以增加材料的强度和抗腐蚀性能[1-2],因而享有“金属味精”之美誉[3-4]。锶也是表面活性元素,可作为A1、Mg等合金的优良变质剂和晶粒细化剂,在结晶学上能改变金属间化合物的行为,因此用它进行变质处理时可以改善金属的塑性加工性能和最终产品的质量[5-6]。Al-Sr合金是一种新型高效变质剂,同其他变质剂相比,变质时间长、无故变质行为、可反复重熔、无腐蚀作用等优点,主要用于铝硅系铸造合金、镁合金、锌合金等的变质及晶粒细化[7]。
熔盐电解法是目前正在研究的一种生产Al-Sr合金的方法[8]。它采用液态阴极法,即以液体铝为阴极,电解生成的金属锶在阴极铝液表面析出,并扩散到铝液内部,从而形成成分均匀、利于变质作用的铝锶合金。邹兴武、[9]李继东[10]、张明杰等[11]开展了以SrCl2或SrCO3为原料,在SrCl2-KCl-SrF2熔盐体系中制备Al-Sr合金的研究,做出了有意义的探索。但是关于熔盐电解法制备合金的电化学过程的基础研究的文献报道却相对较少[12-14],而研究锶从熔盐体系中析出的电化学过程,有利于明晰其在阴极析出的电化学反应机理及控制步骤, 对优化工艺条件、提高电流效率和降低生产能耗具有重要的理论和现实意义。本文采用循环伏安、计时电流和计时电位等三种电化学方法对LiF-SrF2-SrO熔盐体系中金属锶在钨电极上的还原过程进行研究,对其电化学行为进行分析和探究。
1 实验实验所用原材料LiF、SrF2和SrO等均为分析纯化学试剂,将其放入干燥箱,在温度373 K下烘干12 h备用。电解质体系按25.25 %LiF-74.75 %SrF2(wt%,以下同)进行配比,加入无水氧化锶作为电解原料,在研钵中研磨并混合均匀后再次放入干燥箱进行干燥。将烘干后的熔盐放入石墨坩埚,然后置于坩埚电阻炉内加热至1253 K,并在此温度下保温运行。
在电化学工作站(瑞士万通AUTOLAB PGSTAT302,工作电流放大器:BOOSTER 10 A)上,采用由一个工作电极(即熔盐中锶离子能在上面进行氧化或还原的电极)、一个对电极(辅助电极)和一个参比电极组成的三电极体系,分别用循环伏安、计时电流和计时电位等三种电化学方法开展电化学研究。工作电极为钨丝(Ф1 mm,99.95 %),采用SiC砂纸抛光后进行超声波清洗。对电极为钨棒(Ф10 mm,99.95 %),使用前采用1 mol/L NaOH溶液加热至50℃恒温2 h,以清除表面的WO3,再用去离子水清洗后干燥。参比电极采用铂丝(Ф1 mm,99.99 %)。铂丝和钨丝外均套上刚玉管套进行密封,只露出伸入熔盐的部分,以减少高温环境下的损伤。电极插入熔盐的深度由精密提升控制装置来控制[15],此深度值决定了电极的工作面积。
2 结果与讨论 2.1 循环伏安法为了更好地研究Sr2+在熔盐体系中的还原机理,首先对不含SrO原料的25.25 %LiF-74.75%SrF2电解质体系进行空白曲线扫描,从而获得该体系的循环伏安曲线,如图 1所示。
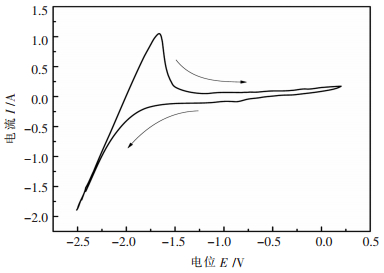 |
| 图 1 1253 K时25.25 %LiF-74.75%SrF2熔盐体系的循环伏安图 Fig. 1 Cyclic voltammogram of 25.25 %LiF-74.75 %SrF2 molten system at 1253 K |
由图 1可以发现,当阴极电位由0V增加至-1.5 V时,电流开始迅速增加,表明此时电解质氟化物开始分解并析出金属。在-1.5 V~0 V电位范围内没有出现氧化还原峰,说明在此电势范围内,LiF-SrF2熔盐体系电化学性能稳定,不存在氧化还原反应。另外,整个测试过程中并未发现分析纯化学试剂中微量杂质对实验结果产生明显影响。
在空白曲线扫描基础上,对掺入0.2 %SrO原料后的25.25 %LiF-74.75 %SrF2熔盐体系进行了研究。温度1253 K下,测试获得不同扫描速率v下Sr2+在钨电极上的循环伏安曲线,如图 2所示。
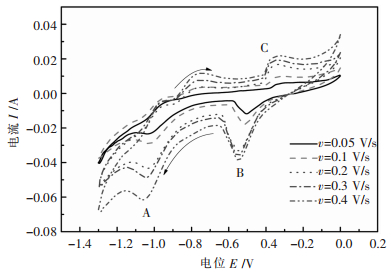 |
| 图 2 1253 K时不同扫描速率下25.25 %LiF-74.75 %SrF2-SrO熔盐体系的循环伏安图 Fig. 2 Cyclic voltammograms of 25.25 %LiF-74.75 %SrF2 -SrO molten salt systems at 1253 K under different scan rates |
由图 2可以看出,阴极扫描过程中绘制的循环伏安既出现了还原峰A、B及氧化峰C,其中,还原峰A为锶离子的还原峰,还原峰B可认为是离子的重新组合引起的电流变化,峰C为氧化峰,本文仅对锶离子在钨电极上的还原机理进行分析,对氧化峰C不作分析。而随着扫描速率的增加,还原峰A的峰电位不断向负方向偏移,且峰位电流Ip增大。由此判断该体系中Sr2+在铂电极上的阴极还原过程为准可逆反应。
下面结合Heyrovsky-Ilkovic方程对曲线中还原峰的转移电子数作进一步研究分析。Heyrovsky-Ilkovic方程[16]可用下式表示:
| $ E = B + \frac{{2.3RT}}{{nF}}\lg \frac{{{I_p} - I}}{I}, $ | (1) |
式中,B为半峰电位,V;T为实验温度,K;R为气体常数,8.314;n为转移电子数;F为法拉第常数,96500 C/mol;Ip为峰电流,A。
由上式可看出,E与
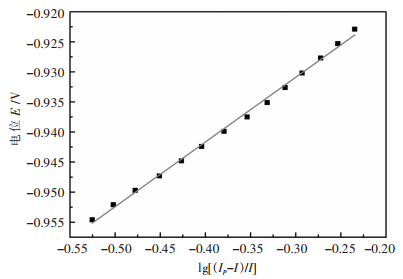 |
| 图 3 还原峰A中E-lg[(Ip-I)/I]关系图 Fig. 3 The relationship between E and lg[(Ip-I)/I] of reduction wave A |
由图 3中可以看出,电位E与lg[(Ip-I)/I]呈正比线性关系,由该直线斜率可以计算获得电子转移数n=2.2 ≈ 2,即锶在钨电极上的析出过程为一步得到两个电子的反应。
那该电化学过程的控制步骤是什么呢?若将图 2中不同扫描速率下获得的Sr2+在钨电极上的循环伏安曲线中的还原峰电流Ip与相应的扫描速率v的平方根作图,其结果如图 4所示。
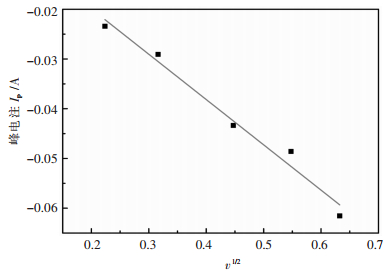 |
| 图 4 峰电流Ip随扫描速率平方根v1/2之间的关系 Fig. 4 The relationship between the peak current and the square root of scan rate |
下面结合图 4来作进一步的分析。由图 4可以看出,随着扫描速率平方根v1/2的增加,峰电流Ip随之增大,且二者呈线性关系。根据Randles-Sevick方程:
| $ {I_p} = 0.4463nFA{\left( {\frac{{RT}}{{nF}}} \right)^{1/2}}{D^{1/2}}{v^{1/2}}{C_0} $ | (2) |
式中,A为电极面积,cm2;D为扩散系数,cm2/s;v为点位扫描速率,V/s;C0为熔盐中反应物浓度,mol/cm3。其它参数意义同式(1)。
由Ip与v1/2之间的线性关系及Randles-Sevick方程可推断Sr2+在钨电极上的阴极电化学过程受扩散步骤控制[17-18]。
2.2 计时电流法计时电流法是指向电化学体系的工作电极施加单电位阶跃或双电位阶跃后,测量电流响应与时间的函数关系。本实验以LiF-SrF2为电解质,SrO为原料,在1253 K温度下,根据熔盐体系的循环伏安曲线(图 2),在Sr2+析出的电势范围内,在钨电极上进行计时电流曲线的测定,从而获得电流I与时间t的关系曲线,如图 5所示。
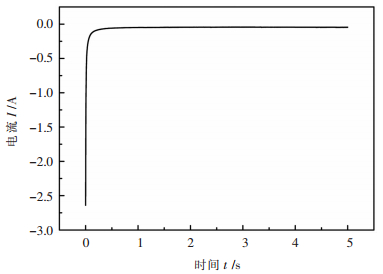 |
| 图 5 25.25% LiF-74.75 % SrF2熔盐体系中锶离子的计时电流图 Fig. 5 chronoamperogram of lithium ions in 25.25 % LiF-74.75% SrF2 eutectic melts at 1253 K |
由图 5可以看出,恒电位下,锶在钨电极上析出,开始时电流最高,随着锶的不断析出,电极附近锶离子浓度降低,熔盐中锶离子来不及扩散至电极表面,从而导致电流迅速衰减。一段时间后,锶离子向电极表面扩散并与析出速率逐渐平衡,因而电流相应地趋于平稳。通过计时电流曲线,同样可以表明Sr2+的电化学过程受到扩散步骤控制。
若将图 5中的数据以电流I与时间t-1/2作I~t-1/2图,则其结果如图 6所示。
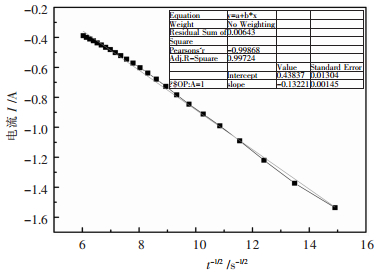 |
| 图 6 I与t-1/2的关系图 Fig. 6 The relationship between Iand t-1/2 |
由图 6可知,电流I与时间t-1/2基本符合线性关系,且I随t-1/2的增加而增大。根据Cottroll方程:
| $ I = \frac{{nFA{D^{1/2}}{C_0}}}{{{\pi ^{\frac{1}{2}}}{t^{\frac{1}{2}}}}} $ | (3) |
上式中各参数的意义同式(1)和式(2)。
由式(3)可知,若式中各参数恒定,则电流I与时间t-1/2成线性关系,其斜率表示为
为了进一步研究锶离子的阴极还原过程,在温度1253 K条件下,对LiF-SrF2-SrO熔盐体系中Sr2+在钨电极上的计时电位曲线进行了测量,结果如图 7所示。
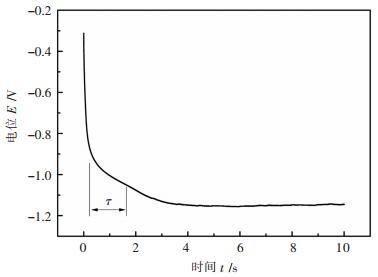 |
| 图 7 1253 K时LiF-SrF2-0.2% SrO熔盐体系中锶离子的计时电位图 Fig. 7 The chronopotentiometry of lithium ions in LiF-SrF2 eutectic melts containing 0.2 % SrO at 1253 K |
由图 7可以看出,在电位为-1.0 V附近出现一个电位增加减缓的平台,与循环伏安曲线(图 2)中还原峰A相对应,此为锶离子的析出峰平台,可读出锶离子析出的过渡时间τ。根据Sand方程[19]:
| $ {\tau ^{1/2}} = \frac{{{\pi ^{1/2}}{D^{1/2}}nF}}{{2i}}{C_0} $ | (4) |
式中,τ为沉积的过渡时间,是Sr2+从开始电解到它在电极表面的浓度降低至零的时间,s;i为阴极上施加的工作电流,其它参数意义同上。
通过图 7确认沉积的过渡时间为区间0.22 s-1.64 s,即1.42 s,阴极上施加的工作电流i为0.085 A,其它参数已知,从而结合sand方程计算出锶离子在熔盐中的扩散系数为D=3.71×10-5 cm2/s。与Cottrel方程计算得出的扩散系数相差不大,属同一数量级。
3 结论针对熔盐电解法制备铝-锶合金的体系,在电化学工作站AUTOLAB上,采用三电极体系以循环伏安法、计时电流法和计时电位法等电化学方法,对1253 K温度下锶在钨电极上的电化学还原过程及其控制步骤进行了研究和探索,其结果对优化工艺条件、提高电流效率和降低生产能耗具有一定的理论和现实意义。主要结论有:
(1)在LiF-SrF2-SrO熔盐体系中,锶离子在钨电极上的电化学还原为一步得两个电子的准可逆反应。
(2)循环伏安法和计时电位法的研究结果表明,锶在钨电极上的析出过程受扩散步骤控制,扩散系数为6.07×10-5 cm2/s,析出电位在-1.0 V附近。
| [1] | 陈英军.我国碳酸锶工业现状及发展方向[J]. 非金属矿,2002 (03):5–7. |
| [2] | 廖健南.Mg-Al-Si合金中Mg2Si相的变质机理研究[D].南昌大学, 2014. |
| [3] |
CAO G, ZHANG C, CAO H, et al. Hot-Tearing Susceptibility of Ternary Mg-Al-Sr Alloy Castings[J].
Metallurgical and Materials Transactions A, 2010,41 (3):706–716. DOI: 10.1007/s11661-009-0134-5. |
| [4] | 陆庆桃, 陆芝华, 张士新.碱土金属锶和钙在无氧铜熔炼中的行为[J]. 上海有色金属,1997 (02):49–52. |
| [5] | 李金丽, 张明杰, 郭清富.真空铝热还原法生产金属锶──SrCO3热分解[J]. 东北大学学报,2002 (08):776–778. |
| [6] | 刘相果, 彭晓东, 谢卫东.金属锶及其合金的研究现状与应用[J]. 稀有金属,2004 (04):750–755. |
| [7] | 李建国, 张柏清, 马洪涛.Al3Ti4B细化剂和Al10Sr变质剂对ZL107合金显微组织的影响[J]. 《中国有色金属学报》,2000 (03):365–369. |
| [8] | 杨少华.以氧化镁为原料熔盐电解法制备Al-Mg合金的研究[D].东北大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10145-2010254137.htm |
| [9] | 邹兴武, 王树轩, 杨占寿.SrCl2-KCl-SrF2体系中熔盐电解法制备铝锶合金[J]. 有色金属(冶炼部分),2012 (08):54–57. |
| [10] | 李继东, 张明杰.以SrCO3为原料熔盐电解生产Al-Sr合金[C].2004年有色金属冶金及材料第二届国际学术会议论文集.2004:566-570. |
| [11] | 张明杰, 李继东.熔盐电解法生产铝-锶合金[J]. 轻金属,1993 (04):25–28. |
| [12] | 贺圣, 李宗安, 颜世宏, 王志强.YF3-LiF熔盐体系中氧化物电解共沉积钇镁合金的阴极过程研究[J]. 中国稀土学报,2007 (01):120–123. |
| [13] | 刘刈, 王长水, 曹龙浩.氟化物熔盐中铀离子的电化学行为研究[J]. 化学通报,2013,76 (11):1049–1052. |
| [14] |
YANG SH, YANG FL, LIAO CF. Electrodeposition of magnesium-yttrium alloys by molten salt electrolysis[J].
Journal of Rare Earths, 2010 (01):385–388. |
| [15] |
LIU J N, SUN Z, JIN X W. The cathodic reduction of magnesium in KCl-NaCl-MgCl2 melts on a platinum electrode[J].
Nonferrous Metals: Extractive Metallurgy, 2007 (6):35–38. |
| [16] | BARDE A J, FAULKNER L R. Electrochemical Methods, Fundamentals and Applications[M]. Beijing: Chemical Industry Press , 2005 : 159 . |
| [17] | BAR D A J, FAULKNER L R. Electrochemical Fundamentals and Applications[M].2nd Edition. New York: John Wiley and Sons INC. , 2003 : 225 -227. |
| [18] |
LI M, SUN T T, LIU B, et al. Electrochemical behavior of Dy (Ⅲ) and the selective formation of Dy-Ni intermetallic compounds in LiCl-KCl eutectic melts[J].
Acta Physico-Chimica Sinica, 2015,31 (2):309–314. |
| [19] | MCDONALD D D. Transient Techniques in Electrochemistry[M]. New York: Plenum Press , 1977 : 365 -367. |
 2016, Vol. 7
2016, Vol. 7


