| 从镍电镀污泥回收的硫酸镍溶液的深度净化 |
电镀工艺在现代工业中扮演着非常重要的角色,它能对金属、非金属材料表面进行修饰、保护并使其获得新的性能,被广泛应用到工业生产中.但是电镀工序会产生含有大量复杂金属元素的废液需要处理.电镀污泥含有多种金属离子,需要经过无害化处理才能排放,否则会对环境造成严重污染.根据电镀污泥组分不同可采用稳定/固化法,火法处理,湿法处理这3种方法处理[1-3].对于含有大量的镍等有价金属的镍电镀污泥,用湿法处理的方式回收有价金属可以使其得以再利用并达到无害化的目的.
湿法处理先采用酸浸或氨浸的方法将金属离子带入水相,再通过化学沉淀或者溶剂萃取等方式提取回收需要的有价金属.由于溶剂萃取技术具备良好的选择性适用于组分复杂的溶液,所以相比沉淀法更适于提取镍电镀污泥浸出液中的有价金属[4].
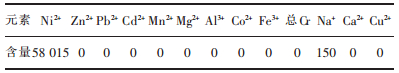
研究中的料液来自宁波双能固废处理厂,是经过HBL110萃取镍电镀污泥硫酸浸出液后反萃产出的粗硫酸镍溶液,料液pH值在1.25左右,阴离子为SO42-,溶液中主要的杂质元素为Fe、Zn、Cu、Cr.由于镍电镀污泥浸出液中杂质含量较高,经过HBL110直接萃镍技术处理的后产出的硫酸镍溶液依然含有一定量的杂质,所以无法直接用于硫酸镍的生产,需要对硫酸镍溶液进行深度净化[5-6].
早期对于硫酸镍的净化采用的是化学沉淀法,但是由于沉淀法会导致一定量镍的损失,并且对微量杂质分离效果不理想,所以化学沉淀法不适于处理复杂组分的硫酸镍溶液.据文献报道20世纪70年代就有人开始采用溶剂萃取的方法处理粗硫酸镍溶液.常用的萃取剂有P204、P507、M5640.上海冶炼厂的杨钟林等[7]提出采用镍皂化P204处理粗硫酸镍溶液,萃取除Cu2+, Fe3+, Zn2+,达到了良好的效果. 20世纪90年代初骆有钔等[8]提出采用镍皂P507净化镍阳极泥水浸溶液制取硫酸镍,证明此方法可达到良好的镍钴分离效果,产品质量达到国家标准.李学鹏等[9]提出采用M5640+P204+P507三步净化硫酸镍溶液生产镍电解液,先用M5640除铜,再用P204除铁等杂质,最后用P507深度净化除Co,得到的硫酸镍溶液可用于生产5N镍电解液.金川公司针对含铁高的硫酸镍料液,采用黄钠铁矾法除铁再用25 %的P507萃取除Cu2+, Co2+, Zn2+, Mn2+等杂质得到纯净的硫酸镍溶液[10].广东银亿的肖万林等[11]的专利中采用镍皂化P204萃取除杂,然后再用镍皂P507除Co2+,Mg2+得到硫酸镍溶液可直接返回电解工序.
由前人的研究成果可见,对于相似组成的粗硫酸镍溶液,通常采取两步净化的方式:先采用化学沉淀法或萃取法对铁等易分离杂质进行初步除杂分离,再根据料液组成采用选择性良好的P507深度净化除杂.实验料液无大量的铁杂质,所以实验中直接采用分离效果优异的P507用作硫酸镍料液的净化,其萃取和反萃原理为[12]:
| $ {{\text{M}}^{n + }} + n\overline {{\text{HR}}} = \overline {{\text{M}}{{\text{R}}_n}} + n{{\text{H}}^ + } $ |
P507的萃取通过阳离子交换实现,需通过皂化将部分H+离子替换成其他阳离子来稳定萃取过程中的溶液pH.由于硫酸镍的产品标准对Na+离子含量有严格的要求,不能采用常见的Na皂化方式处理有机相,借鉴前人研究成果,实验中决定采用Ni皂化的方式制备有机相.镍皂化后的P507萃取反应为[12]:
| $ {{\text{M}}^{n + }} + n\overline {{\text{N1}}{{\text{R}}_2}} = n{\text{N}}{{\text{i}}^{2 + }} + \overline {{\text{M}}{{\text{R}}_n}} $ |
根据料液组成,为了防止铁离子随pH的升高发生水解影响萃取效率,实验中采用先除铁,再深度净化除杂的方式制备高纯度硫酸镍.
1 实验 1.1 实验原料与试剂P507(江西省奉新申新化工有限公司,含量大于95 %),稀释剂为磺化煤油;NaOH(西陇化工股份有限公司),分析纯;六水合硫酸镍(西陇化工股份有限公司),分析纯;浓硫酸(衡阳市凯信化工试剂有限公司),分析纯;碱式碳酸镍(天津科密欧化学试剂有限公司),分析纯;粗硫酸镍溶液(宁波双能固废处理厂),成分如表 1所列.
| 表1 料液成分/(mg.L-1) Table 1 Composition of Feed liquid/(mg.L-1) |
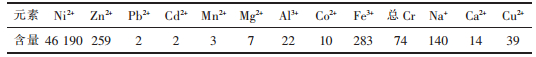 |
| 点击放大 |
1.2 实验工艺流程
实验工艺流程如图 1所示.
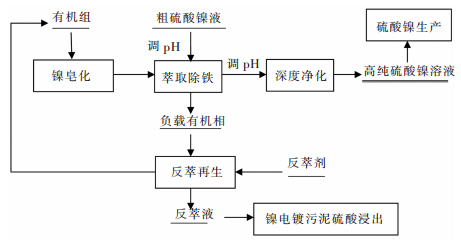 |
| 图 1 硫酸镍溶液深度净化流程图 Fig. 1 Flow sheet of Nickel Sulfate solution deep purification |
1.3 实验设备
125 mL梨型分液漏斗,SHZ-82恒温水浴冷冻振荡器(江苏金坛亿通电子有限公司),iCAP 7000型电感耦合等离子发射光谱仪, 722S紫外可见分光光度计(上海棱技术有限公司),S312电子恒速搅拌器(上海申生科技有限公司).
1.4 净化目标参考HG/T 2824-2009工业硫酸镍标准中的硫酸镍Ⅰ类一等品标准[13],按料液中Ni浓度确定溶液深度净化目标如表 2所列.
| 表2 溶液深度净化目标/(mg.L-1) Table 2 Goal of solution Deep Purification/(mg.L-1) |
 |
| 点击放大 |
1.5 实验方法 1.5.1 P507的配制与镍皂化
萃取剂按10 %的体积比,量取后与作为稀释剂的磺化煤油在烧杯中混合,充分搅拌后用于皂化.将配好的萃取剂与1 mol/L的硫酸镍溶液按VO/VA=1/1的相比在烧杯中混合,用搅拌器剧烈搅拌,为了中和皂化过程中产生的H+离子,根据80 %的镍皂化率条件下会产生的H+的量换算所需加入的NaOH溶液体积,在搅拌过程中缓慢滴加相应体积的NaOH溶液,继续搅拌直到沉淀消失.将皂化后的两相倒入大分液漏斗中静置,待两相澄清后放出水相.再按相比VO/VA=1/1向漏斗中加入纯水将有机相中夹带的钠离子洗脱,分相后获得镍皂P507.
1.5.2 萃取实验先量取所需体积的料液加入125 mL的分液漏斗中,按照所需体积相比量取相应体积的皂化好的有机相加入有水相的分液漏斗中,将分液漏斗置于恒温水浴振荡器,根据实验要求的条件控制振荡过程,震荡结束后取出分液漏斗静置等待分相.分析萃余液中目标元素浓度并计算萃取率E1:
| $ {E_1} = 1 - \frac{{{C_{a2}}{V_{a2}}}}{{{C_{a1}}{V_{a1}}}} \times 100\% $ | (1) |
式(1)中:Ca2是萃余液中金属浓度,g/L;Ca1是料液中金属浓度,g/L;Va2是萃余液体积,mL;Va1是料液体积,mL.
1.5.3 反萃实验先量取所需体积的反萃剂溶液加入125 mL的分液漏斗中,按所需相比量取相应体积的负载有机相加入已有水相的分液漏斗,将分液漏斗置于恒温水浴振荡器中根据实验要求的条件控制振荡过程,震荡结束后取出分液漏斗静置等待分相.分析反萃液中目标元素的浓度,计算反萃率E2:
| $ {E_2} = 1 - \frac{{{C_{o2}}{V_{o2}}}}{{{C_{o1}}{V_{o1}}}} \times 100\% $ | (2) |
式(2)中Co2是反萃后有机相负载的金属浓度,g/L;Co1是负载有机相中金属浓度,g/L;Vo2是反萃后负载有机相体积,mL;Vo1是加入的负载有机相体积,mL.
1.5.4 分析方法水相中金属离子浓度采用iCAP 7000型电感耦合等离子发射光谱仪检测,负载有机相中金属离子浓度主要根据相应水相中对应离子浓度用差减法得到.
负载有机相中金属离子浓度检测是先取一定量有机相滴于纸上置于烧杯中,在电炉上将其烧成灰烬,用一定量王水充分煮沸溶出,收集水相稀释定容,经过自然过滤后用检测水相中金属离子浓度的方式检测溶出的水相中的金属浓度,换算出有机相中的金属浓度.
2 结果与讨论 2.1 萃取除铁结果 2.1.1 平衡pH对萃取的影响实验中,pH是主要控制因素.为了不增加料液中的Na+,对于料液采用在快速搅拌的条件下加入碱式碳酸镍的方式调节pH;萃取条件:VO/VA=1/1、萃取时间5 min、萃取温度30 ℃.平衡pH对主要杂质Fe、Cu、Cr、Zn萃取的影响如图 2所示.
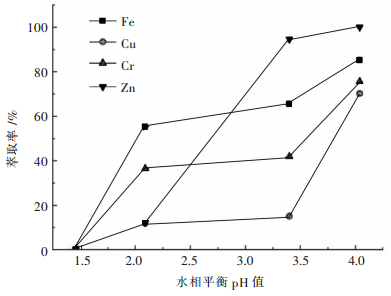 |
| 图 2 不同pH与主要杂质萃取率的关系 Fig. 2 The extraction rate of main metal impurities versus equilibrium pH |
由图 2可见,金属杂质的萃取率随pH提高而提高,Fe3+在pH高于2以后萃取率高于50 %,而其他金属萃取率较低.继续提高pH铁的萃取效果会继续提升,但pH继续提高到2.5以上时,铁会发生水解,此时铁的萃取率上升缓慢的同时铁的水解导致萃取效率下降,所以除铁实验采用的料液最佳pH值为2.2.
2.1.2 相比对萃取的影响料液不变,用碱式碳酸镍调节料液pH至2.2;萃取条件:萃取时间10 min,萃取温度30 ℃,改变萃取相比VO/VA分别为1/2、1/2.5、1/5、1/10、1/20、1/40.相比对主要杂质的萃取影响如图 3所示.
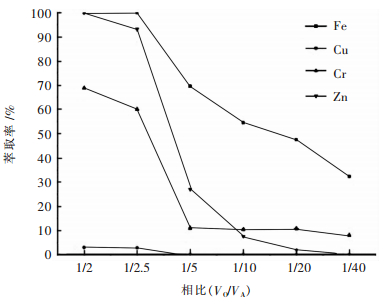 |
| 图 3 不同相比与铁萃取率的关系 Fig. 3 The extraction rate of main metal impurities versus volume phase ratio |
由图 3可见,随着VO/VA的降低,铁的萃取率逐渐下降,相比VO/VA高于1/10时萃取率高于50 %,当VO/VA=1/2.5时能保证较高的萃取率,从单级萃取的角度考虑应该选择VO/VA=1/2.5为最佳相比,但是在实际生产中,不仅要考虑单级萃取分离效果,同时应考虑尽可能提高萃取剂的利用率以及元素的富集,故最佳相比在1/2.5到1/10的区间内选择,然后结合串级实验来确定具体相比.
2.1.3 接触时间对萃取的影响料液:料液使用碱式碳酸镍将pH调到2.2;萃取条件:VO/VA=1/1、萃取温度30 ℃,考查的萃取时间分别为0.5、1、2、5、10 min,研究萃取时间对铁萃取率的影响,实验结果如图 4所示.
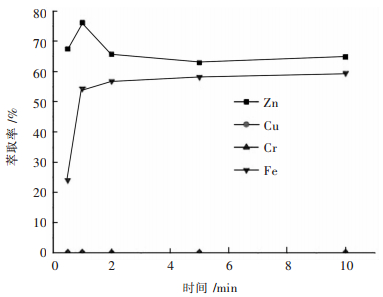 |
| 图 4 萃取时间与萃取率的关系 Fig. 4 Extraction rate versus extraction time |
由图 4可见,Fe3+的萃取率随时间升高而升高.从图 4中可见2 min之后萃取率波动趋于平缓,为方便操作取5 min为最佳反应时间.
2.1.4 萃取等温线由于Fe是本环节除杂的目标元素,所以以Fe为目标绘制操作线.
料液采用宁波双能提供的料液.按照最佳条件,料液使用碱式碳酸镍将pH调到2.2;萃取条件:VO/VA=1/1、萃取时间5 min,萃取温度30 ℃.采用多次接触法绘制萃取等温线,如图 5所示,图 5中6个点从左到右分别是第1到第6次的水相和有机相中的Fe3+离子浓度.
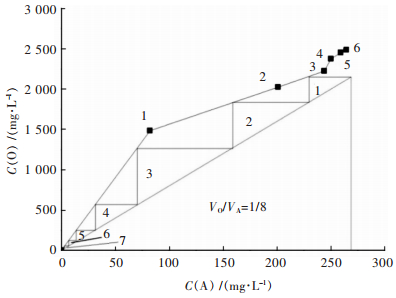 |
| 图 5 铁的萃取等温线 Fig. 5 Extraction isotherm of iron |
由图 5可知,有机相饱和萃铁量为2.2 g/L左右.从相比实验结果可使本料液在相比大于VO/VA=1/10时铁萃取率高于50 %,考虑有机相实际利用率,选择VO/VA=1/8,依照逆流萃取原理,绘制马克凯勒-齐利图,设萃余液中铁浓度为6.6 mg/L, 按照相比VO/VA=1/8绘制铁萃取的操作线,从图 5可以看出,通过6级逆流萃取铁的理论萃取率可接近100 %.不会在深度除杂的pH升高过程中发生水解.
2.1.5 串级模拟实验实验采用7个分液漏斗模拟6级逆流萃取实验.料液采用宁波双能提供的料液.按照最佳条件,料液使用碱式碳酸镍将pH调到2.2;萃取条件:VO/VA=1/8、萃取时间5 min,萃取温度30 ℃.共模拟13排.取后4排萃余液分析铁浓度,计算萃取率.结果如表 3所列.
| 表3 六级逆流萃取实验结果 Table 3 Results of six stage counter-current extraction experiment |
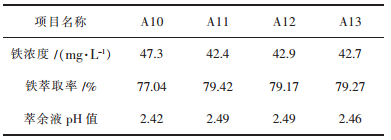 |
| 点击放大 |
由表 3可知,经过6级逆流萃取,萃余液铁浓度在40 mg/L左右,铁萃取率接近80 %,萃余液pH=2.4.铁的萃取率虽然未达到预期效果,但其浓度不会对后续深度除杂过程的pH调节构成影响,所以认为6级为串级萃取除铁阶段的最佳级数.
2.2 深度净化结果深度净化实验采用的是除铁实验后收集的料液,料液的pH=2.5,成分如表 4所列.
| 表4 料液成分/(mg.L-1) Table 4 Composition of feed liquid/(mg.L-1) |
 |
| 点击放大 |
2.2.1 平衡pH对萃取影响
料液使用碱式碳酸镍调节至不同pH.萃取条件:VO/VA=1/1、萃取时间5 min、萃取温度30 ℃.萃取结束后测量萃余液平衡pH值,分析萃余液中含量较高的Fe3+、Cu2+、总Cr、Zn2+的浓度,计算萃取率,结果如图 6所示.
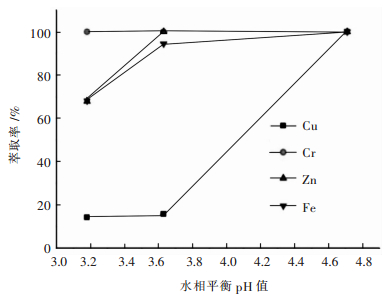 |
| 图 6 平衡pH与主要金属杂质萃取率的关系 Fig. 6 The extraction rate of main metal impurities versus equilibrium pH |
由图 6可见当pH高于3.6时Cr、Zn2+、Fe3+的萃取率都基本达到最佳,由于料液中Cu2+含量较低,采用多级逆流萃取的工艺即可达到净化目标,所以料液的最佳萃取pH确定为3.6.
2.2.2 萃取等温线由pH调节实验结果可见,主要杂质中Cu2+是最难除的杂质,故以Cu2+为目标做萃取等温线确定理论萃取级数.
料液采用除铁实验中收集的萃余液,由于pH=2.5的料液对碱式碳酸镍的利用率低下,故采用本实验使用的镍皂有机相,在VO/VA=1/10的条件下通过萃取的方式将料液pH调节到3.6左右;P507体积浓度10 %,皂化率80 %;萃取条件:VO/VA=1/8、萃取时间5 min,萃取温度30 ℃.采用多次接触法绘制萃取等温线,如图 7所示,图 7中3个点从左到右分别是第1到第3次的水相和有机相中的Cu2+离子浓度.
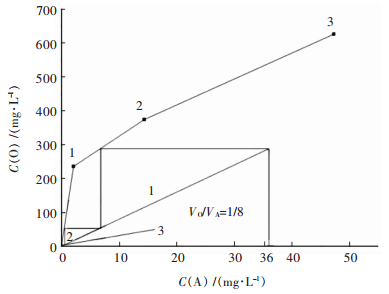 |
| 图 7 Cu2+的萃取等温线 Fig. 7 Extraction isotherm of copper |
由图 7可见,与除铁段相同选择VO/VA=1/8,依照逆流萃取原理,绘制马克凯勒-齐利图,设萃余液中铜浓度为36 mg/L,按照相比VO/VA=1/8绘制铜萃取的操作线,通过3级逆流萃取水相中铜萃取率接近100 %,萃余液中的铜含量达到除铜目标,由于料液中Zn2+含量高于Cu2+含量,为了保证萃取的效果,决定增加1级采用4级逆流萃取除杂.
2.2.3 串级模拟实验实验用5个分液漏斗模拟4级逆流萃取实验.料液采用除铁后的料液.按照最佳条件,现将料液在VO/VA=1/10的条件下用萃取剂将pH调到3.3;萃取条件:VO/VA=1/8、萃取时间5 min,萃取温度30 ℃.共模拟12排.稳定后取后6排萃余液分析铁浓度,计算萃取率.结果如表 5所列.
| 表5 四级逆流萃取实验结果 Table 5 Result of four stage counter-current extraction experiment |
 |
| 点击放大 |
由表 5可见,通过4级逆流萃取可以将有机相中的主要杂质基本除尽,深度净化后料液成分如表 6所列.
| 表6 深度净化后溶液成分/(mg.L-1) Table 6 composition of deep purified liquid/(mg.L-1) |
 |
| 点击放大 |
由表 6可见,由于深度净化时料液pH较高,镍离子部分被萃取,料液中Na+离子浓度无明显变化,其他金属杂质都被萃取完,硫酸镍溶液基本达到深度净化的要求.
2.3 反萃结果实验中反萃所用负载有机相来自所有萃取实验收集汇总的负载有机相.其主要成分如表 7所列.
| 表7 负载有机相主要元素组成/(mg.L-1) Table 7 main elements composition of loaded organic phase/(mg.L-1) |
 |
| 点击放大 |
2.3.1 反萃剂的选择
根据P507的萃取机理,增加H+浓度会使萃取平衡向左移动从而达到反萃的效果,为了保证体系中不含SO42-以外的阴离子,所以借鉴其他论文报道的相似硫酸体系的P507负载有机相的反萃方法,选用H2SO4溶液作为反萃剂[14].
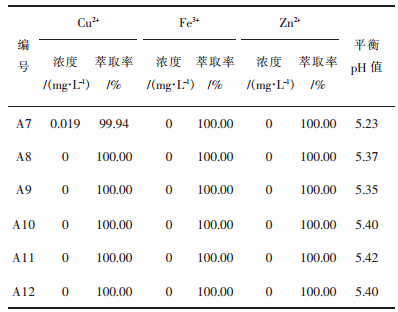
2.3.2 反萃剂H2SO4对反萃的影响有机相采用萃取实验收集的有机相;水相:H2SO4溶液;反萃条件:温度30 ℃,相比VO/VA=5/1,两相接触时间5 min.反萃结果如表 8所列.
| 表8 反萃剂酸度条件实验结果/% Table 8 Result of stripping agent acidity experiment/% |
 |
| 点击放大 |
由表 8可见,Ni2+、Cu2+、Zn2+这3种高含量的杂质都能被完全反萃,根据Fe3+的反萃率变化趋势最终选用4 mol/L的硫酸溶液作为反萃剂用于再生负载有机相.
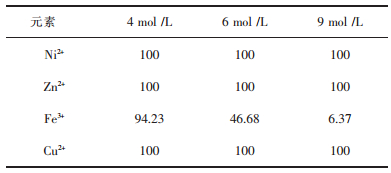
2.3.3 串级反萃实验根据酸度实验得出的结论,尝试采用4 mol/L硫酸进行4级逆流反萃的方式进行反萃实验,考察反萃效果.
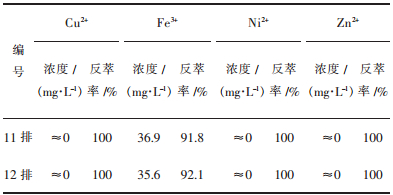
实验采用5个分液漏斗模拟4级逆流反萃实验.有机相采用萃取实验收集的有机相;水相:4 mol/L H2SO4溶液;实验条件:温度30 ℃,相比VO/VA=5/1,两相接触时间5 min.共模拟8排,取最后两排有机相分析金属浓度,结果如表 9所列.
| 表9 4级逆流反萃实验结果 Table 9 result of four-stage counter-current stripping experiment |
 |
| 点击放大 |
由表 9可见,经过4级反萃,负载有机相中的Cu2+、Ni2+、Zn2+已被反萃完全,Fe3+的含量降低至0.03 g/L,达到反萃目的.通过测量发现反萃液的pH<1,阴离子为SO42-,元素的构成与镍电镀污泥硫酸浸出液相似,所以可以考虑返回到电镀污泥酸浸工序回用.
3 结论1)H2SO4体系中,P507体积浓度10 %,皂化率80 %;萃取条件:VO/VA=1/8、萃取时间5 min,萃取温度30 ℃,料液pH=2.2的条件下,经过6级逆流萃取,Fe3+的萃取率可达到80 %.料液中所残留的铁离子不会在后续的深度净化工序中发生水解.
2)H2SO4体系中,P507体积浓度10 %,皂化率80 %;萃取条件:VO/VA=1/8、萃取时间5 min,萃取温度30 ℃,料液pH=3.3的条件下,经过4级逆流萃取,萃余液中所有杂质的含量都已满足深度净化要求.
3)用4 mol/L硫酸溶液,在温度30 ℃,相比VO/VA=5/1,两相接触时间5 min的条件下,经过4级逆流反萃可达到有机相反萃再生目的,反萃后的高酸度水相可以在电镀污泥酸性浸出工序回用.
| [1] | 张殿彬, 陈为亮, 王迎爽, 等.从电镀污泥中回收有价金属的研究进展[J]. 湿法冶金,2012 (5):281–283. |
| [2] | 李彩丽.含镍电镀污泥中镍的回收和综合应用[D].太原:太原理工大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10112-2010143094.htm |
| [3] | 季文佳, 黄启飞, 王琪, 等.电镀污泥资源化与处置方法的研究[J]. 电镀与环保,2010 (1):42–45. |
| [4] | 傅江, 程洁红, 周全法.电镀污泥的重金属湿法回收资源化技术及展望[J]. 资源再生,2009 (6):47–49. |
| [5] | 莫兴德, 肖连生, 张贵清, 等.HBL110从红土镍矿加压浸出液中萃取镍的研究[J]. 有色金属(冶炼部分),2014 (6):30–33. |
| [6] | 莫兴德.红土镍矿加压浸出-直接萃取镍的研究[D].长沙:中南大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10533-1014399065.htm |
| [7] | 杨钟林, 蒋祖惠.P204镍盐萃取法净化硫酸镍溶液[J]. 上海有色金属,1980 (3):5–10. |
| [8] | 骆有钔.P507萃取法生产硫酸镍[J]. 有色金属(冶炼部分),1994 (2):45–46. |
| [9] | 李学鹏.M5640+P204+P507萃取净化镍电解液[J]. 有色金属(冶炼部分),2011 (12):15–17. |
| [10] | 文力, 徐文兵.一种硫酸镍溶液去除杂质的方法:中国, CN101126127A[P]. 2008-02-20. |
| [11] | 肖万林, 王多冬, 和润秀, 等.红土镍矿湿法提镍工艺中保持钠、镁、水体系平衡的方法:中国, CN102181665A[P]. 2011-09-14. |
| [12] | 张启修, 张贵清, 唐瑞仁, 等. 萃取冶金原理与实践[M]. 长沙: 中南大学出版社 , 2014 . |
| [13] | HG/T2824-2009, 工业硫酸镍标准[S]. |
| [14] | 张魁芳, 曹佐英, 肖连生, 等.P507从硫酸体系中萃取镓的研究[J]. 矿冶工程,2014 (6):90–93. |
 2016, Vol. 7
2016, Vol. 7


