| 离子型稀土矿浸出过程主要物质浸出规律研究 |
2. 国家离子型稀土资源高效开发利用工程技术研究中心,江西 赣州 341000;
3. 南阳理工学院生物与化学工程学院,河南 南阳 473000
2. National Engineering Research Center for Ionic Rare Earth, Ganzhou 341000, China;
3. School of Biochemical and Chemical Engineering, Nanyang Institute of Technology, Nanyang 473000, China
离子型稀土矿于1969年在我国首次被发现并命名,含有15种稀土元素,特别是富含国防军工及其他高科技产业领域中不可或缺的铕、铽、镝、镱、镥、钇等中重稀土元素[1],具有配分齐全,中重稀土元素含量高、放射性低、高科技应用元素多、综合利用价值大“五大”突出优点[2].
离子型稀土矿物不是以独立的矿物相形式存在,而是呈离子状态吸附于黏土类矿物中[3-4]. 离子型稀土的开采工艺经历了20世纪80年代从氯化钠浸矿到硫酸铵浸矿工艺、90年代从池浸到原地浸矿工艺的两大飞跃,“硫酸铵浸取-碳铵沉淀工艺”已在离子型稀土矿的提取中得到广泛应用[5]. 原地浸矿工艺的显著优点在于工艺基本对地表植被不予破坏,保持原始生态. 也有研究采用硫酸镁[6-9]或其他浸取剂[10]代替硫酸铵作为浸矿剂,以改善铵根对环境的影响,丰富了原地浸矿工艺内容.
硫酸铵浸出离子型稀土矿浸出过程的化学反应可表示为:
| ${\left[ {{\rm{Clay}}} \right]_m} \cdot n{\rm{RE}}_{\left( {\rm{s}} \right)}^{3 + } + 3n{\rm{NH}}_{4\left( {{\rm{aq}}} \right)}^ + = {\left[ {{\rm{Clay}}} \right]_m} \cdot {\left( {{\rm{NH}}_4^{\rm{ + }}} \right)_{3n\left( {\rm{s}} \right)}} + n{\rm{RE}}_{\left( {{\rm{aq}}} \right)}^{3 + }$ |
其中:[Clay]表示黏土矿物,s表示固相,aq表示液相.
在离子型稀土的开采过程中,铵根离子将稀土离子交换下来而留在黏土矿物中,未交换的铵根离子残留在矿区土壤、地下水和地表水中. 工业上常用1 %~2 %的硫酸铵浸矿剂按体积比为0.33(浸矿液体积∶矿土体积)的比例注入矿体中[11]. 但在实际生产过程中,由于操作工人对硫酸铵浸矿工艺的理论不了解,对浸矿剂与矿体中各元素的浸出规律不明确,为提高稀土的浸出率,就盲目提高硫酸铵浸矿剂的浓度和用量,导致过量的浸矿剂和浸出液渗入矿体下部污染地下水系[12],浸矿液流失严重,流域溪流水中氨氮含量较高,浓度可达0.1 g/L. 据统计,生产1 t氧化稀土,需消耗8 t硫酸铵浸矿剂,产生1 000~1 200 t废水.同时,矿体灌入过量的浸矿剂,易引发滑坡、崩塌和泥石流等次生地质灾害,给矿区人民的生命财产安全带来严重威胁[13].
在浸矿过程中,过量的浸矿剂也会导致铁、铝等非稀土杂质随着稀土一起浸出,对后续沉淀及萃取工序产生影响,同时也影响产品质量. 欧阳克氙等[14]研究了在硫酸铵浸矿剂中添加硫化物、柠檬酸、酒石酸等抑制杂质铝的浸出. 邱廷省等[15]研究了硫酸铵中添加LG-01抑制杂质铝、铁的浸出,LG-01抑杂剂可与铝铁杂质离子形成络合物或难溶沉淀物从而有效抑制稀土矿中的铝铁杂质的浸出. 但抑制剂同时也会与稀土结合影响稀土的浸出效果. 在硫酸铵浸矿理论方面,科技工作者多研究了硫酸铵浸矿的动力学和热力学研究[16],而对浸出过程中水、稀土、硫酸铵、铝铁杂质等的浸出平衡关系报道较少. 何正艳等[17]研究了在不同浸矿剂浓度、pH值、浸取温度条件下稀土和铝及铵的浸出行为,但未对浸出过程中其他的主要物质如水、杂质铁、硅等进行研究.
本文从硫酸铵的浸矿理论出发,研究了硫酸铵浸矿过程中水、稀土、硫酸根、铵根及其他杂质离子的浸出平衡关系,对硫酸铵浸矿规律进行系统性研究,完善硫酸铵浸矿工艺技术基础理论,探索减少浸矿剂用量、控制杂质浸出的条件,进而对硫酸铵浸矿工艺进行优化,为实际应用提供理论依据,实现离子型稀土矿的高效、绿色开采.
1 实 验 1.1 实验药品及仪器实验所用的药品和仪器:硫酸铵 (工业级)、草酸(分析纯)、有机玻璃管Φ 145 mm×1 500 mm等.
离子型稀土原矿为广东平远县仁居稀土矿样品,样品含(吸附)水率W1=17.74 %,稀土品位(REO)ω=0.478 %.浸取液为2 %的硫酸铵溶液,其中含氨氮5.325 g/L,含硫酸根14.20 g/L.
1.2 实验方法在玻璃柱中(Φ 145 mm×1 500 mm)均匀装入10 kg稀土原矿,以一定的流速向玻璃柱中加注2 %的硫酸铵溶液,用饱和的草酸溶液定性检测浸出液中的稀土含量,以此判断是否浸出完全,发现浸出完全后,停止加注硫酸铵溶液,开始加注顶水. 记录出液时间,以250 mL为单位收集浸出液,按出液顺序依次编号,把收集到的浸出液样品送样检测稀土、铝、硅、铁、铵根、硫酸根离子浓度.
1.3 分析方法本实验所有样品均委托赣州艾科锐化工金属材料检测有限公司分析检测,其中稀土的检测按GB/T18882.1-2008(方法2)方法检测,铁、铝的检测按GB/T12 690.5-2003方法检测,镁的检测按国标GB/T12 690.11-2003方法检测,硅的检测按JB/T 4394-1999方法检测,硫酸根的检测按ACRC-28-2/0-2010方法检测. 部分稀土浓度的检测采用EDTA络合滴定法测定,采用pH试纸测定浸出液的pH值.
2 结果与讨论浸出10 kg的离子型稀土矿,共加入硫酸铵(浸矿剂)V1=12 353 mL,顶水V2=10 000 mL;收集的浸出液取样体积V3=9 660 mL,顶水液取样体积V4=10 065 mL;浸出取样时间t1=2 585 min;顶水液取样时间t2=2 596 min;实验共取样79个,19号样为稀土峰值时所取样,38号为加入顶水时的取样. 10 kg稀土矿浸出液中含各主要成分如表 1 所列.
| 表1 浸出液各主要元素含量 Table 1 酝ajor elements in the leaching solution |
 |
| 点击放大 |
2.1 浸出过程水的流出规律
柱浸实验水的平衡见表 2,计算得出每公斤稀土矿可吸收水V5= 2 400 mL,矿土吸水后的含水率为:
| 表2 浸矿过程水的平衡 Table 2 Water balance in the leaching process |
 |
| 点击放大 |
| ${W_2} = \frac{{{V_{5 \cdot \rho 水}} + {m_矿} \cdot {w_1}}}{{{V_{5 \cdot \rho 水}} + {m_矿}}}{\rm{ = }}33.70{\rm{\% }}$ |
其中:m矿为稀土矿质量,g.
计算得吸水后稀土矿土总含水率由之前的17.74 %增加到33.70 %,说明离子型稀土矿土对水有较大的吸附能力.只有在矿土吸水达到饱和时,才会开始流出浸出液,根据这一特点,可以计算出离子型稀土浸矿过程开始出液的所需时间:
T1= 采区矿体体积×矿土密度×(矿饱和吸水率-矿含水率)÷注液速度
根据图 1中稀土及各离子的流出曲线规律,浸出过程前1 781 mL的浸出液,只含少量的SiO32-,而RE3+、NH4+、SO42-、Al3+、Fe3+的浓度几乎为零,根据矿土原含水率为17.74 %计算得出10 kg矿土中含水1 774 mL,与浸出液的体积相近,说明是浸矿剂直接将矿土中的水顶出.
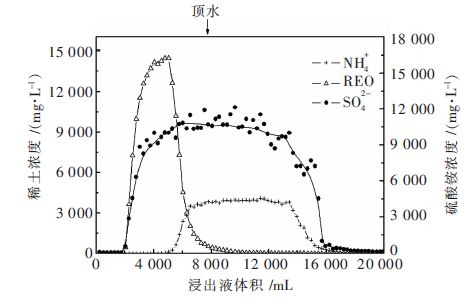 |
| 图 1 稀土及硫酸铵的流出曲线 Fig. 1 Elution profile of rare earth and ammonium sulfate |
2.2 浸出过程稀土与硫酸铵的流出规律
浸出液中稀土及硫酸铵的流出曲线如图 1所示.
2.2.1 稀土的浸出规律根据图 1可知,硫酸铵浸出稀土矿,流出液中稀土浓度呈正态分布,根据分布,可以将浸矿过程分为以下4阶段.
第1阶段: 前期液. 前期液是指浸矿过程中浸出液开始流出,但是浸出液基本不含稀土,或者稀土含量极低的阶段,对应图 1中0~1 781 mL区域;此阶段不流出稀土及硫酸铵,由此可计算出生产中不含稀土的浸出液的出液天数为:
T2 = 采区矿体体积×矿土密度×原矿含水率÷注液速度.
第2阶段:峰前液. 峰前液是指随着2 %硫酸铵的继续加入,流出液开始出现高浓度稀土浸出液,然后稀土浓度急剧增加,直至稀土浓度达到峰值的阶段,对应图 1中1 781~4 790 mL区域.峰前液中共含稀土量32.44 g,占总稀土浸出量的67.87 %,所以大部分的稀土在峰前液中.
第3阶段: 峰后液. 峰后液是指随着2 %硫酸铵的进一步加入,流出液的稀土浓度从峰值开始急剧降低,直至稀土浓度降低到一个极低的数值,对应图 1中4 790~10 000 mL区域.峰后液中含稀土量14.971 g,占总稀土量的31.33 %.
第4阶段:后期液. 后期液是指浸矿过程的尾期,其特点是稀土浓度很低,但是浸出液体积占的比例却很大,呈现一个很长的“拖尾”现象,对应图 1中10 000~20 000 mL区域.
由图 1累加计算出稀土的浸出总量为:
| ${m_{{\rm{RE总}}}} = \sum\limits_{i = 1}^{79} {{v_i}{c_i} = 47.79{\rm{g}}} $ |
由此计算出稀土的浸出率为:
| ${\eta _总} = \frac{{{m_{{\rm{RE总}}}}}}{{w \times {m_矿}}} \times 100\% = 99.98\% $ |
采用柱浸法浸出离子型稀土矿的稀土浸出率较高,接近于100 %.
2.2.2 硫酸铵的流出规律铵根离子在浸出过程中的平衡关系如表 3所列,计算可知离子型稀土矿交换吸附的铵根离子的质量为32.61 g,平均每公斤矿土交换吸附的铵根离子的质量为3.26 g,折算成每吨REO被交换吸附的硫酸铵为2.5 t. 浸取液中的稀土总量为47.79 g,将所有稀土交换下来所需铵量为16.41 g,稀土矿中杂质铝交换需要的铵量为6.54 g,则主要阳离子交换需要的铵总量为22.95 g,那么矿土吸附的铵量为32.61 g- 22.95 g=9.66 g,占总铵量的14.70 %,平均每公斤矿土吸附铵量为0.966 g.
| 表3 浸矿过程NH4+的平衡 Table 3 NH4+ balance in leaching process |
 |
| 点击放大 |
从图 1分析,浸出液中NH4+的流出曲线呈正态分布,在0~4 790 mL范围内,NH4+的浓度基本为零,说明这阶段加入的NH4+基本全部被稀土矿吸附或交换,这阶段加入的铵量为25.51 g,占总吸附及交换量的78.21 %. 稀土交换完毕后,NH4+浓度急剧升高,当NH4+浓度升高到3.5 g/L时,NH4+基本保持浸出平衡状态. 开始加顶水后,顶水逐渐将NH4+不断顶出,在浸出液体积为14 000 mL时,NH4+浓度迅速降低,但出现较长的拖尾现象,说明NH4+较容易残留于矿土中,会对矿山和地下水的生态环境产生一定的影响.
在0~1 781 mL时,浸矿前期液将矿土中的水顶出,在1 781 mL至3 041 mL时,浸出液中SO42-浓度快速上升,跟随稀土离子一同流出,在3 041 mL后,SO42-处于流出平衡状态,随着顶水的加入,与NH4+一同流出(过量的浸矿剂),也出现了较长的拖尾现象.
2.2.3 稀土浸出过程分区情况根据图 2稀土与硫酸铵的浸出关系可看出,流出的浸出液前1 781 mL,浸矿剂将矿土中的水顶出,此部分浸出液只含少量的SiO32-离子,加入硫酸铵浸矿剂后,含水率由17.74 %上升至33.7 %,因此可将Ⅰ区域称之为矿土水交换区.
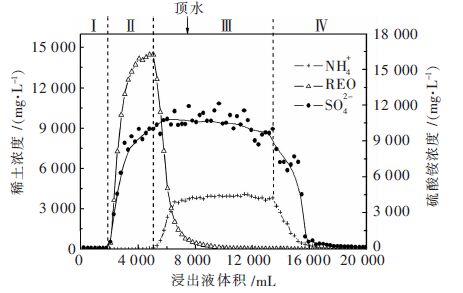 |
| 图 2 稀土浸出过程分区示意 Fig. 2 Zoning map of leaching process |
在Ⅱ区域中,NH4+与稀土离子发生交换反应,浸出液稀土离子浓度和SO42-浓度不断上升,NH4+浓度几乎为零;当稀土离子交换完毕后,即稀土浓度达到峰值后,矿土中可交换的稀土离子减少,NH4+开始流出,SO42-浓度保持流出平衡状态,浓度约为11 g/L. Ⅱ区域主要为NH4+与稀土、Al3+等离子的交换反应,因此此区域称为铵交换区.
随着硫酸铵浸矿剂的不断加入,NH4+浓度开始上升,然后处于流出平衡状态,浓度约为4 g/L.这时候所加入的硫酸铵未发生交换反应,硫酸铵浸矿剂过量,因此可将Ⅲ区域称之为铵过量区. 计算NH4+处于流出平衡状态时的流出体积为7 140 mL,铵过量了57.81 %.
在浸出液离子浓度降低至800 mg/L浓度时(收液累加体积为7 297 mL),加入顶水,待顶水加入体积为6 853 mL后,NH4+与SO42-浓度才逐渐降低,因此可将Ⅳ区域称之为顶水作用区.
对比NH4+及稀土离子的浸出曲线,当浸出液中NH4+的浓度开始上升时,即浸出液中稀土浓度开始下降时,浸取柱中残留的硫酸铵足以将剩余稀土浸出,此时可以停注硫酸铵溶液,改为注顶水,以减少硫酸铵的消耗和作业时间. 随着顶水的加入量越大,矿土中残余的硫酸铵浸矿剂越低,因此可通过加注顶水的方式对矿体进行淋洗修复,以减少铵根离子对矿区的影响.
2.3 浸出液pH值与主要物质的浸出规律离子型稀土矿不但含有稀土离子,而且还含有其他金属杂质离子,在浸矿过程中杂质离子会随着稀土离子一同被浸出,其浸出可用下式表示:
| $\begin{array}{l} {\left[ {{\rm{A}}{{\rm{l}}_2}{\rm{S}}{{\rm{i}}_2}{{\rm{O}}_5}{{\left( {{\rm{OH}}} \right)}_4}} \right]_m} \cdot {\rm{RE}}_{\left( {\rm{s}} \right)}^{3 + } + 3{\rm{NH}}_{4\left( {{\rm{aq}}} \right)}^ + \Leftrightarrow \\ {\left[ {{\rm{A}}{{\rm{l}}_2}{\rm{S}}{{\rm{i}}_2}{{\rm{O}}_5}{{\left( {{\rm{OH}}} \right)}_4}} \right]_m} \cdot 3{\rm{NH}}_{4\left( {\rm{s}} \right)}^ + + {\rm{RE}}_{\left( {{\rm{aq}}} \right)}^{3 + }\\ {\left[ {{\rm{A}}{{\rm{l}}_2}{\rm{S}}{{\rm{i}}_2}{{\rm{O}}_5}{{\left( {{\rm{OH}}} \right)}_4}} \right]_m} \cdot {\rm{M}}_{\left( {\rm{S}} \right)}^{n + } + n{\rm{RE}}_{4\left( {{\rm{aq}}} \right)}^ + \Leftrightarrow \\ {\left[ {{\rm{A}}{{\rm{l}}_2}{\rm{S}}{{\rm{i}}_2}{{\rm{O}}_5}{{\left( {{\rm{OH}}} \right)}_4}} \right]_m} \cdot 3{\rm{NH}}_{4\left( {\rm{s}} \right)}^ + + {\rm{M}}_{\left( {{\rm{aq}}} \right)}^{n + } \end{array}$ |
其中,M表示杂质离子,包括Fe3+、Al3+、Ca2+等离子;n表示杂质离子的电荷数;同时,硅酸根离子也可能与SO42-交换.
本实验过程中只测定Al3+、Fe3+、SiO32-杂质离子的浓度变化,同时测定了取样液的pH值,由此得出浸出液中各离子的浓度变化与浸出液pH值变化关系图,如图 3所示.
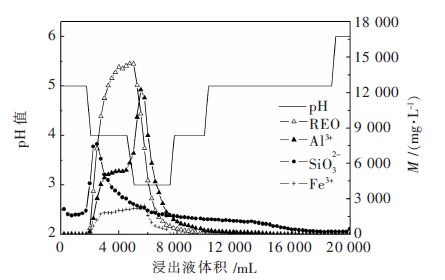 |
| 图 3 各离子浓度与浸出液pH 值变化关系(Al3+×10,SiO32-×102,Fe3+×104) Fig. 3 Relationship between ion concentration and pH value(Al3+×10,SiO32-×102,Fe3+×104) |
由图 3分析,浸出液的pH值与浸出液中的各离子浓度有密切关系,稀土、Al3+、Fe3+、SiO32-离子浓度均呈先上升后下降的趋势,而浸出液pH值是先下降后上升.无稀土和硫酸铵浸出的前1 781 mL浸出液的pH值与2 %的硫酸铵溶液的pH值一致,开始有稀土离子浸出时,浸出液的pH值下降为4,稀土浓度达峰值时,料液pH值达到最低点pH=3,这可能是矿土中含有的吸附态羟基铝与浸矿剂交换后,释放出H+,导致浸出液的pH值降低[18];也有可能是矿土中的稀土或铁离子被浸矿剂交换后,水解形成氢氧化稀土或氢氧化铁,产生H+,使pH值降低. 从图 3也可看出,pH值为3时浸出液中RE3+、Al3+和Fe3+的浓度均达到峰值. 随着浸矿剂和顶水的加入,浸出液的pH值开始上升,直至达到硫酸铵溶液的pH值和顶水的pH值.
无稀土浸出前液中也无Al3+、Fe3+浸出,此时pH=5;随着浸矿剂的加入,铝离子的浓度迅速上升至544 mg/L,随后出现了一个小平台,Fe3+也达到浸出平衡状态,吸附态羟基铝交换下的H+或氢氧化铁水解产生的H+导致浸出液pH值降低,而pH值的降低又促进RE3+、Al3+、Fe3+的浸出.浸出液中RE3+、Al3+、Fe3+浓度降低后,浸出过程逐渐完毕,此时浸出液pH值也逐渐回升. 对比Al3+、Fe3+的浸出曲线,整个浸矿过程中,浸出液中Al3+的浓度(按Al2O3计)可以高达1.23 g/L,很容易被浸出,而Fe3+的浓度最高只有0.24 mg/L,几乎不浸出.
浸出液前期不浸出稀土、Al3+、Fe3+时,SiO32-会随着矿体中水的流出而流出,可能是矿土表面或矿土中的部分游离SiO32-被水带出,因此SiO32-的浸出优先于其他离子. 当pH=4时,SiO32-迅速上升,形成峰值;随着pH值的降低,SiO32-易与H+形成硅酸,抑制了SiO32-的浸出,浸出液中SiO32-浓度逐渐降低,而后出现较长的拖尾现象.
2.4 浸出过程稀土与杂质离子的浸出关系根据图 3稀土、Al3+、Fe3+、SiO32-浓度的浸出曲线可知,随着浸出时间的增加,溶液中的稀土、Al3+、Fe3+、SiO32-的浓度变化都呈先增加后减少的趋势,各离子的浸出顺序为:SiO32-、RE3+、Al3+、Fe3+,浸出达到峰值的先后顺序为:SiO32-、RE3+、Al3+、Fe3+,SiO32-最高浓度为76.23 mg/L,稀土离子最高浓度为14.48 g/L,Al3+最高浓度为1.2 g/L,Fe3+最高浓度为0.24 mg/L.
铝在离子型稀土矿中呈现多种不同的赋存状态,如水溶态铝、交换态铝、吸附态羟基铝、非晶态铝硅酸盐状态、矿物态铝、全相铝等,矿物中含有的离子相态铝可随离子相稀土浸出共同被浸出,因此在浸出液中Al3+的浓度较高. 对比稀土与铝的浸出曲线,当稀土浓度达到峰值时,Al3+浓度刚好出现了一个小平台,此时继续加浸矿剂,浸出液中稀土浓度开始急剧下降,Al3+浓度反而急剧上升,Al3+的浸出略滞后于稀土的浸出,如果此时不加硫酸铵浸矿剂,矿土中残余的硫酸铵可将剩余的稀土浸出,只要加顶水将这部分稀土从矿土中顶出即可. 因此,在稀土出高峰液后,停止加入硫酸铵,改加顶水,这可能实现在浸出过程中减少杂质铝的浸出,减少后续除杂成本.
3 结 论1)离子型稀土矿土对水有较强的吸附能力,浸矿后,矿土的含水率由17.74 %增加到33.7 %,根据矿体体积、矿土密度和注液流速可计算出浸矿过程的出液时间T1=采区矿体体积×矿土密度×(矿饱和吸水率-矿含水率)÷注液速度.
2)整个浸矿过程可分为矿土水交换区、铵交换区、铵过量区及顶水作用区,各浸出离子浓度呈现先上升后下降的趋势,浸出液稀土、Al3+、Fe3+、SiO32-峰值浓度分别为14.48 g/L、1.2 g/L、0.24 mg/L、76.23 mg/L,稀土的浸出率为99.98 %,杂质中Al3+浸出量比较大,SiO32-浸出量较小,而Fe3+几乎不浸出,各离子的浸出顺序为:SiO32-、RE3+、Al3+、Fe3+,稀土先达到峰值,Al3+后达到峰值,这为抑制杂质铝的浸出提供可能.
3)浸出过程中Al3+、Fe3+浓度达到峰值时,pH值最低,随着浸矿剂和顶水的加入,浸出液的pH值开始上升,直至达到硫酸铵溶液的pH值和顶水的pH值.
| [1] | 池汝安, 田君.风化壳淋积型稀土矿评述[J]. 中国稀土学报,2007,25 (6):641–650. |
| [2] |
CHI R A, LI Z J, PENG C, et al. Partitioning properties of rare earth ores in China[J].
Rare Metals, 2005,24 (3):205–209. |
| [3] | 张恋, 吴开兴, 陈陵康, 等.赣南离子吸附型稀土矿床成矿特征概述[J]. 中国稀土学报,2015,33 (1):10–17. |
| [4] | 李永绣. 离子吸附型稀土资源与绿色提取[M]. 北京: 化学工业出版社 , 2014 . |
| [5] | 罗仙平, 钱有军, 梁长利.从离子型稀土矿浸取液中提取稀土的技术现状与展望[J]. 有色金属科学与工程,2012,3 (5):50–59. |
| [6] | 杨幼明, 黄振华, 邓声华, 等.P507-N235 体系复合有机相的再生与循环[J]. 稀有金属,2014,38 (2):300–305. |
| [7] | 黄金. 离子型稀土矿抑杂浸出工艺及机理研究[D]. 赣州:江西理工大学,2015. |
| [8] | 王瑞祥,杨幼明,杨斌,等. 一种离子吸附型稀土提取方法[P]. 中国专利: CN103266224A, 2013-08-28. |
| [9] | 王瑞祥,谢博毅,杨幼明,等. 一种从离子型稀土矿硫酸镁浸出液中沉淀稀土的方法[P]. 中国专利: 201410338630, 2014-07-16. |
| [10] | 黄万抚, 张宏廷, 王金敏, 等.半风化离子吸附型稀土的浸取实验[J]. 有色金属科学与工程,2015,6 (6):121–124. |
| [11] | 袁长林.中国南岭淋积型稀土溶浸采矿正压系统的地质分类与开采技术[J]. 稀土,2010,31 (2):75–79. |
| [12] | 陈斌, 祝怡斌, 翟文龙.某离子型稀土矿采矿活动对地下水的影响分析[J]. 有色金属(矿山部分),2015,67 (2):63–66. |
| [13] | 罗嗣海, 袁磊, 王观石, 等.浸矿对离子型稀土矿强度影响的试验研究[J]. 有色金属科学与工程,2013,4 (3):58–61. |
| [14] | 殴阳克氙, 饶国华, 姚慧琴, 等.南方稀土矿抑铝浸出研究[J]. 稀有金属与硬质合金,2003,31 (4):1–3. |
| [15] |
QIU T S, FANG X H, WU H Q, et al. Leaching behaviors of iron and aluminum elements of ion-absorbed-rare-earth ore with a new impurity depressant[J].
Transactions of Nonferrous Metals Society of China, 2014,3 (3):2986–2990. |
| [16] | 贺伦燕, 王似男.离子吸附型稀土矿淋洗交换稀土动力学问题的研究[J]. 稀有金属与硬质合金,1989,99 :2–8. |
| [17] | |
| [18] | 田君. 风化壳淋积型稀土矿浸取动力学与传质研究[D]. 长沙:中南大学, 2010. |
 2016, Vol. 7
2016, Vol. 7


