| 咪唑基四唑FeII、CoII配合物的[2+3]原位合成、结构及性质研究 |
含氮唑类的配合物是一类结构独特的高含能化合物,具有优越的光电性能,在众多领域存在着巨大的应用潜力. 自1885年瑞典化学家Bladin首次合成四唑类化合物以来[1],四唑化合物的研究吸引了化学家和材料学家的强烈兴趣,尤其是关于单氮唑类(如噻唑)、双氮唑类(如咪唑)、三氮唑(如三唑)等配体和含氮唑类配合物的合成及应用得到非常广泛的研究,到目前为止,高含氮唑材料已经广泛应用于医药、农业、国防等众多领域[2-4].
四氮唑类配体的氮对过渡金属离子、主族金属离子和稀土元素离子具有较强的配位能力,但合成条件比苛刻,不利于四氮唑类配合物的研究和应用. 随着诺贝尔奖获得者Sharpless和他的合作者首次以水做为溶剂合成了5-取代四唑[4],使得四唑化合物可以在安全环保条件下进行,促进了四唑化合物的新一轮发展. 到目前为止,该反应的反应机理还不是很明确,其中被大部人认同的理论是[2+3]五环加成反应理论. 从2001年Sharpless发表文章中可知Lewis酸起催化作用及选用不同的Lewis酸及其用量可以直接影响到四唑的合成速率[4].
国内在氮杂环类有机金属框架结构材料合成及相关性质的研究中,也有部分报道[5-11]. 例如东南大学熊仁根课题组在组装四唑类配合物方面做了大量的工作,系统地研究了单四唑配合物、双四唑配合物、四唑配聚物、异核四唑配聚物以及非心或手性四唑类化合物的合成和结构,并发现四唑化合物在分子铁介电、荧光、非线性光学材料等方面具有潜在的应用[12-13].
基于前人的研究经验和反应机理,又考虑到咪唑是生命体中的一种蛋白质-组氨酸的残基,常被用来组装金属化合物,能够与受体间形成强的氢键体系[14-16]. 利用这种含有咪唑基有机配体(MID)在FeSO47H2O和CoSO47H2O作为路易斯酸催化剂条件下进行水热反应,成功得到了3个结构新颖的四唑类化合物,并对其结构进行了一系列的表征和分析. 此外,通过对其合成条件的探索发现,反应液的酸碱度(pH值)对该反应影响较大.
1 实验部分 1.1 试剂与仪器MID,NaN3,FeSO47H2O和CoSO47H2O均为市售分析纯,无需提纯. 所有药品均由FA1004型电子天平称量,反应是在DHG-9140A 型电热恒温鼓风干燥箱中进行,通过Elementear Vario EL元素分析仪对1、2和3进行了元素分析(C、H、N),利用Netzsch TG F3 Tarsus热重分析仪对其进行了热分析(氮气氛围),IR图谱是用KBr压片法在ALPHA (Bruker)光谱仪上测试,单晶结构测试是在D8 QUEST (Bruker)X-射线单晶衍射仪上收集衍射数据(Mo-Kα,λ = 0.071 073 nm).
1.2 配合物1﹑2和化合物3的合成四唑配体的形成机理:Sharpless 及其合作者以安全方便又环保的方法成功合成了5-取代四唑,随后提出了在Lewis的催化下,氰基化合物与叠氮化物发生[2+3]环加成反应的机理[17-18],如图 1所示. 首先氰基发生质子化,然后与叠氮根进行亲核加成反应,最后生成结构稳定的四唑环. 按照这种思路,利用咪唑基有机配体在作为路易斯酸催化剂条件下进行水热反应,同样成功得到了四唑类化合物.
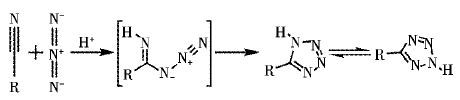 |
| 图 1 Sharpless [2+3]环加成反应的机理图 Fig. 1 The mechanism of Sharpless [2+3] cycloaddition |
配合物的合成:路线如图 2所示,将MID (0.1 mmol,0.013 2 g),FeSO47H2O (0.1 mmol,0.024 2 g)或CoSO47H2O (0.1 mmol,0.028 1 g),NaN3 (0.6 mmol,0.039 0 g),H2SO4 (1 mol/L,调节溶液pH值 ≈ 6) 0.10 mL和溶剂(水:乙醇 = 3:1) 3 mL,加入硬质Pyrex管中,液氮冷却后,抽真空密封,待放入140 ℃的恒温干燥箱中加热72 h,后再以每小时5 ℃的速度冷却,降至室温后,有浅绿色块状配合物1和黄色块状配合物2晶体析出. 其中在不添加金属盐,其它实验条件相同的情况下,可得到无色块状化合物3. 配合物1,C12H12O2N14Fe (440.21) ,产率: 46.5 %. 元素分析:理论值,C,32.74; H,2.75; N,44.55; 实验值,C,32.76; H,2.78; N,44.58. IR (KBr,cm-1): 3462(s),3103(w),2241(m),1630(w),1516(m),1390(w),1370(w),1274(m),1169(m),992(m),887(w),739(m),701(m),641(w),489(w). 对于配合物2: C12H12O2N14Co (443.29) ,产率: 38.6%. 元素分析: 理论值,C,32.51; H,2.73; N,44.24; 实验值,C,32.50; H,2.71; N,44.26. IR (KBr,cm-1): 3478(s),3102(w),2246(m),1631(w),1516(m),1394(w),1370(w),1275(m),1170(m),993(m),890(w),738(m),701(m),641(w),489(w). 对于化合物3 C6H6ON7 (192.18) ,产率:25.6%. 元素分析:理论值,C,37.50; H,3.15; N,51.02;实验值,C,37.48; H,3.17; N,51.00. IR (KBr,cm-1): 3436(s),3109(m),2360(w),2239(m),1635(m),1522(m),1382(m),1280(m),1170(m),990(m),638 (w),489(w).
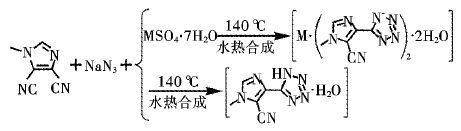 |
| 图 2 配合物1~2和化合物3的合成路线 Fig. 2 Preparation of complexes 1~2 and compound 3 |
1.3 单晶结构的测定
采用D8 QUEST (Bruker)X-射线单晶衍射仪分别测试了1~3的单晶,用石墨单色器单色化的Mo-Kα射线(波长 λ = 0.071 073 nm),以 θ~2θ 的方式扫描收集衍射数据. 所有强度衍射数据经Lp因子矫正和经验吸收矫正. 由直接法和Fourier合成解析其晶体结构 ,非氢原子坐标和各向异性温度因子经全矩阵最小二乘法修正[19],氢键表由命令产生,cif文件通过Check Cif检测产生报告,所有计算由SHELXS-97晶体结构分析程序包完成[20],测定的1~3的晶体数据和精修结构详细参数见表 1,部分键长键角见表 2. 氢键数据见表 3.
| 表1 配合物1和2及化合物3的晶体数据和精修结构 Table 1 Crystal date and structure refinement for 1~3 |
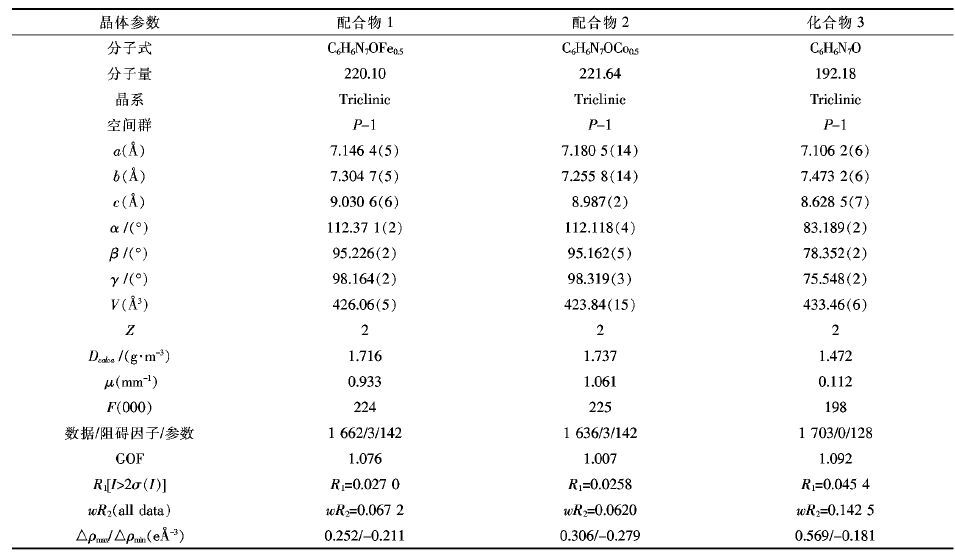 |
| 点击放大 |
| 表2 配合物1和2的键长[]和键角[°] Table 2 The bond longs [] and angles [°] of compounds 1 and 2 |
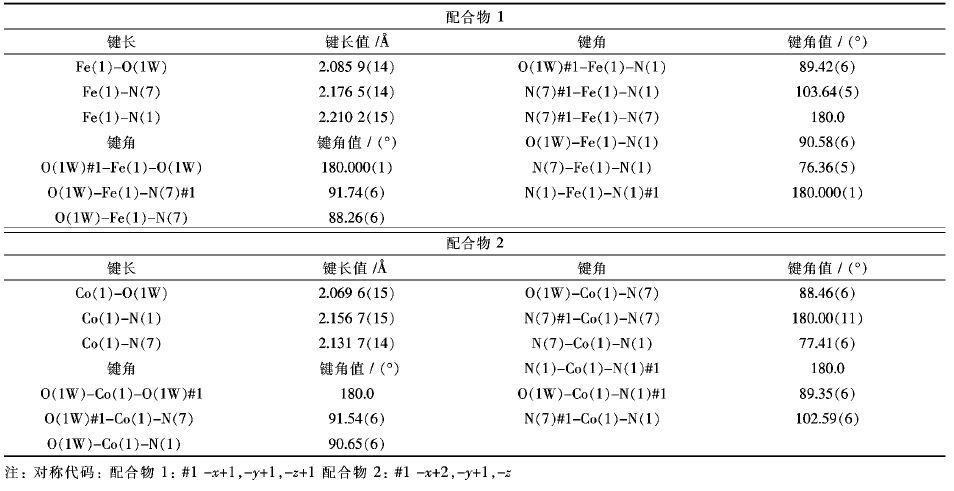 |
| 点击放大 |
2 结果与讨论 2.1 化合物1-3的红外图谱分析
化合物1~3及反应物MID的红外光谱测量范围为400~4000 cm-1. 如图 3所示,3 462 cm-1左右是咪唑基中仲胺=N-H伸缩振动; 3 277 cm-1附近的吸收峰是结晶水中O-H的伸缩振动,弯曲振动在1 630 cm-1附近; 3 102 cm-1是=C-H的伸缩振动吸收峰; 2 241 cm-1附近的吸收峰是咪唑基上R-CN的伸缩振动; 与原料MID相比,化合物1~3在1 394~1 516 cm-1处出现的一系列新的原子振动吸收峰. 根据相关文献报道,证明产物中存在新生成的四唑环[21-22],其中1 273 cm-1,1 172 cm-1,9 93 cm-1,7 38 cm-1,504 cm-1为四唑环骨架振动吸收峰,说明其中一个氰基和叠氮化物发生了Sharpless [2+3]环加成反应.
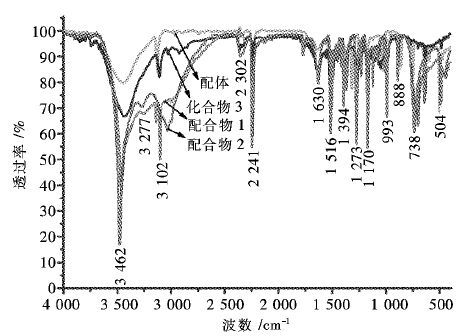 |
| 图 3 MID、配合物1和2及化合物3的红外图谱 Fig. 3 the IR spectra of MID,complexes 1~2 and compound 3 |
2.2 X-射线单晶结构分析
化合物1~3均为经典的Werner 型结构,属于三斜晶系,结晶于P-1空间群,如图 4所示,1和2具有相同的配位环境,下面以1为例来分析单晶结构. 中心金属FeII离子分别与2个配体上的咪唑基和四唑环上的氮原子双齿螯合,同时在轴向上与2个水分子配位,形成一个八面体结构. 其中夹角N(1) -Fe-N(7) 为76.36(5) °. Fe-N的距离2.1765(14) ~2.2102(15) 明显大于Fe-O键长(2.0859(14) ),键角N(7) -Fe-N(1) 和N7-Fe-N1A分别为76.36(5) °和103.64(5) °,同时键角O-Fe-O和N-Fe-N(A)均为180.000(1) °,可以看出O1、Fe和O1A共直线(L),N(1) 、N(7) 、N(1A)、N(7A)和FeII共平面(S),从键角O-Fe-N介于88.26(6) °~91.74(6) °得知该直线L近似垂直该平面S,以金属离子为中心形成一个微形变(压扁)的八面体结构.
(a) 配合物1和2的不对称单元(M = Fe,Co) (b) 化合物3的不对称单元
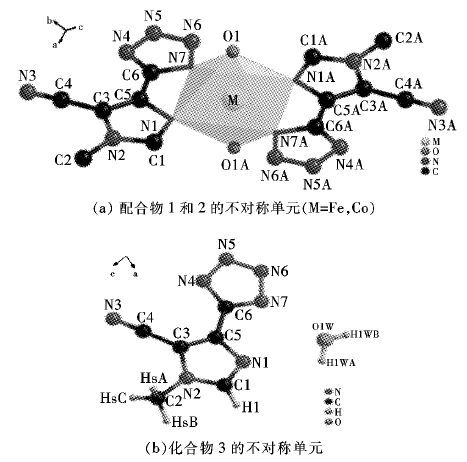 |
| 图 4 配合物1和2及化合物的不对称单元 Fig. 4 the asymmetric units of complexes 1~2 and compound 3 |
如图 5所示,为更清晰的说明 π-π 堆积作用,在图 5(b)中隐去了水分子,配合物 1和2中两层配合物的咪唑基和四唑基平面距离为3.710 ,即分子间存在着较强的 π-π 堆积作用. 而化合物3中只有咪唑基环之间(距离为3.848 )存在着较弱的作用,1~3中相邻两层分子所在平面的夹角分别为4.837(65) °和0.014(67) °. 两层面的错位角分别为θ=17.369(25) °和θ′=15.813(27) °,根据Hunter-Sanders规则,在中性体系中,错位堆积(offset)是有利构型,错位角越大吸引作用越强[23-25],即θ角越大π-π 作用越强,平面距离较小和错位角较大双重因素,使得配合物1、2较化合物3存在着较强的分子间 π-π 堆积作用.
(a) 配合物1,2的π-π作用 (b) 化合物3的π-π 作用
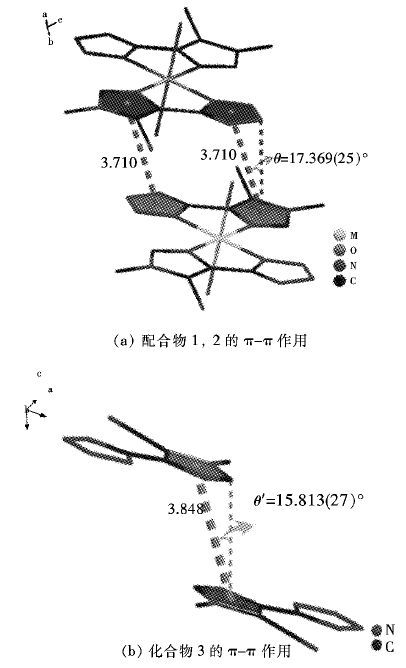 |
| 图 5 配合物1和2及化合物3的π-π作用 Fig. 5 π-π stacking of complexes 1~2 and compound 3 |
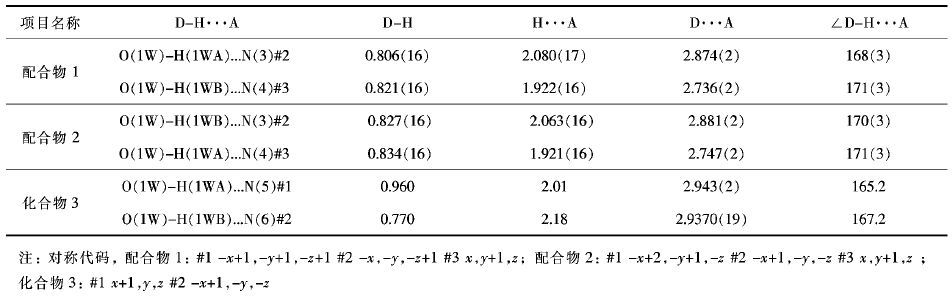
化合物1-3中存在丰富的氢键作用. 在配合物1和2中,配位水分子分别与四唑环的α位氰基上N原子形成强烈的氢键作用(距离分别为1.925 和2.081 ). 由于氢键的连接,在层与层之间形成了18员环使得配合物在整个空间里拓展成为三维的网状结构 (图 6) . 同时,层与层间之间的 π-π 堆积作用增强了该三维结构的稳定性(图 7) . 而在化合物3中,水分子与四唑环上β位N原子形成氢键,通过水桥的作用在分子中形成了有趣的10员环,可能正是这种氢键的形成使得化合物3具有较稳定的中心对称结构 (如图 8) .
(a) 配合物1和2的氢键堆积图(红虚线代表氢键作用) (b) 氢键简化图(M+L代表金属和配体)
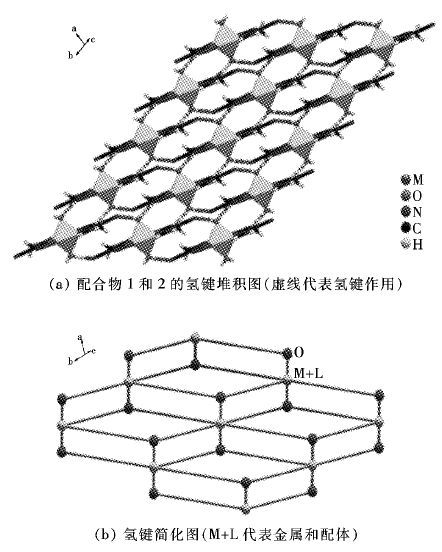 |
| 图 6 配合物1和2的氢键堆积及其简化图 Fig. 6 stacking structure and simplified graph connected by hydrogen bonds of 1 and 2 |
(a) 配合物1和2的π-π堆积和氢键图(黄虚线代表π-π作用) (b) 对应简化图( TZL:四唑环; MIC:咪唑基团)
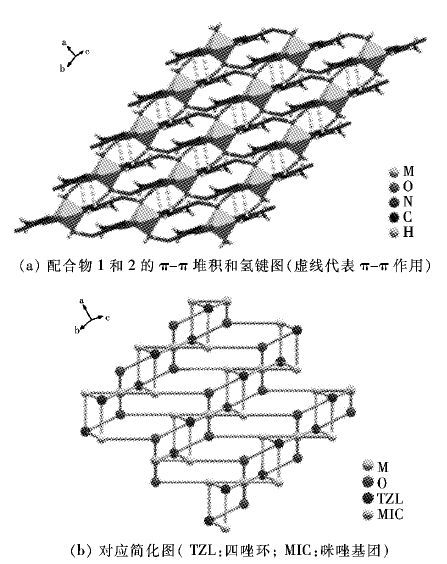 |
| 图 7 配合物 1和2的 π-π 堆积和氢键作用3D及其简化图 Fig. 7 3D supermolecular structure and simplified graph of 1 and 2 through hydrogen bonding and π-π stacking interactions |
(a) 化合物3中由氢键形成的10员环 (b) 配合物1和2中由氢键形成的18员环
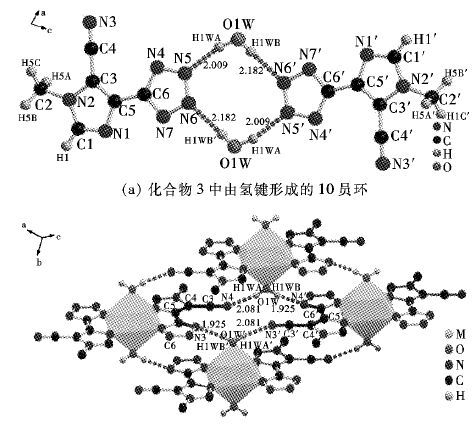 |
| 图 8 化合物3由氢键形成的多员环 Fig. 8 many-member ring of 3 |
| 表3 分子间氢键的长度()和角度(°) (D,给体; A,受体) Table 3 Selected bond lengths () and angles (°) (D,donor; A,receptor) |
 |
| 点击放大 |
2.3 配合物的粉末衍射分析
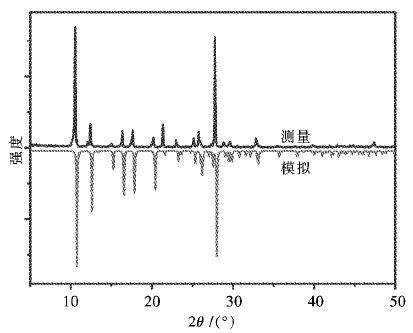
分别对1和2单晶模拟与粉末衍射XRD测试结果进行了对比,分析结果表明1和2为纯净相. 在此以2为例进行分析,如图 9所示,可以看出特征峰位基本上一致,只是在强弱上略有差异,可以判断2的单晶模拟图与粉末衍射XRD测试图基本吻合,而且没有检测到固体原料的残留,证明配合物2为纯相,几乎不含任何杂质.
 |
| 图 9 配合物 2的PXRD图谱 Fig. 9 the PXRD pattern of 2 |
2.4 差热分析
在N2 (100 mL/min)的保护下以10 K/min 的升温速率对1和2的热稳定性进行测试. 分析结果表明1和2具有基本相同的失重现象,如图 10所示. 在此以1为例进行分析: 在480~550 K内有一个明显的失重平台,失重约8.0 %,对应于失去2个配位水分子(理论失重8.2 %),随着温度升高,配合物持续失重,直至骨架彻底坍塌. 通过分析热重曲线(TGA)可知,1和2具有较好的热力学稳定性.
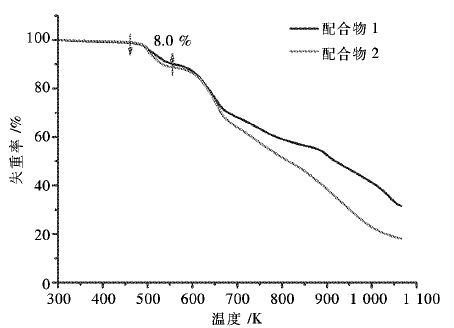 |
| 图 10 配合物1和2的热重分析曲线(TGA) Fig. 10 the TGA pattern of 1 and 2 |
3 结论
以1-甲基-1H-咪唑-4,5-二甲腈 (MID) 为有机配体,以二价过渡金属离子(Fe,Co)为路易斯酸催化剂,设计生成四唑的Sharpless反应,并成功原位合成出2个结构新颖的金属-有机配合物1和2以及不含金属离子的化合物3.
1) 配合物1和2是首个以1-甲基-1H-咪唑-4,5-二甲腈 (MID)为有机配体在Fe2+,Co2+路易斯酸催化下进行Sharpless反应的产物.
2) 配合物1和2及化合物3分子间存在着丰富的氢键. 通过分子间氢键和弱的 π-π 相互作用使得配合物1,2和化合物3形成一个具有较好热稳定性的三维网状结构.
3) 通过元素分析可知配合物1,2和化合物3中氮含量分别为44.6 %,44.3 %和50.99 %,可作为潜在的高含能材料进行进一步研究.
| [1] |
Benson F R. The chemistry of the tetrazoles[J].
Chemical Reviews, 1947, 41(1): 1–61. DOI: 10.1021/cr60128a001. |
| [2] | Dai L L, Cui S F, Damu L. et al. Recent advances in the synthesis and application of tetrazoles[J]. Chinese Journal of Organic Chemistry, 2013, 33: 224-244. |
| [3] |
Zhang H Z, Zhou C H, Geng R X, et al. Recent advances in syntheses of oxazole compounds[J].
Chinese Journal of Organic Chemistry, 2011, 31(12): 1963–1976. |
| [4] |
Demko Z P, Sharpless K B. Preparation of 5-Substituted 1H-tetrazoles from nitriles in water[J].
Organic Chemistry, 2001, 66: 7945–7950. DOI: 10.1021/jo010635w. |
| [5] | 于银梅, 谭育慧, 黄海平, 等. 一个中心对称的(6, 3)拓扑二维蜂窝网的Ni-咪唑基三脚架配合物的合成、结构及其介电性[J]. 有色金属科学与工程, 2014, 4(5): 59–65. |
| [6] | 唐云志, 王艳, 谭育慧, 等. 2,2′-联吡啶-5,5′-二羧酸CuⅡ配合物的构筑、结构及性质研究[J]. 有色金属科学与工程, 2013(4): 17–22. |
| [7] |
Tang Y Z, Yu Y M, Xiong J B, et al. One pot synthesis, crystal structures and properties of two new MOFs with imidazole-containing tripodal ligand[J].
Science China Chemistry, 2014, 57(11): 1514–1519. DOI: 10.1007/s11426-014-5169-9. |
| [8] |
Tang Y Z, Wen H R, Cao Z, et al. A novel three dimensional 3d-4f heterometallic coordination framework with 2,2′-bipyridine-3-carboxylate and oxalate ligands[J].
Inorganic Chemistry Communications, 2010, 13(8): 924–928. DOI: 10.1016/j.inoche.2010.04.027. |
| [9] |
Tan Y H, Xiong J B, Huang J, et al. A familyof tetrazole compounds formed through in situ[J].
Chinese Journal of Inorganic Chemistry, 2014, 30(7): 1621–1628. |
| [10] |
Tang Y Z, Zhou M, Huang J, et al. In situ synthesis and ferroelectric, SHG response, and luminescent properties of a novel 3D acentric zinc coordination polymer[J].
Inorganic Chemistry, 2013, 52(4): 1679–1681. DOI: 10.1021/ic302411r. |
| [11] |
Tan Y H, Wu J J, Yang L F, et al. Anion and pH induced spontaneous resolution of Δ- and Λ-[J].
CrystEngComm, 2012, 14: 8117–8123. DOI: 10.1039/c2ce26334c. |
| [12] |
Zhang W, Xiong R G. Ferroelectric Metal–Organic Frameworks[J].
Chemical Reviews, 2012, 112(2): 1163–1195. DOI: 10.1021/cr200174w. |
| [13] |
Zhao H, Qu Z R, Ye H Y, et al. In situ hydrothermal synthesis of tetrazole coordination polymers with interesting physical properties[J].
Chemical Society Reviews, 2008, 37(1): 84–100. DOI: 10.1039/B616738C. |
| [14] | Yang L N, Li J, Zhang F X, Tri (2,2′-biimidazole) nickel (Ⅱ) phthalate[J]. Acta Crystallographica Section E Structure Reports Online, 2005, 61(10): 2169-2171. |
| [15] |
Li X P, Pan M, Zheng S R, et al. Dimension-increase via hydrogen bonding and weak coordination interactions from simple complexes of 2-(pyridyl) benzimidazole ligands[J].
Crystal Growth and Design, 2007, 7(12): 2481–2490. DOI: 10.1021/cg070080j. |
| [16] |
Li X P, Zhang J Y, Pan M, et al. Zero to three dimensional increase of silver (Ⅰ) coordination assemblies controlled by deprotonation of 1,3,5-tri(2-denzimidazolyl) benzene and aggregation of multinuclear building units[J].
Inorganic Chemistry, 2007, 46(11): 4617–4625. DOI: 10.1021/ic070309k. |
| [17] | Himo F, Demko Z P, Sharpless K. B, et al. Mechanisms of tetrazole formation by addition of azide to nitriles[J]. Journal of the American Chemical Society, 2002, 124, 12210-12216. |
| [18] | Himo F, Demko Z P, Sharpless K. B, et al. Why is tetrazole formation by addition of azide to organic nitriles catalyzed by zinc(II) salts [J]. J. Am. Chem. Soc., 2003, 125, 9983-9987. |
| [19] | Sheldrick G M. SHELXS-97, Programs zur losung von kristall-strukturen[M]. Gottingen: University of Grttingen , 1997: 509-771. |
| [20] | Sheldrick G M. SHELXS-97, Programs for X-ray crystal structure refinement[M]. Gottingen: University of Grttingen , 1997: 208-311. |
| [21] |
Li Z, Li M, Zhou X P, et al. Metal directed supramolecular architectures: from mononuclear to 3D frameworks based on in situ tetrazole ligand synthesis[J].
Crystal Growth and Design, 2007, 7(7): 1992–1998. |
| [22] |
Qu Z R, Zhao H, Wang X S, et al. Homochiral Zn and Cd coordination polymers containing amino acid-tetrazole ligands[J].
Inorganic Chemistry, 2003, 42(18): 7710–7712. |
| [23] | 苏成勇, 潘梅. 配位超分子结构化学基础与进展[M]. 北京: 科学出版社 , 2010: 64-65. |
| [24] | 艾浩, 漆婷婷, 包俊, 等. 稀土Dy单分子磁体的研究进展[J]. 有色金属科学与工程, 2013(6): 82–91. |
| [25] | 谭秀珍, 陈景林, 曹兴付, 等. 一价铜卤化物的设计合成与晶态结构研究[J]. 有色金属科学与工程, 2013(1): 31–36. |
 2016, Vol. 6
2016, Vol. 6


