| Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料的合成与性能 |
富锂锰基正极材料因具有放电比容量高,循环寿命长,价格低廉,对环境友好等诸多优点而得到广泛关注[1-7],富锂锰基正极材料主要是由Li2MnO3与具有层状结构特性的LiMO2(M=Ni、Co、Mn等)材料所形成的固溶体系.Kim等[8]通过燃烧法制备的Li(Li1/6Mn1/2Ni1/6Co1/6)O2在2.0~4.8 V内0.2 C下首次放电比容量为225 mAh/g,50次循环后材料的放电比容量降为175 mAh/g;Young等[9]采用燃烧法合成了Li[Li0.2Ni0.2Mn0.6]O2正极材料,在20 mA/g的电流密度,2.0~4.8 V电压范围内材料的首次放电比容量为288 mAh/g,30次循环之后降低至213 mAh/g;Lee等[10]采用溶胶凝胶法制备的Li(Li0.2Mn0.55Co0.1Ni0.15)O2正极材料在2.0~4.8 V,20 mA/g首次放电比容量可达240 mAh/g,50次循环后材料的容量保持率仅为58. 33 %.可见富锂锰基正极材料的循环稳定性仍有待提高,而掺杂改性是改善其电化学性能的有效途径.Kang等[11]研究发现,采用Li-Ni-PO4对0.5Li2MnO3·0.5LiNi0.44Co0.25Mn0.31O2进行包覆后,材料的倍率性能得到明显改善,包覆试样在1 C倍率下的放电容量达200 mAh/g,而未包覆试样仅为170 mAh/g;Park等[12]采用Al对Li[Li0.15Ni0.275Mn0.575]O2正极材料进行掺杂改性,发现掺入少量Al后可以降低材料的面积比电阻,提高材料的循环稳定性;Jiao等[13]研究了Cr掺杂对Li[Li0.2Ni0.2Mn0.6]O2电化学性能的影响,通过溶胶凝胶法合成了Li[Li0.2Ni0.2-x/2Mn0.6-x/2Crx]O2正极材料,研究发现当x=0.04时所制备试样的电化学阻抗相比于未掺杂试样得到明显的降低,材料的放电比容量得到提高,倍率性能得到改善.本文将采用共沉淀法制备Ni0.43Mn0.57(OH)2前驱体,再将前驱体同Li2CO3和Al(OH)3混合均匀后经高温固相反应合成了Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料,考察了不同Al掺入量对材料的结构,形貌以及循环稳定性,低温放电性能等电化学性能的影响.
1 实验 1.1 Li1.07(Ni0.4Mn0.53)1-xAlxO2的合成采用MnSO4·H2O(分析纯),NiSO4·6H2O(分析纯),Al(OH)3(分析纯),NaOH(分析纯)和Li2CO3(电池级)为原料.首先将MnSO4·H2O、NiSO4·6H2O按化学计量比n(Mn):n(Ni)=53:40(物质的量比)称取一定的量配制成2 mol/L的混合盐溶液,另称取一定量的NaOH配制成4 mol/L的碱溶液.通过恒流泵将混合盐溶液和碱溶液同时均匀地滴加到反应釜中,通入氮气进行气氛保护,以NH3·H2O为络合剂,控制反应的pH=10.9~11,在55 ℃下共沉淀反应24 h制得前驱体Ni0.43Mn0.57(OH)2.将前驱体进行洗涤,过滤,真空干燥24 h后与Al(OH)3和Li2CO3按化学计量比进行均匀混合后置于箱式电阻炉中,空气气氛下,在550 ℃下保温4 h,再升温至950 ℃下保温16 h,自然冷却至室温,取出研末过筛后即得Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料.
1.2 Li1.07(Ni0.4Mn0.53)1-xAlxO2的表征实验采用荷兰PANalytical X’Pert PRO型转靶X射线衍射仪对产物进行结构分析,测试条件如下:Cu-Kα辐射,40 kV管电压,40 mA管电流,扫描范围为2θ=10 °~80 °,步长为0.02 °,扫描速度为10 (°)/min;采用德国ZEISS EVO/MA10型扫描电镜对产物的表面形貌进行分析;采用丹东百特BT-9300ST型激光粒度分布仪对产物进行粒度分析.
1.3 Li1.07(Ni0.4Mn0.53)1-xAlxO2的电化学性能测试将制备好的Li1.07(Ni0.4Mn0.53)1-xAlxO2作为正极材料,Super-P和KS-6为导电剂,聚偏氟乙烯为黏结剂,四者按质量比90:2.5:2.5:5,加入溶剂N-甲基吡咯烷酮,制成黏度适宜的浆料,涂敷在铝箔上,制成正极片;采用MCMB为负极材料,Super-P和KS-6为导电剂,聚偏氟乙烯为黏结剂,四者按质量比90:1.5:1.5:7,加入溶剂N-甲基吡咯烷酮,配制黏度适宜的浆料,涂覆在铜箔上,制成负极极片.采用深圳新宙邦生产的1 mol/L LiPF6/DMC+EMC+EC(体积比为1:1:1) 电解液,Celgard2300隔膜,在通有流动干燥的除湿房中,卷绕组装成软包电池.
采用NEWARE BTS 5V3A型电池测试系统对装配好的电池进行电性能测试,充放电电压范围为2.75~4.2 V,测试温度为-20 ℃和25 ℃;采用SOLARTRON 1287+1260型电化学工作站对装配好的电池进行电化学阻抗测试,测试温度为25 ℃,频率范围为10 mHz~1 MHz,交流电压振幅为5 mV.
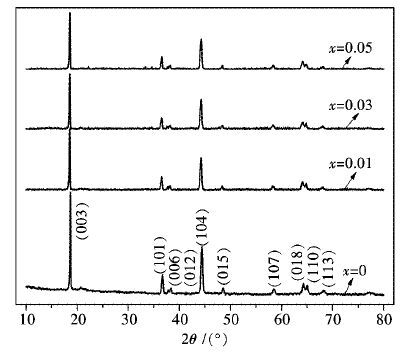
2 分析与讨论 2.1 Li1.07(Ni0.4Mn0.53)1-xAlxO2的晶体结构图 1为Li1.07(Ni0.4Mn0.53)1-xAlxO2的XRD图谱.由图 1可以看出,不同掺Al量下所得试样的主要衍射峰均为层状α-NaFeO2的特征峰,材料归属于六方晶系,空间群为Rm.掺入不同量的Al后所得各试样的衍射图谱相比于未掺杂时的Li1.07Ni0.4Mn0.53O2的衍射图谱中的峰形、峰位接近且无其它杂相峰的出现,表明Al3+成功进入材料的晶格中形成固溶体结构,而且Al的掺杂并不会改变Li1.07Ni0.4Mn0.53O2的本体晶型结构.各试样XRD图谱中(006) 和(012) ,(018) 和(110) 2组峰都存在明显的分裂,表明所制备各试样的层状结构较好[14].
 |
| 图 1 Li1.07(Ni0.4Mn0.53)1-xAlxO2的XRD图谱 Fig. 1 XRD patterns of Li1.07(Ni0.4Mn0.53)1-xAlxO2 |
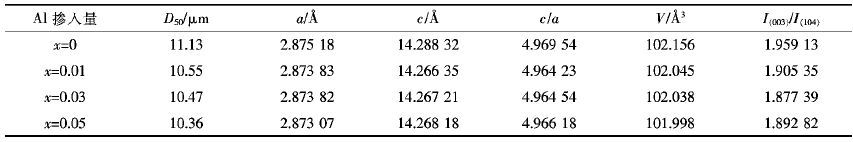
表 1列出了Li1.07(Ni0.4Mn0.53)1-xAlxO2的路径与晶胞参数值.由表 1可以看出,相比与未掺Al时Li1.07Ni0.4Mn0.53O2的晶胞参数,Li1.07(Ni0.4Mn0.53)1-xAlxO2的a,c和晶胞体积(V值)均更小,且随着Al掺入量的增加,所制备材料的晶胞体积越来越小.这是由于Al3+的离子半径(0.535 )与Mn4+的离子半径(0.53 )相近,却明显小于Ni2+的离子半径(0.69 ).Al掺入后所得各试样的c/a值均大于4.899,表现出试样较好的层状结构.此外,I(003)/I(104)值可以用来衡量材料中阳离子混排程度,其数值越大,表明阳离子混排程度越小[15].一般认为,当I(003)/I(104)值大于1.2时,材料的阳离子混排程度较小,离子有序度较好.各试样的I(003)/I(104)值均大于1.87,表明所制备试样较弱的阳离子混排程度.
| 表1 Li1.07(Ni0.4Mn0.53)1-xAlxO2的粒径与晶胞参数表 Table 1 Particle size and lattice parameters of Li1.07(Ni0.4Mn0.53)1-xAlxO2 |
 |
| 点击放大 |
2.2 Li1.07(Ni0.4Mn0.53)1-xAlxO2的表面形貌
图 2为Li1.07(Ni0.4Mn0.53)1-xAlxO2的SEM图.由图 2可以看出,各试样均呈现明显的层状岩盐形貌,且试样的晶粒形态并不随掺Al量的增加而出现较为明显的变化,说明Al的掺杂并不会改变材料的形态结构.各试样颗粒均是由多个一次颗粒聚集形成的二次颗粒,颗粒间存在较多空隙.随着Al的掺入,材料颗粒间的团聚现象越为明显,当Al掺入量为0.5时,试样团聚严重.结合表 1可知,Al的掺入可以降低材料的中位径.正极材料颗粒粒径减小可以缩短充放电过程中Li+的迁移路径,从而降低材料的内阻,提升材料的电化学性能.但材料粒径太小致使颗粒的表面能增大,材料团聚严重.综合对比可知,Al掺入量为0.03所得试样的颗粒分布较为均匀,粒径较为适中.
 |
| 图 2 Li1.07(Ni0.4Mn0.53)1-xAlxO2的SEM图 Fig. 2 SEM images of Li1.07(Ni0.4Mn0.53)1-xAlxO2 |
2.3 Li1.07(Ni0.4Mn0.53)1-xAlxO2的电化学性能
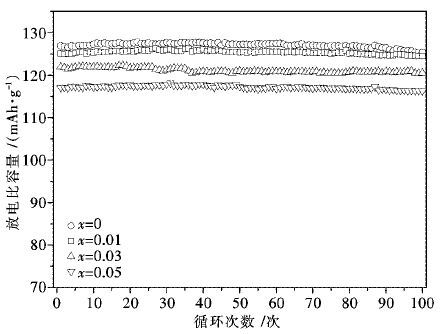
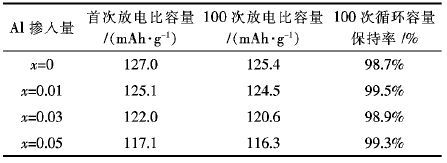
图 3为Li1.07(Ni0.4Mn0.53)1-xAlxO2在25 ℃,2.75~4.2 V电压范围内,0.5 C倍率下的循环曲线图,表 2为Li1.07(Ni0.4Mn0.53)1-xAlxO2在0.5 C倍率不同循环周次下的放电比容量表.由图 3和表 2可以看出,未掺杂Al所得Li1.07Ni0.4Mn0.53O2材料的首次放电比容量为127.0 mAh/g,100次循环后的容量保持率为98.7 %.随着Al掺入量的增加,材料的放电比容量逐渐降低,但掺铝后所得材料在0.5 C下经100次循环之后的容量保持率有所提高,其中x=0.01时所得试样的首次放电比荣为125.1 mAh/g,100次循环后的容量保持率达到99.5%.这主要是因为Al3+在材料结构中不具有电化学活性,不能贡献电化学容量,而材料中的活性Ni2+的含量随着Al掺入量的增加而减小,使得材料的放电比容量降低.同时正是在材料结构中不变价态的Al3+,其离子半径较小,离子间的作用力较大而起着稳定材料结构的作用,使得Li+能在Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料中的顺利脱嵌,增强了材料的循环稳定性能.Al掺杂量不宜太大,否则将带来较大的放电比容量的降低,当x=0.03时,材料的放电比容量相比于未掺杂时下降较为明显,0.5 C下的首次放电比容量仅为117.1 mAh/g.
 |
| 图 3 Li1.07(Ni0.4Mn0.53)1-xAlxO2的循环曲线图 Fig. 3 Cycle performance curves of Li1.07(Ni0.4Mn0.53)1-xAlxO2 |
| 表2 Li1.07(Ni0.4Mn0.53)1-xAlxO2在0.5 C不同循环次数下的放电比容量表 Table 2 Discharge specific capacity of Li1.07(Ni0.4Mn0.53)1-xAlxO2 in different cycles with 0.5 C |
 |
| 点击放大 |
图 4为Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料在25 ℃,2.75~4.2 V内不同倍率下的循环曲线图.由图 4可以看出,随着放电倍率的增加,材料的放电比容量均呈现不同程度的降低,这主要是因为放电倍率越大,单位时间内材料结构中Li+的脱嵌量越大,对材料结构的冲击和破坏的程度就越严重.同时,大倍率充放电下电极材料的极化程度加剧,电池内阻增加,致使放电比容量的降低.Li1.07Ni0.4Mn0.53O2在1 C和2 C倍率下的放电比容量分别为0.2 C放电比容量的92.8 %和87.8 %,x=0.01所得试样在1 C和2 C倍率下的放电比容量分别为其0.2 C放电比容量的93.4 %和88.3 %.由此说明少量Al的掺入可以在一定程度上提高材料的倍率性能.
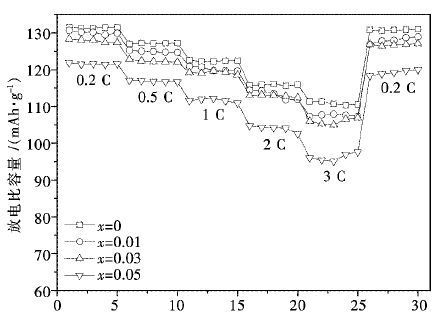 |
| 图 4 Li1.07(Ni0.4Mn0.53)1-xAlxO2在不同倍率下的循环曲线图 Fig. 4 Rate capacity of Li1.07(Ni0.4Mn0.53)1-xAlxO2 cycled at different rates |
将Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料装配成电池,在25 ℃,2.75~4.2 V内以0.2 C倍率循环5次,记录稳定后电池的放电容量为室温放电容量,之后以0.2 C恒流充电至4.2 V,在4.2 V下恒压充电至电流下降到0.02 C,将电池转入低温箱中,在-20 ℃下放置16 h后,以0.2 C倍率进行放电所得的容量记为低温放电容量,低温放电效率为电池的低温放电容量与室温放电容量的百分比.图 5为Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料在-20 ℃,2.75~4.2 V,0.2 C倍率下的放电曲线图,由图 5可以看出,对于纯相的Li1.07Ni0.4Mn0.53O2而言,其在-20 ℃,2.75~4.2 V,0.2 C倍率下的放电容量仅为25 ℃,2.75~4.2 V,0.2 C倍率下放电容量的36.7 %,随着Al掺入量的增加,材料的低温放电效率呈现先增大后减小的变化规律.其中x=0.03时所得试样在-20 ℃,2.75~4.2 V,0.2 C倍率下的放电容量为25 ℃,2.75~4.2 V,0.2 C倍率下放电容量的41.1 %.表明少量Al的掺入可以改善材料的低温放电性能.
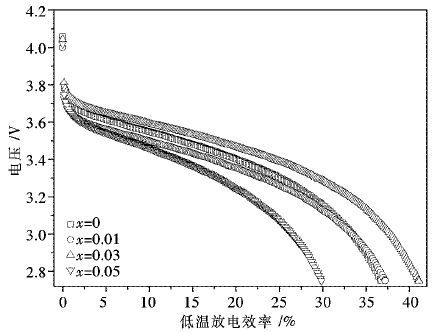 |
| 图 5 Li1.07(Ni0.4Mn0.53)1-xAlxO2在-20 ℃,0.2 C倍率下的放电曲线图 Fig. 5 Discharge efficiency curves of Li1.07(Ni0.4Mn0.53)1-xAlxO2 cycled at -20 ℃ with 0.2 C |
为进一步考察Al掺入后材料电化学性能得到改善的原因,对所制备的Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料装配成软包电池后先以0.2 C循环5次,再以0.2 C恒流充电至电压为4.0 V后用于电化学阻抗测试.图 6为不同掺Al量下所得Li1.07(Ni0.4Mn0.53)1-xAlxO2的EIS图谱及其等效电路图.
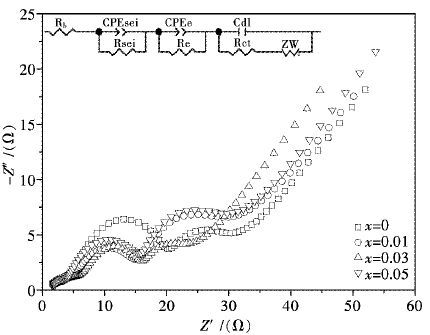 |
| 图 6 Li1.07(Ni0.4Mn0.53)1-xAlxO2的EIS图谱及其等效电路图 Fig. 6 EIS patterns and equivalent circuit of Li1.07(Ni0.4Mn0.53)1-xAlxO2 |
由图 6可以看出,各试样的EIS图谱均由4部分组成:3个半圆加一直线.高频区压缩的扁半圆所对应的是Li+在材料表面SEI膜层中的迁移过程,中高频区的半圆对应为Li+通过SEI膜层后进入材料内部的输运过程,中频区的半圆对应的是电荷传递过程,低频区的直线对应的是Li+在材料中的扩散过程[16-17].在EIS等效电路图中,Rb代表材料的欧姆电阻,Rsei代表Li+通过SEI膜时产生的阻抗,Re代表材料的电子传输电阻,是表征电子在材料颗粒内部输运过程的基本参数,Rct代表材料的电荷传递阻抗,Zw代表Li+扩散过程中产生的Warburg阻抗,CPEsei和CPEe分别为与Li+在SEI膜迁移过程和Li+在材料内部颗粒输运过程有关的恒相位角元件,Cdl为双电层电容[18-20].
表 3为EIS图谱拟合数据.由表 3可以看出,少量Al的掺入可以降低Li+在正极材料中的电荷传递阻抗(Rct),从而改善材料的低温放电性能.随着Al掺入量的增加,材料的Rct值先减小后增大,其中x=0.03所对应试样的Rct值最小,低温放电效率最高,随着Al的掺入量的进一步增加,材料的Rct值又变大,低温放电效率也开始降低.这与Al掺入后材 料的低温放电效率的变化规律一致.
| 表3 EIS图谱拟合数据 Table 3 The fitting data of EIS patterns |
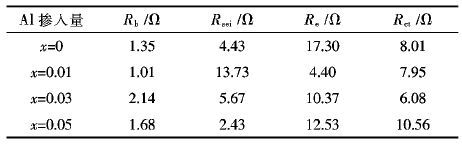 |
| 点击放大 |
3 结论
采用共沉淀法制备出Ni0.43Mn0.57(OH)2前驱体,将其与Li2CO3和Al(OH)3按化学计量比均匀混合后,经高温固相烧结合成了Li1.07(Ni0.4Mn0.53)1-xAlxO2正极材料.研究结果表明,少量Al的掺入并不会改变材料的晶体结构,Al掺杂后所得材料的颗粒粒度有所减小,放电比容量相比于未掺杂试样有所降低,但掺Al后所得试样循环的稳定性和倍率性能得到了改善.其中x=0.01所得试样在25 ℃,2.75~4.2 V,0.5 C倍率下的首次放电比容量为125.1 mAh/g,100次循环后的容量保持率达到99.5 %.此外,掺入少量Al后,试样的电荷传递阻抗有所降低,低温放电性能有所改善,其中x=0.3时所合成材料的低温性能最好,材料在-20 ℃,0.2 C下的放电效率由未掺杂试样的36.7 %提升到了41.1 %.
| [1] | Lu Z H, Beaulieu L Y, Donaberger R A, et al. Synthesis, structure, and electrochemical behavior of Li[NixLi1/3-2x/3Mn2/3-x/3]O2[J].J Electrochem Soc,2002,149(6):A778-A791. |
| [2] | Johnson C S, Li N, Lefief C, et al. Synthesis,characterization and electrochemistry of lithium battery electrodes: xLi2MnO3·(1-x)LiMn0.333Ni0.333Co0.333O2(0≤x≤0.7)[J].Chem Mater,2008, 20(19):6095-6106. |
| [3] |
Castel E, Berg E J, Kazzi M E, et al. Differential electrochemical mass spectrometry study of the study of the interface of xLi2MnO3·(1-x)LiMnO2(M=Ni, Co, and Mn) material as a positive electrode in Li-ion batteries[J].
Chem Mater, 2014, 26: 5051–5057. DOI: 10.1021/cm502201z. |
| [4] | 钟盛文, 徐宝和, 吴甜甜, 等. Mg2+掺杂对富锂锰基材料性能的影响[J]. 电源技术, 2013, 37(1): 32–34. |
| [5] | 钟盛文,吴甜甜,徐宝和,等.层状锰基材料Li[Li0.2Mn0.54Ni0.13Co0.13]O2的固相合成及电化学性能[J].电源技术,2012,36(1):59-62. |
| [6] | 徐宝和,吴甜甜,钟盛文,等.Si4+掺杂对富锂Li[Li0.15Mn0.575Ni0.275]1-xSixO2材料性能的影响[J].有色金属科学与工程,2012,3(2):24-27. |
| [7] | Hy S, Felix F, Rick J, et al. Direct in situ observation of Li2O evolution on Li-rich high capacity cathode material, Li[NixLi(1-2x)/3Mn(2-x)/3]O2(0≤x≤0.5) [J].J Am Chem Soc,2014, 136(3):999-1007. |
| [8] | Kim G Y, Yi S B, Park Y J,et al. Electrochemical behaviors of Li[Li(1-x)/3Mn(2-x)/3Nix/3Cox/3]O2 cathode series (0<x<1) synthesized by sucrose combustion process for high capacity lithium ion batteries[J].Materials Research Bulletin,2008,43: 3543-3552. |
| [9] | Young S H, Yong J K,Kwang S R,et al. Charge/discharge behavior of Li[Ni0.20Li0.20Mn0.60]O2 and Li[Co0.20Li0.27Mn0.53]O2 cathode materials in lithium secondary batteries[J].Solid State Ionics,2005,176:1035-1042. |
| [10] | Lee S H, Koo B H, Kim J C, et al. Effect of Co3(PO4)2coating on Li[Co0.1Ni0.15Li0.2Mn0.55]O2 cathode material for lithium rechargeable batteries[J].J Power Sources,2008,184(1):276-283. |
| [11] |
Kang S H, Thackeray M M. Enhancing the rate capability of high capacity xLi2MnO3·(1-x)LiMO2(M=Mn, Ni, Co) electrodes by Li-Ni-PO4 treatment[J].
Electrochem Commun, 2009, 11(4): 748–751. DOI: 10.1016/j.elecom.2009.01.025. |
| [12] | Park S H, Sun Y K. Synthesis and electrochemical properties of layered Li[Li0.15Ni(0.275-x/2)AlxMn(0.575-x/2)]O2 materials prepared by sol-gel method[J].J Power Sources,2003,119/120/121:161-165. |
| [13] | Jiao L F,Zhang M, Yuan H T, et al. Effect of Cr doping on the structural,electrochemical properties of Li[Li0.2Ni0.2-x/2Mn0.6-x/2Crx]O2(x=0, 0.02, 0.04, 0.06, 0.08) as cathode materials for lithium secondary batteries[J].J Power Sources,2007,167(1):178-184. |
| [14] | Liu H S, Li J, Zhang Z R, et al. Structural, electrochemical and thermal properties of LiNi0.8-yTiyCo0.2O2 as cathode materials for lithium ion battery[J].Electrochim Acta,2004, 49(7):1151-1159. |
| [15] |
Hwang B J, Santhanam R, Chen C H. Effect of synthesis conditions on electrochemical properties of LiNi1-yCoyO2 cathode for lithium rechargeable batteries[J].
J Power Sources, 2003, 114(2): 224–252. |
| [16] | Chen Y, Chen Z, Xie K. Effect of annealing on the first-cycle performance and reversible capabilities of lithium-rich layered oxide cathodes[J].J Phys Chem C,2014,118(22): 11505-11511. |
| [17] | Liu J, Jayan R, Manthiram A. Conductive surface modification with aluminum of high capacity layered Li[Li0.2Mn0.54Ni0.13Co0.13]O2 cathodes[J]. J Phys Chem C,2010,114(20): 9528-9533 |
| [18] | 庄全超, 徐守冬, 邱祥云, 等. 锂离子电池化学阻抗谱分析[J]. 化学进展, 2010, 22(6): 1044–1057. |
| [19] | Deng Y H, Liu S Q,Liang X X. Study of carbon surface-modified Li[Li0.2Mn0.54Ni0.13Co0.13]O2 for high-capacity lithium ion battery cathode[J].J Solid State Electrochem,2013,17(4):1067-1075. |
| [20] |
Guo S H, Yu H J, Liu P, et al. Surface coating of lithium-manganese-rich layered oxides with delaminated MnO2 nanosheets as cathode materials for Li-ion batteries[J].
J Mater Chem A, 2014, 2: 4422–4428. DOI: 10.1039/c3ta15206e. |
 2016, Vol. 6
2016, Vol. 6


