| 羧基取代镍酞菁配合物的合成及其电化学性能研究 |
随着储能电源和电动汽车的迅猛发展,对锂离子电池的性能提出了更高的要求,开发出高能量密度的锂离子电池成为未来研究的热点方向[1-2].正极材料对锂离子电池性能的提高有重要影响.目前,广泛使用的无机正极材料为锂过渡金属氧化物,如LiCoO2、LiNiO2、LiMn2O4、LiFePO4等,它们有如 下缺点[3-4]:①容量提升空间有限:理论比容量均在300 mA·h/g以下,实际可用的比容量不超过200 mA·h/g;②不符合可持续发展的要求:以不可再生的矿藏为原料,同时开采它们需要消耗大量能量;③存在安全隐患:当电池过充时,易产生高价态金属氧化物,并伴随氧气的释放,导致与电解液发生剧烈的放热反应.因此,需要开发比容量更高、安全性更高、在自然界中储量更为丰富的绿色能源材料.
与无机正极材料相比,有机物正极材料具有理论比容量高、原料丰富、环境友好、结构可设计性强、体系安全的优点[5],是一类具有广泛应用前景的储能物质.在锂离子电池正极材料的研究中,一些学者开始了有机化合物作为正极材料的研究,合成了一些特殊结构的有机化合物,研究了它们的电化学性能以及电化学反应机制,取得了一些突破性的成果,为锂离子电池有机物正极材料的设计提供了新思路.研究较多的锂电池有机正极材料[5-6]主要包括导电聚合物、含硫化合物、氮氧自由基化合物和含氧共轭化合物等,其中含氧共轭化合物[7]由于拥有大的共轭体系、含有多个羰基官能团等特点使得该类材料具有结构多样性、比容量高和反应动力学快等优点,将作为一类新兴的电化学储能材料受到人们广泛关注.因此,相对其他几类有机电极材料来说,基于共轭含氧化合物的有机电极材料最有望发展成为下一代绿色锂电池有机电极材料.
目前国内外有很多学者针对有机化合物作为锂离子电池正极材料方面进行了大量卓有成效的工作[7],特别是在含氧有机共轭化合物方面,一些电化学活性高的含氧官能团及其分子结构对有机正极化合物的设计具有重要的指导和借鉴意义,其中关于解决有机物正极材料在电解液中的溶解[8-13]、导电率偏低[14-19]等问题的方法也有很多可借鉴之处.作为锂离子正极活性材料的有机化合物分子,要实现优良的电化学性能,必须考虑以下3个方面的因素:①实现锂离子在充放电过程的入嵌与脱嵌;②在电解液中不溶解;③具备一定的导电性能.
目前,已有的含氧有机化合物正极材料的研究从导电剂的添加[20-22]、羰基化合物的锂/钠盐化[23-29]、羰基化合物的聚合过程[30-35]等方面进行了许多改进措施,取得了一定的成效,但仍然存在以下问题:①导电剂的加入虽然在一定程度上改善溶解性和导电性能,但是会造成电极容量的显著降低;②锂盐化措施虽然可以降低溶解性,但使额外引入的多个非电化学活性的Li+-O-官能团,导致比容量降低,而且官能团Li+-O-的供电子效应使相应的小分子共轭羰基化合物的氧化还原电位下降,不利于正极材料的性能发挥;③聚合过程虽然可以有效降低溶解性,但是会引入没有化学活性的组分(如偶联单元)而导致比容量降低,且聚合物低的导电性和单体间大的电荷排斥力引起较慢的离子/电子传输速率,同时聚合物在充放电过程中的溶胀性及其本身的凝聚态结构也会对锂离子的扩散迁移速率产生影响.
为了同时解决这些难题,本文在现有研究的基础上,扬长避短,将电化学活性较高的含氧共轭基团取代到稳定的酞菁大环共轭体系上,构建一种新型的含氧共轭活性化合物分子模型.采用“固相”模板合成法和特殊的分离提纯工艺制备得到了纯净的四羧基取代镍酞菁有机配合物,与一定比例的导电剂I2和炭黑混合掺杂后球磨分散制备得到酞菁活性纳米颗粒,并以锂片为负极,考察了该纳米活性颗粒的电化学性能,分析了其羧基官能团导电机理.有望解决现有有机化合物作为锂离子电池正极材料所面临的普遍问题.
1 实验 1.1 羟基酞菁化合物的合成“模板”反应合成法,即以中心NiCl2.6H2O金属盐作为“模板剂”,与可形成酞菁环的“分子碎片”偏苯三甲酸酐直接发生“模板反应”得到金属酞菁配合物.合成路线如图 1所示,将偏苯三甲酸酐、尿素、六水合氯化镍和钼酸铵一起放入研钵中均匀混合后转移倒入烧杯中,置于烘箱中加热至100 ℃并保持30 min,直至烧杯内部不再出现气泡为止,然后设置温箱温度到180 ℃恒温反应4 h,冷却后将得到的黑色固体碾碎后加入到500 mL 1.0 mol/L的盐酸/氯化钠的饱和溶液中,微沸后冷却、过滤、干燥.
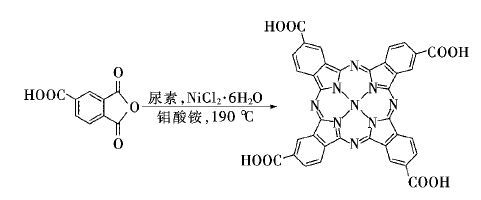 |
| 图 1 羧基取代酞菁活性化合物合成路线图 Fig. 1 synthetic route of Carboxyl substituted phthalocyanine compounds |
1.2 羟基酞菁化合物的分离
羧基取代酞菁化合物在绝大多数溶液中很难溶解,非常不利于其分离提纯,且由于具有大环共轭结构,酞菁分子化合物容易发生分子间的相互作用而产生聚集体,加大了分离提纯的难度.因此,采用常规的柱状色谱柱分离提纯方法对羧基取代酞菁化合物提纯行不通,需要设计特殊的分离提纯工艺,如图 2所示.
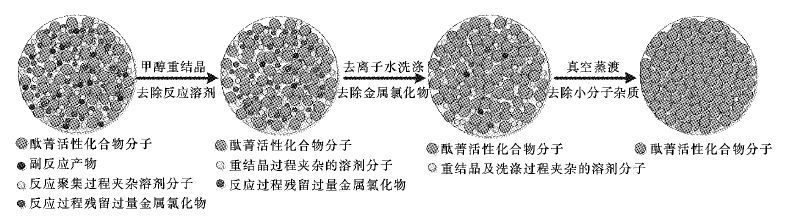 |
| 图 2 含氧共轭酞菁化合物提纯路线图 Fig. 2 Purification process of carboxyl substituted phthalocyanine compounds |
将合成后干燥的产物加入到500 mL的氢氧化钠溶液中并加热到100 ℃,在此温度反应至无氨气放出.冷却溶液,将其倒入1 000 mL的去离子水中,用6.0 mol/L的盐酸溶液调节pH=2,静置24 h,待产品完全沉淀后,过滤分离,产品用去离子水、甲醇洗涤多次,将绝大多数小分子量的副产物、反应聚集过程夹杂的溶剂分子和反应过量残留的金属氯化物去除,再放入真空箱中于180 ℃下蒸镀12 h,以去除少量残留的低沸点杂质.得到7.84 g羧基取代酞菁化合物 (Ni-Pc).产率(80 %).质谱(MS-EI (m/z): 810.2 (M+),764.18 (M+-NO2),764.18 (M+-2NO2),764.18 (M+-3NO2); 1H-NMR (DMSO-d6,400Hz): 7.67-7.63 (d,4H),7.48-7.51 (d,4H),7.07-7.10 (d,4H) ppm. 元素分析Elemental Analysis: C,53.29; H,2.98; N,20.72; Ni,7.23; O,15.78,Found: C,53.21; H,3.05; N,20.61; Ni,7.29; O,15.84.
1.3 羟基取代酞菁活性化合物颗粒的改性将酞菁活性物质、导电剂I2和黏结剂PVDF按质量比85:10:5 的比例混合后放入球磨机球8 h,取出过筛 (230目,孔径0.062 mm),在筛下固体混合粉末中加入适量的NMP溶液,再次放入球磨机中球磨4 h直到均匀混合.将混合均匀的浆液涂覆到铜箔上,加热干燥后得到纳米活性正极材料.
1.4 电池的制备按照图 3的工艺流程将酞菁活性物质、碘颗粒与黏结剂PVDF的NMP溶液均匀混合制浆,涂覆在铜箔上制成酞菁活性纳米颗粒作为正极材料.以锂片为负极,1 mol/L的LiPF6为电解液,组装成扣式电池,密封备用.
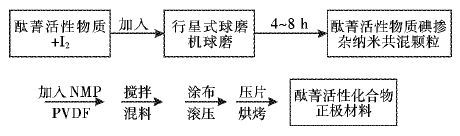 |
| 图 3 酞菁活性正极材料制备工艺流程 Fig. 3 preparation process of phthalocyanine active cathode material |
2 结果与讨论 2.1 碘掺杂前后吸收光谱对比
将未掺杂和掺杂I2的酞菁活性物质溶解在NMP中制备成1×10-4 mol/L的溶液,测量它们的紫外可见吸收光谱.如图 4所示,分别为I2、Ni-Pc掺杂前后在NMP溶液中的吸收光谱,可以看出单质碘I2在NMP中的特征吸收峰为422 nm,而未掺杂I2的Ni-Pc在NMP溶液的特征吸收峰包括B带吸收(358 nm与410 nm)和Q带吸收(650 nm与700 nm),经过I2掺杂之后,Ni-Pc的NMP溶液吸收峰出现明显变化,具体表现在:①350~400 nm之间的B带吸收峰强度增大,而630~710 nm之间的Q带吸收峰明显减弱;②Q带吸收峰变得又宽又矮,且在490 nm有一个新的吸收峰产生.
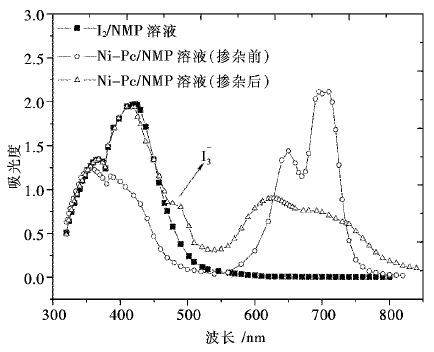 |
| 图 4 碘掺杂前后四羟基酞菁化合物UV-Vis吸收光谱 Fig. 4 UV-Vis spectra of I2 and Ni-Pc in NMP solution |
碘(I2)是很好的电子受体,将其掺杂在酞菁化合物分子中形成电荷转移络合物(CTC)[36],氮原子向碘转移了电子,形成I3-,这样就有了氧化态的共轭分子和还原态的I3-分别堆砌成2个有序的分子柱,使得酞菁环之间的距离拉近,具备了一维导体的聚集态结构.通常情况下,酞菁聚集态结构的形成会导致Q带吸收产生明显的变化[37-38],即Q带吸收峰变成了又宽又矮的“鼓包”形状,且分裂变得不明显,正如图 4中的Q带吸收峰,由未掺杂前的(650 nm与700 nm)转变为掺杂后的(628 nm与730 nm),宽度明显变长且强度显著降低.此外,碘掺杂后,碘与酞菁化合物形成CTC络合物,在490 nm处产生一个新的吸收峰,该峰即为新形成的I3-的特征吸收峰[39],而酞菁B带的吸收峰也会因CTC络合物的形成而强度增大.
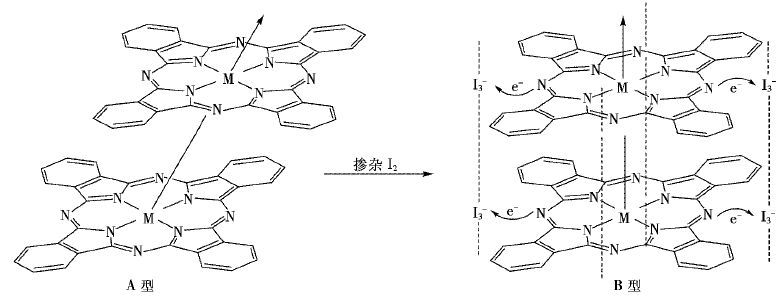 |
| 图 5 酞菁化合物碘掺杂后的构型变化示意图 Fig. 5 Configuration change process of phthalocyanine compound before and after dopping I2 |
如图 5所示,对于β型MPc,上下两层之间要错开45°左右(A型),层与层之间的重叠程度较差,因而表现为带宽窄、能隙大.碘掺杂以后,晶体的构型为(B型),上下两层之间变成正对而有一旋转角,这是碘对2层的吸引作用的结果,使得上下两层之间的电子云重叠程度增强,带宽增宽,能隙变窄,从而电导率显著提高[36, 39].
对电池的阻抗性能进行了测试,结果如图 6所示.可以看出掺杂I2后活性电极的阻抗与未掺杂碘的酞菁活性材料相比,其阻抗值明显降低,充分验证了碘掺杂对酞菁活性电极导电性能的改善效果.此外,碘掺杂的导电性能改性技术,与文献[20~23]中掺杂大量导电炭黑和碳纳米管的改性方法相比,导电性更好.且导电剂I2含量为10 %,明显低于文献中导电炭黑的百分含量(35 %),充分验证了低质量-高效率掺杂的显著效果.
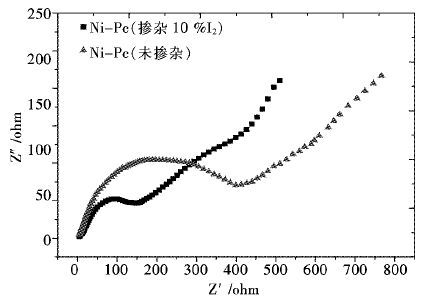 |
| 图 6 碘掺杂前后羧基酞菁活性化合物阻抗(EIS)谱图 Fig. 6 EIS spectra of phthalocyanine compound before and after dopping I2 |
2.2 表面形貌分析
碘掺杂羟基取代酞菁化合物经过行星式球磨机研磨后,制浆涂布在铝箔上,选取烘干后的样品进行SEM扫描电镜测试,如图 7所示,球磨后酞菁活性物质的颗粒尺寸大小分布在0.5~5 m之间,因掺杂后I2和酞菁活性化合物形成CTC络合物,分别堆砌成2个有序的分子柱(见图 5) ,形成的I3-分子柱分布在酞菁分子柱的周边,由图 6可以看出颗粒大小在20 nm左右,且连续的絮状物质即为I3-分子柱,分布在酞菁活性化合物的周围,对提高活性物质的导电性能发挥重要作用.
 |
| 图 7 碘掺杂酞菁活性化合物正极表面结构形貌 Fig. 7 SEM of phthalocyanine compound after dopping I2 |
2.3 充放电性能研究
球磨后的样品制浆涂布在铜箔上,以锂片为负极组装成扣式电池,先恒流放电至0.3 V,使样品充满Li+,再在0.3~3.2 V电压范围内充放电,前3次所得的容量微分曲线如图 8所示,样品在1.0 V有一较大的氧化峰和2.7 V有较小氧化峰.2.7 V的氧化峰面积较小,对应的容量不高,而1.0 V处的峰面积更大,电压相对较低,也可以尝试用做负极材料.
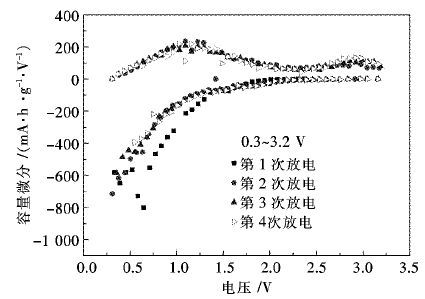 |
| 图 8 电极的容量微分曲线图(电压范围0.3-3.2V) Fig. 8 Differential capacity curve of phthalocyanine cathode (voltage range 0.3-3.2V) |
2.4 循环性能研究
组装后的扣式电池,先恒流放电至0.3 V,使样品充满Li+,再在0.3~3.2 V电压范围内充放电.如图 9和图 10所示,活性化合物的初始放电容量在850 mA·h/g,然后容量迅速下降,经过10次循环容量下降至400 mA·h/g左右,此后容量保持稳定,在55次循环的放电容量仍然保持在300 mA·h/g左右.
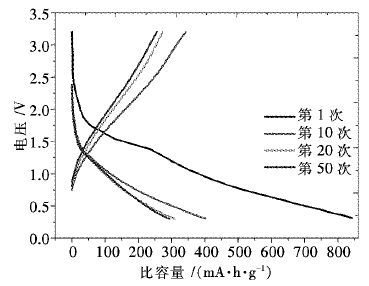 |
| 图 9 充放电曲线 Fig. 9 charge/discharge cycle curve |
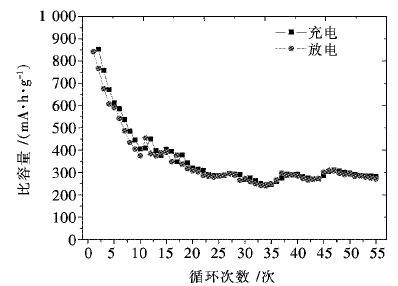 |
| 图 10 充放电容量随循环次数变化曲线 Fig. 10 Change curve of specific capacity with the cycle number |
酞菁化合物周边取代的羰基具备较高的氧化还原电位,是产生充放电性能的重要官能团,其电化学反应机制[4-7]是 :放电时每个氧原子得一个电子,同时嵌入锂离子生成Li+-O-锂盐;充电时锂离子脱出,氧原子还原,通过含氧基团和Li+-O-锂盐结构之间的转换实现锂离子可逆地嵌入和脱出(图 11) .
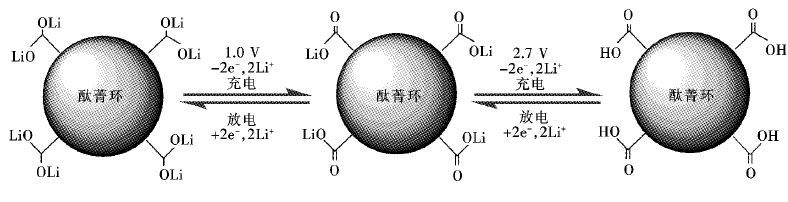 |
| 图 11 羟基取代酞菁活性物质充放电机理图 Fig. 11 Schematic diagram of mechanism for carboxyl substituted phthalocyanine compounds |
样品在1.0 V有一较大的氧化峰和2.7 V有一较小氧化峰.2.7 V的氧化峰属于羧基的锂盐化峰,过程不涉及共轭体系的变化,故面积较小,对应的容量不高;而1.0 V处的氧化峰属于羰基的锂盐化过程,涉及共轭体系的重排,因而峰面积更大.因此,关于初期放电容量衰减较快的原因可以归结为以下2个方面:①羟基的嵌锂过程一部分来自于锂盐化过程,产生的羧酸锂形成了牢固的共价键,而且此过程不参与共轭结构的可逆转化,故最易成为不可逆容量的主要来源;②由于羧基易与铝箔发生反应,故初期研究采用铜箔作为集流体,但Li+会与铜箔表面少量的氧化铜之间发生氧化还原嵌锂反应,而使锂离子流失产生不可逆容量,造成初期容量的迅速下降.
后续将通过进一步的改进研究,采用碳膜或镍网作为集流体及其它改性措施,并进一步研究其导电机制和活性点位抑制机理,循环改进,有望得到更高比容量和循环稳定性能的酞菁活性材料.
3 结论将电化学活性高的羟基基团取代到酞菁大环共轭体系中,研究了酞菁活性化合物作为锂离子电池正极材料的电化学性能.通过掺杂I2使得酞菁化合物形成电荷转移络合物(CTC),分别堆砌成2个有序的分子柱,具备了一维导体的聚集态结构,表现在Q带吸收峰强度显著下降、B带吸收峰显著增强.通过球磨法得到颗粒分布在0.5~5 m之间的酞菁活性物质,掺杂的I2单质颗粒大小在20 nm左右,分布在活性化合物的间隙之中,对提高活性物质的导电性能发挥重要作用.电化学性能研究表明:活性物质在1.0 V有一较大面积的氧化峰和2.7 V有一较小面积氧化峰,初始放电容量达到850 mA·h/g,然后容量迅速下降,经过10次循环容量下降至400 mA·h/g左右,此后容量保持稳定,在55次循环的放电容量仍然保持在300 mA·h/g左右.关于放电容量在早期衰减较快的原因分析及其改进工作后续正在研究之中.
| [1] | 冯瑞, 王立伟, 吕之阳, 等. 高性能LiFePO4/碳纳米笼锂离子电池正极材料[J]. 化学学报, 2014, 72: 653. |
| [2] | 钟盛文,钟风娣,张骞.锂离子正极材料LiNi0.5Mn0.3Co0.2O2的合成与掺杂Al的性能研究[J].有色金属科学与工程,2013,4(4):11-16. |
| [3] | Goodenough J B,Kim Y. Challenges for rechargeable Li batteries[J]. Chem. Mater., 2010,22:587-603. |
| [4] | 赵磊, 王维坤, 王安邦, 等. 含氧有机物作为锂电池正极材料[J]. 化学进展, 2010, 22(12): 2268–2715. |
| [5] | Liang Y L, Tao Z L,Chen J. Organic Electrode Materials for Rechargeable Lithium Batteries[J]. Adv. Energy Mater.,2012,2:742-769. |
| [6] |
Wang Y C, Luo L, Liu Y, Hao J Y. Research Development on Polymer Cathode Materials for Lithium Ion Batteries[J].
Chemical Industry and Engineering Progress, 2013, 32(1): 134–139. |
| [7] | 王诗文, 陶占良, 陈军. 锂离子电池有机共轭羰基化合物电极材料研究进展[J]. 科学通报, 2013, 58(31): 3132–3139. |
| [8] | Chen H, Armand M,Demailly G, Dolhem F,Poizot P, Tarascon J M. From Biomass to a Renewable LiXC6O6 Organic Electrode for Sustainable Li-Ion Batteries (pages 348-355)[J]. ChemSusChem.,2008,1 (4):348-355. |
| [9] | Reddy A L M,Nagarajan S, Chumyim P. Lithium Storge Mechanisms in Purpurin Based Organic Lithium Ion Battery Electrodes[J]. Sci. Rep., 2012(2):960. |
| [10] | Zeng R H,Li X P, Qiu Y C. Synthesis and Properties of a Lithium-organic Coordination Compound as Lithium-inserted Materials for Lithium Ion Batteries [J]. Electrochem. Commun.,2010,12:1253-1256. |
| [11] | Liang Y L,Zhang P, Chen J. Function-oriented Design of Conjugated Carbonyl Compound Electrodes for High Energy Lithium Batteries[J]. Chem. Sci.,2013(4):1330-1337. |
| [12] | Liang Y L,Zhang P, Yang S Q. Fused Heteroaromatic Organic Compounds for High-power Electrodes of Rechargeable Lithium Batteries[J]. Adv. Energy. Mater.,2013(3):600-605. |
| [13] | 王维坤, 张勇勇, 王安邦, 等. 锂电池正极材料1,4,5,8-四羟基-9,10-蒽醌的电化学性能[J]. 物理化学学报, 2010, 26(1): 47–50. |
| [14] | Zhang Y Y,Wang W K, Wang A B,et al. Study on the 1,4,5,8-tetra hydroxyl-hexylbenzo-tetraquinone as cathode materials for lithium ion batteries [J]. 15th National Conference on Electrochemistry (Changchun),2009,B-P33. |
| [15] | Yao M,Senoh H, Sakai T. 5,7,12,14-Pentacenetetrone as a High-Capacity Organic Positive-Electrode Material for Use in Rechargeable Lithium Batteries [J]. Int. J. Electrochem. Sci.,2011(6):2905-2911. |
| [16] | Geng J Q,Bonnet J P, Renault S. Polyimides: Promising Energy-Storage Materials[J]. Angew. Chem. Int. Ed., 2010,49:8444-8448. |
| [17] | Geng J Q,Bonnet J P, Renault S. Evaluation of Polyketones with N-cyclic Structure as Electrode Material for Electrochemical Energy Storge: Case of Tetraketopiperazine unit[J]. Energy Environ. Sci.,2010(3):1929-1933. |
| [18] | Tobishima S,Yamaki J, Yamaji A. Cathode Characteristics of Organic Electron Acceptors for Lithium Batteries[J]. J. Electrochem. Soc., 1984,131 (1):57-63. |
| [19] |
Cui Y Z, Hua S N. Study on the 2,4,7-trinitro-9-fluorenone[J].
Journal of Shandong Normal University (Nature Science), 2000, 15(2): 157–161. |
| [20] | Bu P, Liu S Q,Lu Y. Effects of carbon back on the electrochemical performance of lithium-organic coordination compound batteries [J]. Int. J. Electrochem. Sci., 2012(7):4617-4624. |
| [21] | Zhao L,Wang W K, Wang A B. A MC/AQ parasitic composite as cathode material for lithium battery[J]. J. Electrochem.Soc., 2011,158:991-996. |
| [22] | Genorio B,Pirnat K, Cerc-Korosec R. Electroactive organic molecules immobilized onto solid nanoparticles as a cathode material for lithium-ion batteries[J]. Angew Chem. Int. Ed.,2010,49:7222-7224. |
| [23] | Luo C,Huang R M, Kevorkyants R,et al. Self-Assembled Organic Nanowires for High Power Density Lithium[J]. Nano. Lett., 2014, 14:1596-1602. |
| [24] | Chen H Y,Armand M, Courty M. Lithium Salt of Tetrahydroxybenzopuinone:Toward the Development of A Sustainable Li-Ion Battery[J]. J. Am Chem. Soc.,2009,131:8984-8988. |
| [25] | Wang S W,Wang L J, Zhang K,et al. Organic Li4C8H2O6 Nanosheets for Lithium-Ion Batteries [J]. Nano. Lett., 2013, 13:4404-4409. |
| [26] | Armand M,S Grugeon,Vezin H. Conjugated Dicarboxylate Anodes for Li-Ion Batteries [J]. Nat. Mater., 2009(8):120-125. |
| [27] | Renault S,Brandell D, Gustafsson T. Improving the Electrochemical Performance of Organic Li-Ion Battery Electrodes [J]. Chem. Commun., 2013,49:1945-1947. |
| [28] | Renault S,Geng J Q, Dolhem F. Evaluation of Polyketones with N-cyclic Structure As Electrochemical Energy Storage: Case of Pyromellitic Diimide Dilithium Salt[J]. Chem. Commun.,2011,47:2414-2416. |
| [29] | Kim D J,Je S H, Sampath S. Effect of N-substitution in Naphthalenediimides On the Electrochemical Performance of Organic Rechargeable Batteries [J]. Rsc. Adv.,2012,2:7968-7970. |
| [30] | Gall L T,Reiman K H, Grossel M C. Poly (2,5-dihydroxy-1,4-benzoquinone -3,6-methylene):A New Organic Polymer As Positive Electrode Material For Rechargeable Lithium Batteries [J]. J. Power Sources, 2003,119:316-320. |
| [31] | Nokami T,Matsuo T, Y Inatomi. Polymer-Bound Pyrene-4,5,9,10-Tetraone for Fast-charge and -discharge Lithium-Ion High Capacity[J]. J. Am. Chem. Soc.,2012,134:19694-19700. |
| [32] | Haringer D,Novak P, Haas O. Poly(5-amino-1,4-naphthoquinone),A Novel Lithium-Inserting Electroactive Polymer with High Specific Charge[J]. J. Electrochem. Soc., 1999,146:2393-2396. |
| [33] | Tang Z P,Xu G X. The Application of Poly(1-aminoantraquinone)for Positive Electrode Material in Lithium Secondary Battery[J]. Acta Phys.-Chim. Sin., 2003,19:307-310. |
| [34] | Song Z P,Zhan H, Zhou Y H. Anthraquinone Based Polymer As Performance Cathode Material For Rechargeable Lithium Batteries[J]. Chem. Commun.,2009,448-450. |
| [35] | Liu K, Zheng J M, Zhong G M. Poly(2,5-dihydroxy-1,4-benzoquinonyl sulfide) (PDBS) As A Cathode Material For Lithium Ion Batteries[J]. J. Mater. Chem., 2011, 21: 4125-4131. |
| [36] | 王秀军, 黄宗浩, 苏忠民, 等. 酞菁、酞菁铁及酞菁镍电子性质的理论研究[J]. 高等学校化学学报, 1997, 18(11): 1847–1850. |
| [37] | Kobayashi N. Dimers, trimers and oligomers of phthalocyanines and related compounds[J]. Coord. Chem. Rev. 2002, 227, 129-152. |
| [38] | 陈军, 王双青, 杨国强. 有机金属酞菁类化合物及其非线性光限幅特性[J]. 物理化学学报, 2015, 31(4): 595–611. |
| [39] | 刘同明, 汪福临. 碘掺杂双酞菁镥和电学性能的研究[J]. 化学学报, 1989, 47: 967–970. |
 2016, Vol. 6
2016, Vol. 6


