| 烧结气氛对无钴镍基正极材料LiNi0.7Mn0.3O2性能的影响 |
b. 江西理工大学江西省动力电池及其材料重点实验室,江西 赣州 341000
b. Jiangxi Key Laboratory of Power Battery and Materials, Jiangxi University of Science and Technology, Ganzhou 341000, China
目前储量丰富,比容量高,具有α-NaFeO2型结构的LiNiO2被认为是可替代LiCoO2[1-2]且最具发展前景的正极材料之一,但难以合成符合化学计量比且优异电化学性能的LiNiO2[3-5].钴掺杂可明显稳定其结构[6-7],但Co属稀缺、昂贵、有毒资源,研究表明,Mn掺杂可稳定LiNiO2的结构,抑制Jahn-Teller效应,减小锂镍阳离子混排[8-10],而Mn资源丰富易得,因而无钴Li(Ni1-xMnx)O2成为近年来大家共同研究的焦点材料[11-12].由于Ni2+难以氧化为Ni3+,因而在烧结过程中对气氛的要求十分苛刻,通常需要在氧气氛围下烧成[13],若Ni2+没有完全氧化成Ni3+,为了保持电荷平衡,部分Ni2+占据Li+的位置,阻碍Li+在充放电过程中正常的脱出/嵌入的通道,Li+和Ni2+混排程度增大,大大降低了其循环稳定性[14-15].但目前对烧结气氛的研究较少,且没有具体分析烧结过程中气氛条件的改变对材料性能的影响,因而寻找合理的烧结气氛对制备出电化学性能优良的无钴镍基正极材料Li(Ni1-xMnx)O2显得尤为重要.
鉴于烧结气氛对正极材料LiNi0.7Mn0.3O2性能影响的报道较少,本实验采用共沉淀法制备了前驱体Ni0.7Mn0.3(OH)2,将前驱体与LiOH·H2O均匀混合后在不同气氛条件下高温烧结,合成了无钴镍基正极材料LiNi0.7Mn0.3O2,研究烧结过程中气氛条件的变化对其性能的影响.
1 实验部分 1.1 试验样品的制备将NiSO4 ·6H2O与MnSO4·H2O按7:3的摩尔比混合均匀配制成2 mol/L金属盐溶液,将适量NH3·H2O(络合剂)与4 mol/L的NaOH混合,再将上述2种溶液分别经蠕动泵缓慢地滴加到有N2保护且匀速搅拌的反应容器中,控制溶液的温度为55 ℃,pH值在11.3附近,待金属盐溶液滴加完成后,将产物过滤,于100 ℃干燥得到形貌规则的球形Ni0.7Mn0.3(OH)2前驱体.将其按化学计量比与LiOH·H2O混合,添加适量的无水乙醇球磨4~6 h,干燥之后的混锂材料置于石英管式炉中,在不同气体条件下焙烧,合成正极材料LiNi0.7Mn0.3O2,见表 1.
| 表1 正极材料LiNi0.7Mn0.3O2烧结工艺参数 Table 1 Sintering technology parameters of LiNi0.7Mn0.3O2 cathode material |
 |
| 点击放大 |
1.2 材料的形貌及结构表征
采用德国ZEISS EVO MA10扫描电子显微镜(SEM)进行形貌分析.采用荷兰PANalytical X’Pert Pro MPD型X射线自动衍射仪(XRD)进行结构分析,测试条件为:管电压40 kV;管电流:40 mA;Cu靶Kα线,λ=0.154 06 nm;扫描速度:4°/min;扫描范围:10°~80°.采用BEE-AO-200离子流氧气分析仪对石英管出口氧气浓度进行分析监测.
1.3 电化学性能测试与表征以N-甲基吡咯烷酮(NMP)为溶剂,按质量比90:6:4将LiNi0.7Mn0.3O2粉末,乙炔黑,聚偏氟乙烯(PVDF)研磨成均匀浆状物质,并均匀地涂敷于集流体上,于120 ℃真空干燥箱中干燥12 h,辊压,分切制得350 mm×36.5 mm的正极极片,以石墨为负极,以微孔复合聚合物为隔膜,以1 mol/L LiPF6的碳酸乙烯酯(EC)+碳酸二甲酯(DMC)(体积比为1:1)为电解液,在露点不低于-28 ℃的除湿房中组装成圆柱AA全电池,采用CT2001C LAND电池测试系统对电池进行充放电循环测试,测试温度为室温,在2.75~4.35 V电压范围内以一定的倍率进行恒流充放电.采用上海辰华电化学工作站(CHI660)测试材料的交流阻抗性能(振幅5 mV,频率0.1~100 kHz).
2 结果与讨论 2.1 SEM表征图 1为共沉淀法所制备Ni0.7Mn0.3(OH)2前驱体的扫描电镜图像.
 |
| 图 1 前驱体Ni0.7Mn0.3(OH)2 SEM像 Fig. 1 SEM images of Ni0.7Mn0.3(OH)2 precursor |
图 1可以看出,前驱体Ni0.7Mn0.3(OH)2呈类球形,颗粒分布均匀,表面粗糙,分布有较多的孔隙.有利于与LiOH ·H2O充分的接触,高温焙烧时Li+充分均匀的扩散,从而更易制备出性能优异的LiNi0.7Mn0.3O2正极材料.
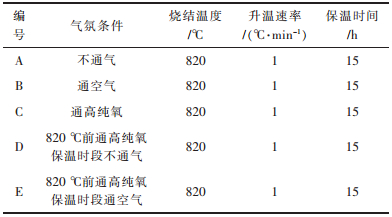
从图 2发现,不同烧结气氛合成的LiNi0.7Mn0.3O2正极材料的颗粒都是由亚微米级的一次晶粒堆积而成的二次颗粒且分布较均匀,比表面积大,有利于活性材料与电解液充分的接触从而减小极化,使得材料电化学性能提高.烧结过程中不通气(图 2(a))或通空气(图 2(b))时一次晶粒发育不完全,导致材料结晶性能较差,结构不稳定,不利于循环性能的发挥;烧结气氛为全程高纯氧(图 2(c))时一次晶粒发育较完全,堆积成二次颗粒的球形度最好,流动性好,反应活性高,材料结构稳定有利于循环性能的提高.而820 ℃前通高纯氧,保温时段不通气(图 2(d))或通空气(图 2(e))得到材料的结晶性能以及球形度都较差,其原因是晶粒发育过程中突然改变气体会破坏原本正常发育晶粒的生长环境,增大了晶粒的混乱度.
 |
| 图 2 不同气氛条件下合成正极材料LiNi0.7Mn0.3O2的SEM像 Fig. 2 SEM images of LiNi0.7Mn0.3O2 synthesized at different atmosphere |
2.2 XRD表征
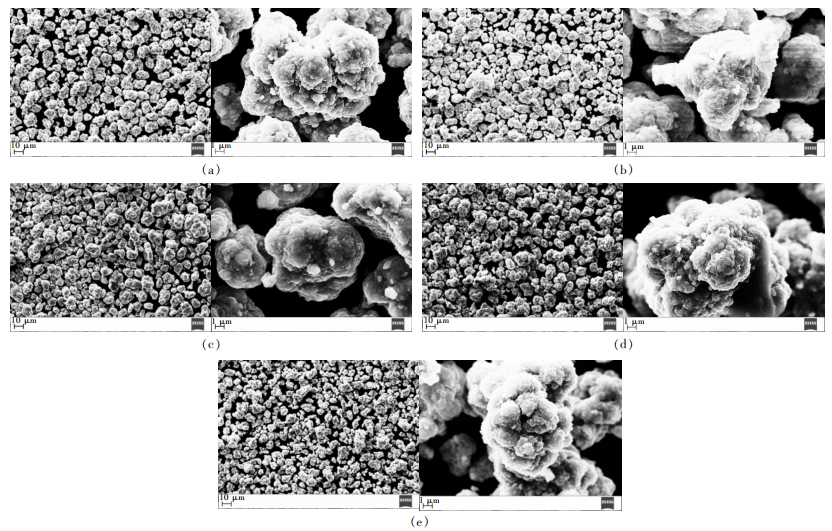
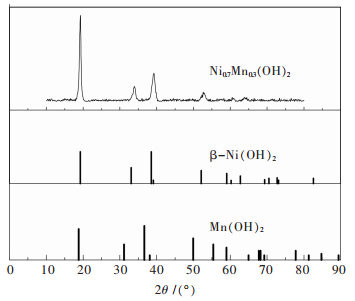
图 3为前驱体Ni0.7Mn0.3(OH)2的XRD图谱,图 4为不同烧结气氛合成正极材料LiNi0.7Mn0.3O2的XRD图谱.
 |
| 图 3 前驱体Ni0.7Mn0.3(OH)2的XRD图谱 Fig. 3 Powder XRD patterns of Ni0.7Mn0.3(OH)2 |
 |
| 图 4 不同烧结气氛合成LiNi0.7Mn0.3O2的XRD图谱 Fig. 4 Powder XRD patterns of LiNi0.7Mn0.3O2 synthesized at different atmosphere |
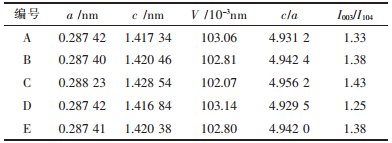
图 3看出,所制备前驱体Ni0.7Mn0.3(OH)2的XRD结果与六方晶系β-Ni(OH)2和Mn(OH)2的XRD像基本吻合,表明其具有明显的层状结构,Mn2+进入了Ni(OH)2结构中,使2种金属离子处于原子水平的混合. 图 4看出,不同气氛条件下合成的样品均具有典型的α-NaFeO2型层状结构.晶体层状二维结构的有序程度可用2对特征峰(006)/(102)以及(108)/(110)的分裂程度来表示.当烧结过程中全程通高纯氧时,这2组峰分裂最明显,表明材料结晶较完全.据文献[16-18]报道,当晶格常数c/a > 4.9以及(003)峰与(104)峰的峰强比I003/I104 > 1.2时,镍酸锂系化合物阳离子混排程度最小,具有较好的层状结构,同时也表现出良好的电化学性能.由表 2可看出,烧结全程通高纯氧的c/a值和I003/I104值最大且晶胞体积最小,表明材料晶体结构发育完整,阳离子混排程度较小,层状二维有序化程度较高.而升温到820 ℃时段通高纯氧保温时段不通气或通空气所制备材料的c/a值和I003/I104值要比所对应的全程不通气或通空气小,表明烧结过程中气氛的改变会使得材料晶体的发育突然发生转变,从而增加阳离子混排程度,降低其电化学性能.
| 表2 不同烧结气氛合成试样的晶体结构参数 Table 2 Crystal structure parameters of synthetic samples synthesized at different atmosphere |
 |
| 点击放大 |
2.3 氧气浓度表征
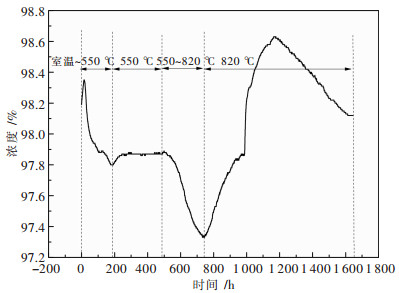
图 5为LiOH·H2O和Ni0.7Mn0.3(OH)2的混合物在烧结过程中,炉膛的氧气浓度随时间变化曲线图.
 |
| 图 5 烧结过程中氧气浓度随时间变化曲线 Fig. 5 Oxygen concentration changing with time in the sintering process |
图 5可看出,室温~550 ℃阶段氧气浓度逐渐减小,此阶段对应LiOH·H2O和Ni0.7Mn0.3(OH)2的氧化分解生成大量水蒸气,氧气浓度减小;550 ℃保温阶段氧气浓度基本没有变化,说明此过程没有明显的其他相的生成;550~820 ℃升温阶段氧气浓度出现明显的减小,表明此过程需要大量的吸收氧气,使Ni2+向Ni3+充分的转变;在820 ℃保温阶段氧气浓度先增大后减小,表明在大量吸收氧之后晶体发育不再明显的吸收氧,但保温一段时间后再一次出现明显吸收氧气的过程,目的是将剩余的Ni2+氧化为Ni3+,这也就是820 ℃前通高纯氧之后的保温阶段不通气或通空气得到材料的电化学性能的不佳的原因.
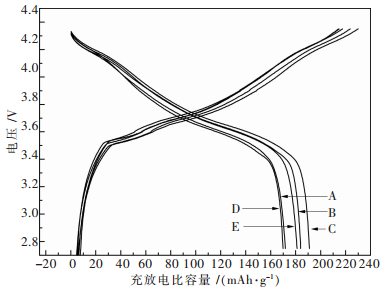
2.4 电化学性能表征不同烧结气氛得到的LiNi0.7Mn0.3O2制备成AA圆柱电池,在室温条件下,恒流充电分3步完成,首先10 mA电流将其充电到3.6 V,再20 mA充电到3.9 V,最后30 mA充电到4.35 V,静置5 min后以30 mA电流放电到2.75 V,首次充放电曲线如图 6所示.显然,5种试样在3.75 V附近和4.10 V附近都存在2个充放电平台,比纯相LiNiO2少了在4.20 V附近可逆性小的菱面体相H2与H3的相变[19-20],从而减小了LiNi0.7Mn0.3O2不可逆容量,增强了材料的循环稳定性. 图 6可看出,在不同烧结气氛条件下(A、B、C、D、E)的首次放电比容量分别为171.8 mAh/g、184.0 mAh/g、191.0 mAh/g、169.9 mAh/g、181.1mAh/g,对应的库仑效率为76.8 %、85.9 %、87.8 %、73.9 %、84.3 %,显然是烧结全程通高纯氧(编号C)制备的LiNi0.7Mn0.3O2具有最高的放电比容量和库伦效率.
 |
| 图 6 不同烧结气氛下LiNi0.7Mn0.3O2首次充放电曲线 Fig. 6 First charge/discharge curves of LiNi0.7Mn0.3O2 sintering at different atmosphere |
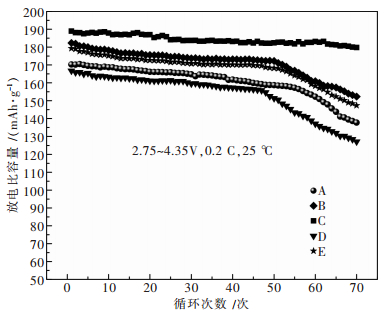
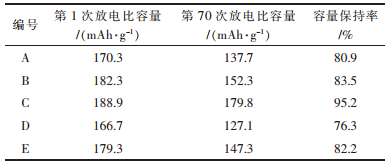
从图 7和表 3中看出,烧结气氛对材料的电性能有较大影响,820 ℃前通高纯氧,保温时段改变气氛(编号B和编号E)比烧结全程为同一气氛条件(编号A和编号D)所合成材料的首次放电比容量以及70周后的容量保持率比全程不通气要小,表明烧结过程中改变气氛条件会破坏晶体正常发育,不利于其电化学性能.同一气氛条件下,烧结全程通高纯氧时,LiNi0.7Mn0.3O2第1次循环放电比容量达到188.9 mAh/g,70周后容量保持率为95.2 %,烧结全程通空气表现出的电性能较之稍差但比全程不通气要好.由此可见,在全程通高纯氧条件下合成的产物具有高的比容量以及良好的循环稳定性,这归因于全程高纯氧更有利于材料中的Ni氧化为+3,可保证晶体完整的发育,从而其具有高的比容量以及良好的循环性能.
 |
| 图 7 不同烧结气氛下LiNi0.7Mn0.3O2比容量衰减曲线 Fig. 7 Cycle performance of LiNi0.7Mn0.3O2 synthesized at different atmosphere |
| 表3 不同烧结气氛下的LiNi0.7Mn0.3O2电化学性能 Table 3 Electrochemical performance of LiNi0.7Mn0.3O2 synthesized at different atmosphere |
 |
| 点击放大 |
2.5 交流阻抗(EIS)表征
图 8为不同烧结气氛条件下正极材料LiNi0.7Mn0.3O2经0.2 C循环5次并充电至4.05 V后所做的交流阻抗谱.EIS的高频半圆与锂离子通过正极材料颗粒表面钝化膜(SEI膜)的扩散迁移有关,称为SEI膜电阻,中频区半圆与电荷迁移相关,称为传荷电阻.图 8表明,不同烧结气氛条件下LiNi0.7Mn0.3O2的SEI膜电阻没有差别,而传荷电阻有明显的差别,具体表现为烧结全程通高纯氧(编号C)的传荷电阻最小,其库仑效率最高也就得到了证实.
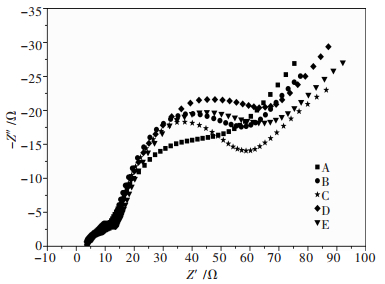 |
| 图 8 不同烧结气氛条件下LiNi0.7Mn0.3O2的交流阻抗谱(EIS) Fig. 8 EIS spectra of LiNi0.7Mn0.3O2 synthesized at different atmosphere |
3 结论
烧结气氛对正极材料LiNi0.7Mn0.3O2性能的影响很显著,烧结过程气氛条件的改变对颗粒晶体发育不利,全程通同一气体会使得材料电化学性能更稳定,有利于离子有序化程度的增强.由于LiNi0.7Mn0.3O2在600~820 ℃和820 ℃保温后期存在2次明显吸氧的过程,而O2可促使Ni2+向Ni3+的转变,因此全程通高纯氧制备材料的离子高度有序,循环性能稳定,电阻小.
| [1] |
Zhong S W, Zhao Y J, Lian F, et al. Characteristics and electrochemical performance of cathode material Co -coated LiNiO2 for Li-ion batteries[J].
Transactions of Nonferrous Metals Society of China, 2006, 16(1): 137–141. DOI: 10.1016/S1003-6326(06)60024-1. |
| [2] | 梅佳, 钟盛文, 张骞, 等. 高性能LiCoO2的制备与性能表征[J]. 电源技术, 2007, 31(2): 128–130. |
| [3] |
Lu C H, Lee W C. Reaction mechanism and kinetics analysis of lithium nickel oxide during solid-state reaction[J].
Journal of Materials Chemistry, 2000, 10(6): 1403–1407. DOI: 10.1039/a909130k. |
| [4] |
Schoonman J, Tuller H L, Kelder E M. Defect chemical aspects of lithium-ion battery cathodes[J].
Journal of power sources, 1999, 81: 44–48. |
| [5] |
Moshtev R, Zlatilova P, Vasilev S, et al. Synthesis, XRD characterization and electrochemical performance of overlithiated LiNiO2[J].
Journal of power sources, 1999, 81: 434–441. |
| [6] |
Delmas C, Menetrier M, Croguennec L, et al. An overview of the Li (Ni, M) O2 systems: syntheses, structures and properties[J].
Electrochimica Acta, 1999, 45: 243–253. DOI: 10.1016/S0013-4686(99)00208-X. |
| [7] | 刘欣艳, 赵煜娟, 李燕, 等. Al, Co和Mn掺杂对LiNiO2结构的影响[J]. 无机化学学报, 2006, 22(6): 1007–1012. |
| [8] |
Rossen E, Jones C D W, Dahn J R. Structure and electrochemistry of LixMnyNi1-yO2[J].
Solid State Ionics, 1992, 57(3): 311–318. |
| [9] |
Hirano A, Kanno R, Kawamoto Y, et al. Neutron diffraction study of LiNi0.8Mn0.2O2[J].
Journal of Solid State Chemistry, 1997, 134(1): 1–4. DOI: 10.1006/jssc.1997.7505. |
| [10] |
Caurant D, Baffler N, Bianchi V, et al. Preparation by a 'chimie douce' route and characterization of LiNizMn1-zO2 (0.5≤z≤1) cathode materials[J].
Journal of Materials Chemistry, 1996, 6(7): 1149–1155. DOI: 10.1039/JM9960601149. |
| [11] |
Sun Y K, Lee D J, Lee Y J, et al. Cobalt-free nickel rich layered oxide cathodes for lithium-Ion batteries[J].
ACS Applied Materials & Interfaces, 2013, 5(21): 11434–11440. |
| [12] |
Mohanty D, Paudel P, Gabrisch H. Microstructure and magnetic behavior of compounds in the solid solution system Li[Ni1-xMnx]O2 (x=0.3, 0.5, 0.7)[J].
Solid State Ionics, 2010, 181(19): 914–920. |
| [13] |
Lee Y S, Sun Y K, Nahm K S. Synthesis and characterization of LiNiO2 cathode material prepared by an adiphic acid -assisted sol-gel method for lithium secondary batteries[J].
Solid State Ionics, 1999, 118(1): 159–168. |
| [14] | 郭炳昆, 徐徽, 王先友, 等. 锂离子电池[M]. 长沙: 中南大学出版社 , 2002: 1-30. |
| [15] | 刘万民, 胡国荣, 彭忠东, 等. 加压氧化法制备LiNi0.8Co0.15Al0.05O2正极材料[J]. 中国有色金属学报, 2013(1): 133–140. |
| [16] |
Zhang S, Deng C, Yang S Y, et al. An improved carbonate co-precipitation method for the preparation of spherical Li[Ni1/3Co1/3Mn1/3]O2 cathode material[J].
Journal of Alloys and Compounds, 2009, 484(1/2): 519–523. |
| [17] |
Wang G X, Zhong S, Bradhurst D H, et al. Synthesis and characterization of LiNiO2 compounds as cathodes for rechargeable lithium batteries[J].
Journal of Power Sources, 1998, 76(2): 141–146. DOI: 10.1016/S0378-7753(98)00153-0. |
| [18] |
Moshtev R V, Zlatilova P, Manev V, et al. The LiNiO2 solid solution as a cathode material for rechargeable lithium batteries[J].
Journal of Power Sources, 1995, 54(2): 329–333. DOI: 10.1016/0378-7753(94)02094-J. |
| [19] |
Megahed S, Scrosati B. Lithium -ion rechargeable batteries[J].
Journal of Power Sources, 1994, 51(1): 79–104. |
| [20] |
Song M Y, Lee D S, Park H R. Electrochemical properties of LiNi1-yTiyO2 and LiNi0.975M0.025O2 (M=Zn, Al, and Ti) synthesized by the solid-state reaction method[J].
Materials Research Bulletin, 2012, 47(4): 1021–1027. DOI: 10.1016/j.materresbull.2012.01.003. |
 2015, Vol. 6
2015, Vol. 6


