| P25 TiO2光催化降解中低浓度氨氮废水 |
2. 江西省矿冶环境污染控制重点实验室, 江西 赣州 341000;
3. 南方离子型稀土资源开发及应用省部共建重点实验室, 江西 赣州 341000
2. Jiangxi Key Lab of Mining & Metallurgy Environmental Pollution Control, Ganzhou 341000, China;
3. Key Development and Application Lab for Southern China's Ion-adsorption Rare Earth, Ganzhou 341000, China
随着社会经济发展及人类活动加剧,地球上有限的水资源日益受到环境污染的严重威胁.工业排放的氨氮废水是造成水体污染的主要途径之一.近年来,赣南地区随稀土矿的大量开发,产生大量氨氮废水,污染日益严重.水环境中存在过量的氨氮会造成多方面的有害影响,氨氮废水的处理已经引起广泛关注[1-3].对于中低浓度氨氮废水处理,应用较多的方法有化学沉淀法,吹脱法,吸附法等[4-5];化学沉淀法是通过向废水中投加某种化学药剂,使之与废水中的某些溶解性污染物质发生反应,形成难溶盐沉淀下来,从而降低水中溶解性污染物浓度的方法[5-6];吹脱法一般都要采用NaOH调节废水的pH值,药剂和能源消耗比较大;利用吹脱技术处理氨氮还要注意回收由液相转移至气相后的氨氮,否则会导致大气的二次污染.吸附法是利用离子交换剂上可交换离子与NH4+间发生交换和吸附作用下,吸收NH3分子达到去除水中的氨,这是一个可逆的过程,此法中离子交换吸附剂廉价易得且可再生循环使用,但存在的主要问题是交换容量有限,解析频繁,为了增加其容量需进行改性处理,故该法一般需要与其他方法联用或者作为深度处理的一部分[4-6].
光催化氧化技术是一种绿色、高效、低能耗的水处理技术,在目前广泛的光催化剂中,二氧化钛其无毒、价廉、稳定、高效、无二次污染等优点因被广泛研究应用.其中纳米二氧化钛P25已经实现了工业化生产[7-8].
P25纳米TiO2属于混晶型,金红石和锐钛矿的质量比约为1:4,混晶可以增大TiO2的晶格内缺陷,使电子与空穴对数量增加,光催化性能增加[9].本文选择了氨氮废水的光催化降解为模型反应,测试了P25纳米晶的光催化性能,考察了降解体系的pH值和外加氧化剂H2O2等因素对降解效果的影响.在适宜酸度和汞灯的照射下,P25纳米晶能够有效地光催化降解氨氮废水.本文采用光催化氧化法处理中低浓度氨氮废水,旨在为中低浓度氨氮废水处理提供新的思路.
1 材料与方法 1.1 实验材料本实验中,主要试剂材料为氯化铵(分析纯)[天津市大茂化学试剂厂]和P25(德固赛,比表面积50±15 mg/L,平均粒径21 nm)[广州市禾英贸易有限公司];主要实验仪器有XPA-7型光化学反应仪[南京胥江机电厂],UV-2100型分光光度计[尤尼柯(上海)仪器有限公司].
1.2 实验方法配制模拟氨氮废水100 mg/L,取10 mL先置于光反应仪内避光搅拌10 min,再打开500 W汞灯,取样,离心,用纳式试剂分光光度计法(HJ535-2009)测定其吸光度,氨氮去除率通过式(1)计算.考察P25用量、pH值、不同初始浓度及外加氧化剂H2O2、水体中各种阴阳离子Cl-、HCO3-、NO3-、SO42-、Na+、K+、Ca2+、Mg2+对氨氮废水的处理效果以及最佳反应条件.
氨氮去除率公式:
| $ R = [({C_0}-C)]/{C_0} \times 100\% $ | (1) |
式(1)中:R:氨氮去除率,%;C0:反应前的氨氮浓度,mg/L;C:反应一定时间后的氨氮浓度,mg/L.
2 结果与讨论 2.1 催化剂的表征 2.1.1 催化剂的UV-vis DRS表征结果本实验采用日本岛津公司出产的UV-2550型的紫外-可见分光光度仪测定,以标准BaSO4粉末为参比,扫描范围为200~800 nm,采样间隔为0.5 nm,于室温下进行测定.文献[8]指出光催化材料的光催化活性与该材料受光诱导后产生的光电子和光空穴的转移有关.而光催化材料的这种特性则与材料的电子结构有密切的关系.将其代入方程式(2)[8]计算光催化剂的禁带宽度:
| $ {E_g} = hc/{\lambda _0} = 1240/{\lambda _0} $ | (2) |
式(2)中:λ0为最大吸收波长;Eg为禁带宽度.
做最陡坡面的切线图,见图 1,切线与纵坐标为0处的横坐标的交点得λ0,λ0=400.7 nm代入式(2)中,得出P25的禁带宽度为3.09 eV.
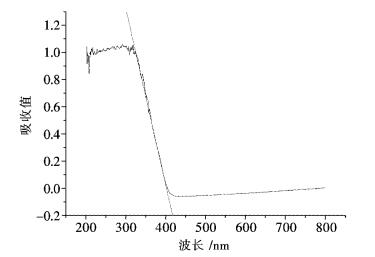 |
| 图 1 UV-vis DRS图谱 Fig. 1 UV-vis DRS atlas |
2.1.2 催化剂的BET表征结果
为了测试P25的比表面积,利用氮吸附性能,采用JW-004A型BET氮吸附比表面仪对标准焦黑与P25作对比,得出P25的比表面积为48.109 6 g/m2.与商家给定结果一致.
2.2 不同pH对P25降解氨氮废水的影响实验方法如1.2所述,改变溶液初始的pH值分别为8.1、9.0、10.1、11.2,P25的投加浓度为1 g/L,不同pH值下的氨氮溶液对P25的降解效果的影响随时间的变化关系如图 2所示.
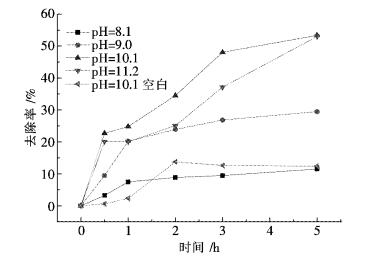 |
| 图 2 pH值对P25的降解氨氮废水的影响 Fig. 2 Influence of pH on degradation of ammonia nitrogen wastewater of P25 |
溶液的初始pH将会影响P25表面所带电荷的性质和氨氮在水中的存在状态,从而影响氨氮的去除效果.在500 W紫外光照射下,P25用量为1 g/L,对100 mg/L氨氮废水进行处理,在不同的pH值下反应5 h测定NH3-N的去除率.由图 2可知,随着pH值的逐渐增大,氨氮的去除率也不断地提高.随着pH值的逐渐增大,OH-的数量会增加,生成的·OH增加,氨氮的去除率也随之增大.同时,氨氮在水体中以NH3·H2O和NH4+ 2种状态存在,随着pH值升高,溶液中NH3·H2O分子所占比例增大,在搅拌过程中,有一部分NH3·H2O分子被空气吹脱出来,进而提高了氨氮的去除率.在pH=10.1时,氨氮的去除率达到了53 %;在pH=11.2时,氨氮的去除率达到了53.4 %;比较pH=10.1与pH=10.1(空白)所以催化剂占主导地位;是因为当pH≥10.1以后,氨氮主要以NH3存在,由于TiO2的表面是带负电荷的,利于空穴由颗粒内部到表面与NH4+的吸附,且界面附近过量的OH-,会有利于·OH的生成.同时,NH3比NH4+的空间位阻小,更加有利于·OH进攻NH3的反应,从而反应效率迅速提高[10].考虑到在pH=10.1和pH=11.2时氨氮的去除率相差不大,且过高的pH产生过多的OH-也不利于催化反应的进行[11-12].增大溶液的pH值将会增加实验的成本,故试验过程中取pH=10.1.由于在反应初始的10 min先进行了避光搅拌实验,开灯降解时已经达到吸附平衡,故开灯降解后比较迅速.在pH≥9时,前30 min降解率更为显著,是由于催化剂本身还具有的吸附作用,实验在pH值为10.1时在使用催化剂不光照的前提下,前30 min降解率达到10.4 %,之后几乎处于动态平衡状态.
2.3 不同P25的投加量对氨氮废水降解的影响实验方法如1.2所述,氨氮溶液的pH调制10.1,改变P25的投加量,使其投加量分别为0.5 g/L、1 g/L、1.5 g/L、2 g/L、2.5 g/L、3 g/L.不同P25的投加量对氨氮溶液降解随时间的变化关系如图 3所示.
 |
| 图 3 P25投加量对氨氮溶液降解影响 Fig. 3 Influence of dosage of P25 solution on ammonia nitrogen degradation effects |
图 3结果表明,在试验条件下,随着P25用量的增加,对氨氮的降解有显著的作用.当P25的用量达到0.5 g/L时,处理5 h氮的去除率最高,达到了56.0 %;再增加P25的用量,氨氮去除率反而会降低.其主要原因是在一定波长紫外光照射下,催化剂用量越大,空穴-电子对越多,进而增加强氧化剂·OH的产量,从而提高反应效率,提高了氨氮的去除率.但当P25的用量过高时,降低了水的透光性,在散射和屏蔽作用的双重影响下,降低对紫外光的利用率,使空穴-电子对数量降低[10-11],因而影响反应效率.
2.4 P25对不同浓度的氨氮溶液的降解的影响将氨氮溶液的pH值调制10.1,P25的投加量为0.5 g/L.改变氨氮溶液的起始浓度使其分别为25 mg/L、50 mg/L、75 mg/L、100 mg/L.实验方法如1.2所述,P25对不同浓度的氨氮废水降解随时间的变化关系如图 4所示.
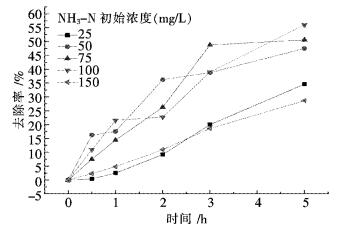 |
| 图 4 不同氨氮初始浓度的降解 Fig. 4 Influence of initial concentration on degradation of ammonia nitrogen wastewater |
从图 4中可以看出,在完全相同的试验条件下,随废水中氨氮初始浓度提高,光催化降解的效果呈先上升后下降的趋势.这是由于过高的氨氮浓度不利于·OH的产生,在处理5 h时氨氮初始浓度为25 mg/L时去除率达到50 %,当氨氮初始浓度为100 mg/L时,去除率达到了56 %.这说明针对不同浓度,甚至是中低浓度的氨氮废水具有一定的去除率.
2.5 不同H2O2加入量对氨氮溶液的降解效果的影响将氨氮溶液100 mg/L的pH值调制10.1,P25的投加量为0.5 g/L.在氨氮溶液中分别加入0.01 mmol/L、0.1 mmol/L、0.5 mmol/L、2 mmol/L、10 mmol/L的H2O2.实验方法如1.2所述,加入不同的H2O2对氨氮废水降解随时间的变化关系如图 5所示.
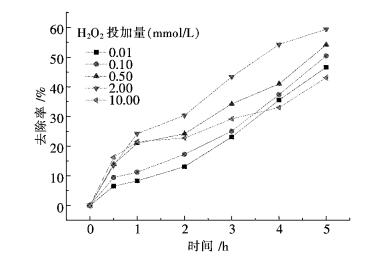 |
| 图 5 不同H2O2对氨氮溶液降解的影响 Fig. 5 Influence of H2O2 on degradation of ammonia nitrogen wastewater |
从图 5中可以看出,在完全相同的试验条件下,随废水中H2O2加入量的增多,光催化降解的效果呈先上升后下降的趋势.在处理5 h时H2O2加入量为2 mmol/L时去除率达到59.4 %,当H2O2加入量为10 mmol/L时,去除率达到了33.0 %.这是因为H2O2作为一种强氧化剂,可以有效地捕获TiO2导带上的光生电子,从而使电子和空穴分离,产生·OH[10-13],同时在光的照射下,H2O2本身也能分解产生·OH.然而随着H2O2加入量的继续增加,NH3-N的去除率降低.这是由于H2O2过高时,会发生如下反应:
| $ {{\rm{H}}_2}{{\rm{O}}_2} + \cdot {\rm{OH}} \to {{\rm{H}}_2}{\rm{O}} + \cdot {\rm{H}}{{\rm{O}}_2} $ | (3) |
| $ {\rm{H}}{{\rm{O}}_2} + \cdot {\rm{OH}} \to {{\rm{H}}_2}{\rm{O}} + {{\rm{O}}_2} $ | (4) |
因此,H2O2浓度过高时,·OH会减少,影响光催化效率说明针对不同H2O2加入量,P25对氨氮溶液的去除率先上升后下降.
2.6 加入不同离子对氨氮溶液的降解影响在500 W紫外光照射下,P25用量为0.5 g/L,调节氨氮溶液的pH,使pH=8.3,因为在一定的碱性条件下Ca2+、Mg2+会产生白色沉淀,当pH值小于等于8.4时均无沉淀产生.Na+,K+,Ca2+,Mg2+,Cl-,SO42-,NO3-,HCO3-各加入10 μg/mL,对初始浓度为100 mg/L的氨氮溶液进行处理,测定NH3-N的去除率,考察水体中各种阴阳离子对氨氮去除效果的影响,结果如图 6、图 7所示.
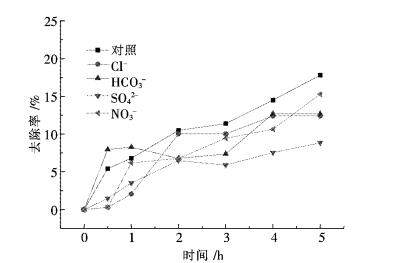 |
| 图 6 不同阴离子对氨氮废水降解效果的影响 Fig. 6 Influence of different anions on degradation of ammonia nitrogen wastewater |
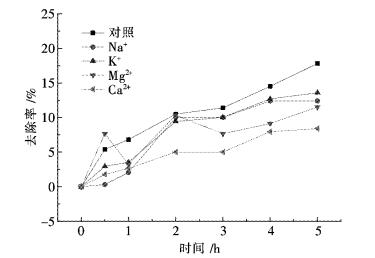 |
| 图 7 不同阳离子对氨氮废水降解效果的影响 Fig. 7 Influence of different cations on degradation of ammonia nitrogen wastewater |
从图 6、图 7中可以看出,在完全相同的试验条件下,水体中各种阴阳离子对光催化氧化有明显的抑制作用.因为HCO3-具有很强的·OH清除作用,Cl-、SO42-对·OH的捕获作用是导致P25光催化降解速率有所下降的主要原因[14-19],NO3-对紫外光的吸收起着一种惰性滤层作用,会降低光吸收,进而降低体系中·OH的浓度从而导致光催化作用减弱;Mg2+、Ca2+电荷较高,吸引电子能力较强阻碍了体系中活性O2自由基的形成[17-18];Na+、K+对催化活性影响较Ca2+,Mg2+的小,因为Na+、K+已是最高氧化态,不具有变价,不能捕获自由基和空穴,在反应体系的pH下,不会生产氢氧化物因此也不太可能沉积在表面上[19-20],所以影响较小.
3 结论1)使用P25光催化降解模拟100 mg/L氨氮废水,得出初始溶液pH=10.1,光照500 W,P25用量为0.5 g/L为最佳条件,在反应5 h后氨氮去除率可达到56 %.
2)在pH,P25投加量一定的条件下,添加2 mmol/L的H2O2为最适添加量,当反应5 h后可促进降解,使氨氮去除率达到59.4 %.
3)水体中常见阴阳离子Na+,K+,Ca2+,Mg2+,Cl-,SO42-,NO3-,HCO3-对于P25降解氨氮具有一定的抑制作用.
4)对不同的氨氮初始浓度进行测定,得出P25光催化剂比较适合处理中低浓度的氨氮废水.
| [1] | 李琰, 吕静, 李春静, 等. 沸石负载TiO2光催化剂的制备及光催化降解染料废水的研究[J]. 工业水处理, 2013, 33(10): 56–58. |
| [2] | 张安龙, 张佳. 低浓度氨氮废水处理技术进展[J]. 纸和造纸, 2011, 30(8): 60–64. |
| [3] |
Yu H G, Xu L L, Wang P, et al. Enhanced photoinduced stability and photocatalytic activity of AgBr photocatalyst by surface modification of Fe (III) cocatalyst[J].
Applied Catalysis B, 2014, 144: 75–82. DOI: 10.1016/j.apcatb.2013.06.023. |
| [4] | 赖华, 罗仙平, 张燕, 等. 树脂对稀土冶炼废水氨氮的吸附及动力学研究[J]. 有色金属科学与工程, 2012, 3(5): 74–77. |
| [5] | 罗仙平, 张艳, 邓扬悟, 等. 几种常见离子交换材料在氨氮废水处理中的应用[J]. 有色金属科学与工程, 2012, 3(6): 51–54. |
| [6] | 罗仙平, 李健昌, 严群, 等. 处理低浓度氨氮废水吸附材料的筛选[J]. 化工学报, 2010(1): 216–222. |
| [7] |
Eiden-Assmann S, Widoniak J, Maret G. Synthesisand characterization of porous and nonporous monodisperse colloidal TiO2 particles[J].
Chemistry of Materials, 2004, 16(1): 6–11. DOI: 10.1021/cm0348949. |
| [8] |
Tang Y N, Di W H, Zhai X S, et al. A study on upconversion UV-vis-NIR responsive photocatalytic activity and mechanisms of hexagonal phase NaYF4:Yb3+, Tm3+@TiO2 core-shell structured photocatalyst[J].
Applied Catalysis B, 2014, 144: 379–385. DOI: 10.1016/j.apcatb.2013.07.035. |
| [9] |
Vojka Z, Marija V, Sreco D S, et al. Photocatalytic properties of TiO2 and TiO2/Pt: A sol-precipitation, sonochemical and hydrothermal approach[J].
Ultrasonics Sonochemistry, 2014, 21: 367–375. DOI: 10.1016/j.ultsonch.2013.05.018. |
| [10] | 李元昊, 丁忠浩, 陶晓明, 等. 油田氨氮废水的纳米TiO2光催化处理[J]. 湖北农业科学, 2013, 52(21): 5186–5188. |
| [11] | 王春英, 江桐桐, 周丹, 等. 掺铁钨酸铋的制备及光催化降解罗丹明B的研究[J]. 江西理工大学学报, 2013, 34(1): 7–12. |
| [12] |
Ma Y, Qiu J, Cao Y, et al. Photocatatytic activity of TiO2 films grown on different substrates[J].
Chemosphere, 2001, 44(5): 1087–1092. DOI: 10.1016/S0045-6535(00)00360-X. |
| [13] | 刘佳, 龙天渝, 陈前林, 等. Cu/La共摻杂TiO2光催化氧化水中的氨氮[J]. 环境工程学报, 2013(2): 457–462. |
| [14] | 黄兵华, 张晓飞, 宋磊, 等. TiO2光催化水处理技术综述[J]. 水处理技术, 2014(3): 11–17. |
| [15] | 王文超, 管俊芳, 严春杰, 等. 斜发沸石处理氨氮废水[J]. 环境工程学报, 2014, 8(3): 1036–1042. |
| [16] |
Fu H, Pan C, Yao W, et al. Visible-light-induced degradation of Rhodamine B by nanosized Bi2WO6[J].
Journal of Physical Chemistry B, 2005, 109(47): 22432–22439. DOI: 10.1021/jp052995j. |
| [17] |
Wang J, Tafen D N, Lewis J P, et al. Origin of photocatalytic activity of nitrogen-doped TiO2 nanobelts[J].
Journal of the American Chemical Society, 2009, 131(34): 12290–12297. DOI: 10.1021/ja903781h. |
| [18] |
Nakamura R, Okamoto A, Osawa H, et al. Design of all-inorganic molecular-based photocatalysts sensitive to visible light:Ti (IV)-O-Ce (III) Bimetallie assemblies on Mesoporous silica[J].
Journal of the American Chemical Society, 2007, 129(31): 9596–9597. DOI: 10.1021/ja073668n. |
| [19] | 任学昌, 陈学民, 赵昊星, 等. 水体中常见无机阴离子对TiO2光催化降解的影响[J]. 环境工程学报, 2008(10): 1339–1344. |
| [20] | 任学昌, 陈学民, 赵昊星, 等. 水体中常见无机阳离子对TiO2光催化降解的影响[J]. 水处理技术, 2009(9): 73–76. |
 2016, Vol. 6
2016, Vol. 6

