| CuO-CO2-NH3-H2O体系孔雀石浸出的热力学分析 |
b. 江西理工大学,应用科学学院,江西 赣州 341000
b. College of Applied Science, Jiangxi University of Science and Technology, Ganzhou 341000, China
铜是重要的有色金属,在国民经济和国防军工诸多领域有着广泛用途.我国铜资源紧缺,随着国民经济的快速发展,铜的供需矛盾将更为突出[1].铜矿物资源分为硫化铜矿和氧化铜矿2类.其中,硫化铜矿易于选别和富集,冶炼成本较低,长期以来作为主要炼铜原料被大量消耗;氧化铜矿中铜主要以孔雀石Cu2CO3(OH)2、蓝铜矿Cu3(CO3)2(OH)2、黑铜矿CuO等形态存在,其难以富集成高品位精矿,只能得到含大量脉石的低品位铜矿,其脉石有SiO2、CaO、MgO和Al2O3等成分[2-4].湿法浸出低品位铜矿可在酸性溶液或碱性含氨溶液中进行,其中酸浸工艺研究和应用较多,适合处理碱性脉石含量低的铜矿.由于氨与重金属离子有较强配位作用,且与大部分脉石成分无作用或作用微弱,所以氨浸工艺能选择性将铜及伴生重金属浸出,适合处理低品位尤其是碱性脉石含量高的铜矿.我国云南、内蒙古、新疆、四川等地拥有相当规模的高碱性脉石氧化铜矿,为缓解我国铜资源紧缺的形势,不少学者开展了氨浸工艺处理高碱性脉石铜矿的研究[5-11].在热力学方面,王玺等利用GEMS-PSI程序,采用Gibbs自由能最小化算法,研究了铜氧化物在NH3-NH4Cl-H2O体系的溶解度及组元行为[12].刘维等基于质量平衡和电荷平衡,计算了铜氧化物在不同氨和氯化铵浓度溶液中的溶解行为[13].上述研究均有实验验证,铜溶解度计算数据与实验数据大体一致.目前,已有热力学研究着重考察反应前初始溶液的铵、氨浓度对铜溶解度的影响.本文认为,pH值对体系热力学平衡起决定性作用,总氮浓度一定的情况下,铵氨比本质上取决于pH值.另外,浸出过程并非封闭体系理想状态,脉石溶解、氨挥发或二氧化碳溶解等因素都可能导致溶液pH值变化,从而改变体系的平衡状态.因此,拟选取pH值为变量研究CuO-CO2-NH3-H2O体系中铜氧化物的溶解性,并着重考察平衡后溶液状态对铜溶解度的影响,得出预测性结果,为工业实践提供参考.
1 热力学数据的选取CuO-CO2-NH3-H2O体系涉及的沉淀物和配合物种类较多,本文优先选取2007年IUPAC Technical Report中引用和推荐的热力学数据,体系可能发生的化学反应及其平衡关系式列于表 1.对于多元复杂溶液体系,缺少有效方式获取各离子的活度系数,因而,本文的计算均以浓度代替活度.
| 表1 CuO-CO2-NH3-H2O体系可能存在的化学反应及其平衡关系式(25 ℃) |
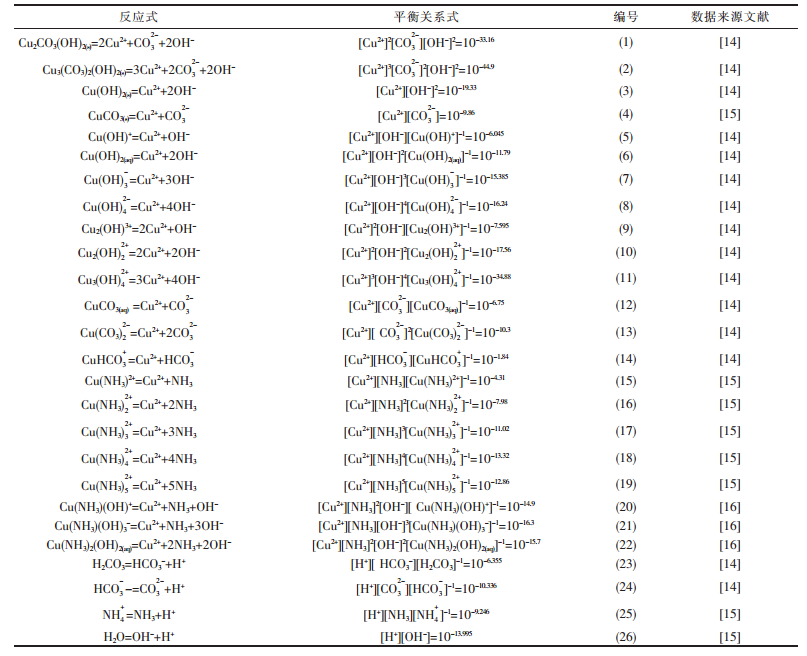 |
| 点击放大 |
2 CuO-CO2-NH3-H2O体系的热力学计算
CuO-CO2-NH3-H2O体系中,游离铜、氮和碳的存在形态有:Cu2+、Cu(OH)+、Cu(OH)2(aq)、Cu(OH)3-、Cu(OH)42-、Cu2(OH)3+、Cu2(OH)22+、Cu3(OH)42+、Cu(NH3)2+、Cu(NH3)22+、Cu(NH3)32+、Cu(NH3)42+、Cu(NH3)52+、Cu(NH3)(OH)+、Cu(NH3)(OH)3-、Cu(NH3)2(OH)2(aq)、NH3、NH4+、CuCO3(aq)、Cu(CO3)22-、CuHCO3+、CO32-、HCO3-、和H2CO3(aq).孔雀石与溶液平衡后,当体系中固体只有孔雀石而无其它沉淀生成时,进入溶液的铜和碳均由孔雀石提供,溶液中总铜浓度[Cu]T和总碳浓度[C]T之比应等于孔雀石铜与碳的化学计量比,则有:
| $ {{\rm{[Cu]}}_{\rm{T}}}:{{\rm{[C]}}_{\rm{T}}}{\rm{ = 2:1}} $ | (27) |
根据同时平衡原理,此时,溶液中各游离组分满足式(1)、式(5)~式(27).
一定条件时,孔雀石可能转变为蓝铜矿、碳酸铜或氢氧化铜.在孔雀石转变为蓝铜矿的边界pH值时,溶液中各游离组分满足式(1)、式(2)、式(5)~式(27);在孔雀石转变为碳酸铜的边界pH值时,溶液中各游离组分满足方程式(1)、式(4)、式(5)~式(27);在孔雀石转变为氢氧化铜的边界pH值时,溶液中各游离组分满足式(1)、式(3)、式(5)~式(27).酸性条件时,溶液中碳主要以碳酸的形态存在,碳酸易分解为二氧化碳和水,使溶液难以维持一定的总碳浓度;另一方面,在强碱性溶液中,游离氨易挥发,使溶液难以维持一定的总氮浓度,因此,本文热力学计算主要研究弱酸性至弱碱性pH值范围的热力学问题.
根据以上平衡关系,可算得不同总氮浓度[N]T下孔雀石与溶液平衡后沉淀物的优势区图,如图 1.由图 1可见,OH-浓度对沉淀的形态有重要影响,随着pH值升高,OH-取代CO32-参与沉淀的形成,使稳定存在的固体按蓝铜矿、孔雀石、氢氧化铜的顺序逐渐转变.因此,对于蓝铜矿,pH值升高其将转变为孔雀石,进而被氨浸出.
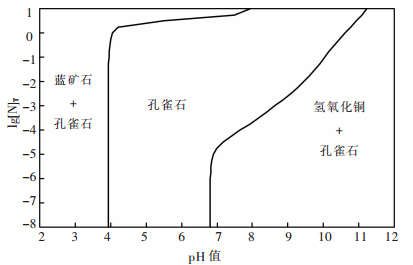 |
| 图 1 CuO-CO2-NH3-H2O体系沉淀物优势区图 |
在孔雀石与蓝铜矿的共存区,溶液中各游离组分满足式(1)、式(2)、式(5)~式(26);在孔雀石与氢氧化铜的共存区,溶液中各游离组分满足式(1)、式(3)、式(5)~式(26).根据以上平衡关系,可以计算和绘制25 ℃总氮浓度为1 mol/L时CuO-CO2-NH3-H2O体系各溶解组分的lgc-pH图,如图 2.在此基础上,还可获得该条件时氮元素分布分数与pH值的关系,如图 3.由图 3可见,pH值对铜的溶解起决定性作用,当pH值较低时,溶液H+和Cu2+竞争与NH3的结合,使溶液中氮主要以NH4+存在,铜氨配合物浓度低;当pH值大于11时,OH-和NH3竞争与Cu2+的结合,使铜转化为氢氧化铜沉淀,不利于铜氨配合物的形成.此时,氮主要以游离NH3形态存在;当pH值在8~11的范围内,H+和OH-的竞争作用均较弱,大部分NH3与Cu2+形成配合物,并可见Cu(NH3)42+为该pH值区域的优势物种.
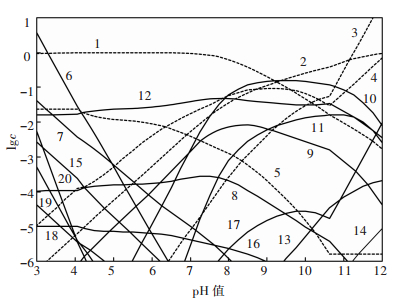 |
| 1. NH4+;2.NH3;3.CO32-;4. HCO3-;5. H2CO3;6. Cu2+;7. Cu(NH3)2+;8. Cu(NH3)22+;9. Cu(NH3)32+;10. Cu(NH3)42+;11. Cu(NH3)52+;12. Cu(NH3)(OH)+;13. Cu(NH3)2(OH)2(aq);14. Cu(NH3)(OH)3-;15. CuHCO3+;16. CuCO3(aq);17. Cu(CO3)22-;18. Cu(OH)+;19.Cu2(OH)22+;20.Cu2(OH)3+. 图 2 CuO-CO2-NH3-H2O体系各溶解组分的lgc-pH图(25 ℃,[N]T=1 mol/L) |
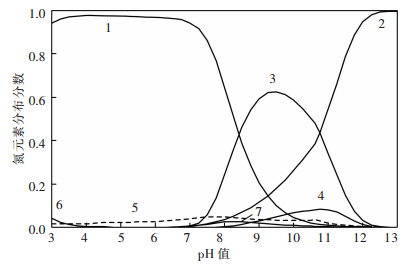 |
| 1. NH4+;2. NH3;3.Cu(NH3)42+;4. Cu(NH3)52+5. Cu(NH3)(OH)+;6.Cu(NH3)2+;7. Cu(NH3)32+ 图 3 CuO-CO2-NH3-H2O体系氮元素分布分数与pH值的关系(25 ℃,[N]T=1 mol/L) |
采用上述方法亦可计算出25 ℃下总氮浓度为0~1 mol/L时平衡后的lg[Cu]T-pH图,如图 4.由图 4可见,氨的存在对孔雀石的溶解行为有显著的影响.相比于无氨的情形,溶液中总铜浓度在一定pH值范围内随着总氮浓度的升高而升高,表明氨是分解孔雀石的有效试剂.此外,还可发现总氮浓度越高,其影响的pH值范围越大.结合图 1和图 2分析可知,含氨溶液中,由于NH3结合Cu2+形成配合物,降低了溶液中Cu2+活度,使氢氧化铜要在更高pH值条件下形成,从而扩大了孔雀石的单独稳定区,缩减了氢氧化铜的稳定区.
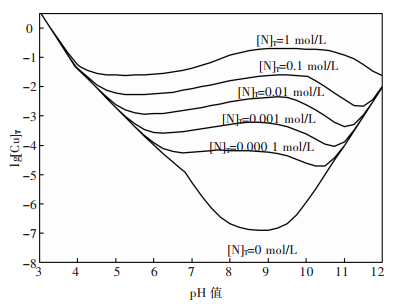 |
| 图 4 CuO-CO2-NH3-H2O体系不同总氮浓度时的lg[Cu]T-pH图(25 ℃) |
3 铵盐体系孔雀石最佳浸出pH值的热力学预测
利用同时平衡原理,可算得25 ℃下总氮浓度为1~5 mol/L时平衡后溶液总铜浓度与pH值的关系,如图 5.由图 5可见,pH值对铜溶解度影响较大,并且,不同总氮浓度下,总铜浓度最高时的pH值不尽相同.为便于指导工业实践,有必要对不同总氮浓度下氨浸出孔雀石的最佳pH值做热力学预测.
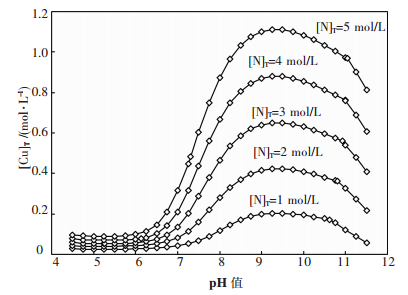 |
| 图 5 CuO-CO2-NH3-H2O体系不同总氮浓度下的[Cu]T-pH图(25 ℃) |
由图 5可见,在pH值8~11的区间内,总铜浓度随pH值的变化呈现出单峰函数的关系,但由于方程组数量较多且形式复杂,难以求得该函数的数学表达式,因而难以通过公式运算的方法求得极值点.在此情况下,采用爬山搜索的算法,以pH值8.5为起点,初始搜索步长为0.1,达到该步长的最高总铜浓度后,搜索步长缩短为原来的1/10,进行下一轮搜索,以此迭代,直至pH值精确值小数点后5位.通过这种方法可获得不同总氮浓度时氨浸出孔雀石的最佳pH值,如图 6.由图 6可见,最佳浸出pH值在9.3~9.4之间,且随溶液总氮含量的变化而变化.在此基础上,可绘制最佳浸出pH值时总铜和总氮平衡浓度的关系曲线图,如图 7.由图 7可见,总铜和总氮浓度大体呈直线关系,通过该直线的斜率可求得最佳浸出pH值时总氮对总铜浓度的比值为4.4,结合图 3的分析,可进一步确认该浸出条件时Cu(NH3)42+为优势物种.
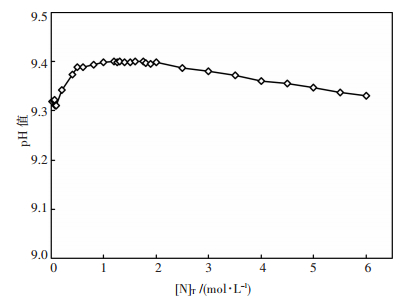 |
| 图 6 不同总氮浓度时氨浸出孔雀石的最佳pH值 |
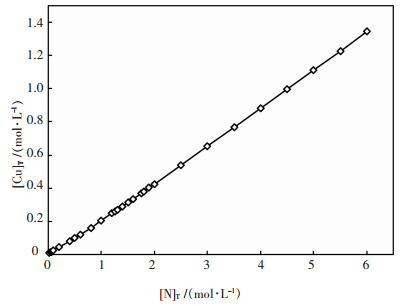 |
| 图 7 最佳浸出pH值时总铜和总氮浓度的关系 |
对于浸出前溶液溶质为NH3·H2O和(NH4)2SO4的情形,根据电中性原则可算得平衡后溶液中SO42-的浓度,再根据质量守恒定律可推算出浸出前溶液中SO42-与总氮的比例,进而求得浸出前溶液的铵氨比[NH4+]/[NH3] .因此,基于平衡后的最佳浸出pH值,可求得不同总氮浓度时浸出前溶液的最佳铵氨比,如图 8所示.由图 8可见,浸出前液铵氨比需要根据体系总氮浓度的变化作出调整,当总氮大于2 mol/L,浸出前液铵氨比控制在0.58左右为宜.
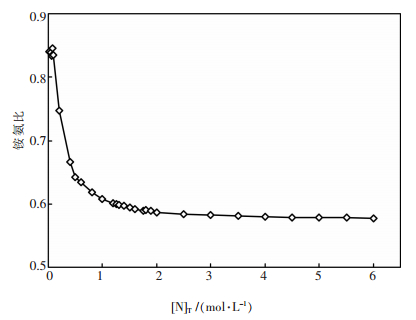 |
| 图 8 不同总氮浓度时浸出前溶液的最佳铵氨比 |
4 结论
1)基于同时平衡原理,运用现有热力学数据,计算并绘制了CuO-CO2-NH3-H2O体系的热力学平衡图.结果表明,随着pH值升高,OH-取代CO32-参与形成沉淀,使稳定存在的固体按蓝铜矿、孔雀石、氢氧化铜的顺序转变.含氨溶液中,NH3结合Cu2+形成配合物,使Cu2+活度降低,氢氧化铜需在更高pH值条件下形成,其稳定区因此缩减.
2)pH值对铜的溶解起决定性作用.pH值较低时,H+和Cu2+竞争与NH3的结合,溶液中铜氨配合物浓度低;pH值较高时,OH-和NH3竞争与Cu2+的结合,使铜转化为氢氧化铜沉淀,抑制了铜氨配合物的形成;pH值8至11时,H+和OH-的竞争作用较弱,大部分NH3与Cu2+形成配合物,其中Cu(NH3)42+为优势物种.
3)求得不同总氮浓度时氨浸出孔雀石的最佳pH值在9.3至9.4之间.该条件时总铜和总氮平衡浓度大体呈直线关系,斜率为4.4.对于浸出前溶液溶质为NH3·H2O和(NH4)2SO4的情形,当总氮大于2 mol/L,浸出前液铵氨比宜控制在0.58左右.
| [1] | 蒋开喜. 有色金属进展(第4卷: 重有色金属)[M]. 长沙: 中南大学出版社 , 2007. |
| [2] | 翟秀静. 重金属冶金学[M]. 北京: 冶金工业出版社 , 2011. |
| [3] | 张仪, 文书明. 铜湿法冶金理论与实践[M]. 北京: 化学工业出版社 , 2014. |
| [4] | 王成彦. 高碱性脉石低品位难处理氧化铜矿的开发利用——浸出工艺研究[J]. 矿冶, 2001, 10(4): 49–53. |
| [5] | 刘大星, 赵炳智, 蒋开喜, 等. 汤丹高碱性脉石难选氧化铜矿的试验研究和工业实践[J]. 矿冶, 2003, 12(2): 49–52. |
| [6] | 程琼, 章晓林, 刘殿文, 等. 某高碱性氧化铜矿常温常压氨浸试验研究[J]. 湿法冶金, 2006, 25(2): 74–77. |
| [7] | 臧宏, 温建康, 陈勃伟, 等. 高碱性低品位氧化铜矿氨浸-萃取-电积工业试验[J]. 金属矿山, 2010(11): 87–90. |
| [8] | 纪翠翠, 周庆华. 氧化铜矿常温常压两段氨浸试验研究[J]. 有色金属, 2011, 63(2): 152–154. |
| [9] | 程泰, 单庆生. 新疆某低品位氧化铜矿氨浸试验研究[J]. 黄金, 2014, 35(8): 60–64. |
| [10] | 巨少华. MACA体系中铜、镍和金的冶金热力学及其低品位矿的堆浸工艺研究[D]. 长沙: 中南大学, 2006. |
| [11] | 方建军. 汤丹难处理氧化铜矿高效利用新技术及产业化研究[D]. 昆明: 昆明理工大学, 2009. |
| [12] |
Wang X, Chen Q Y, Hu H P, et al. Solubility prediction of malachite in aqueous ammoniacal ammonium chloride solutions at 25℃[J].
Hydrometallurgy, 2009, 99: 231–237. DOI: 10.1016/j.hydromet.2009.08.011. |
| [13] |
Liu W, Tang M T, Tang C B, et al. Thermodynamic research of leaching copper oxide materials with ammonia-ammonium chloride-water solution[J].
Canadian Metallurgical Quarterly, 2010, 49(2): 131–145. DOI: 10.1179/cmq.2010.49.2.131. |
| [14] |
Powell K J, Brown P L, Byrne R H, et al. Chemical speciation of environmentally significant metals with inorganic ligands Part 2: The Cu2+-OH-, Cl-, CO32-, SO42-, and PO43-systems (IUPAC Technical Report)[J].
Pure and Applied Chemistry, 2007, 79(5): 895–950. |
| [15] | Speight J G. Lange’s handbook of chemistry[M]. New York: McGraw-Hill Professional , 2005. |
| [16] |
Fisher J F, Hall J L. Polarographic study of complexes of copper(II) ion with ammonia and various ethyl, ethanol, and ethylethanol-amines[J].
Analytical Chemistry, 1967, 39(13): 1550–1556. DOI: 10.1021/ac50156a023. |
 2014, Vol. 5
2014, Vol. 5

