| 铜渣熔融还原过程中硫的行为特征 |
铜渣中氧化物主要是SiO2和FeO,另含有一定Cu、Fe[1-5]等有价金属,特别渣含铁在35%左右,具备较高回收价值[6].若能实现有效回收对实现铜渣二次资源有效利用具有重要意义.
铜炉渣中含铁物相主要为(2FeO·SiO2)和磁铁矿(Fe3O4)[7],针对其的回收主要有高温熔融氧化-常温破碎磁选法、阶段磨矿阶段选别法和直接熔融还原法3种.高温熔融氧化-常温破碎磁选工艺中,向熔融铜渣中吹入空气并在冷却过程中控制一定降温速率 [8],渣中磁铁矿富集率可提高到85% [9],但反应后期熔渣黏度升高,磁铁矿相继续聚集长大受阻,铁收得率总体较低.阶段磨矿阶段选别工艺中,铁硅酸盐在磁选过程中进入尾矿,铁回收率亦较低[10-12].倪文、马明生等[13]在铜渣直接熔融还原工艺中发现渣中铁还原率可提高至90%,但其对铁水成分没有进行详细研究,李磊、胡建杭等[14]在研究中通过提高熔渣碱度、加入CaF2添加剂等可有效降低铁水中硫、磷含量,但其未对硫元素的热力学及动力学行为特征进行探索.基于此,本研究主要探索铜渣熔融还原过程中硫元素的行为特征,对实现硫的有效脱除具备技术指导意义.
1 实验 1.1 实验原料实验所用原料为某铜冶炼厂水淬铜渣,化学组成见表 1.
| 表1 铜渣的化学组成/wt% |
 |
| 点击放大 |
表 1表明铜渣中硫含量高达0.52%,去除压力大.渣样物相组成见图 1.
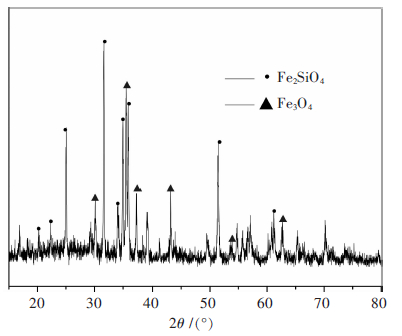 |
| 图 1 铜渣X射线衍射图谱(扫描范围2θ=15°~80°,步长为8°/min) |
图 1表明渣中含铁物相主要为Fe2SiO4和Fe3O4,且以Fe2SiO4为主[14],另渣含硫物相主要为Cu2S和FeS[15-17],但含量较少在XRD图谱中未能标示.
1.2 实验装置及实验方法实验所用电炉为高温管式电阻炉(见图 2),可加热温度范围为0~1 873 K.反应器坩埚材料为镁铝尖晶石(MgO 41.5%(质量分数),Al2O3 37.5%(质量分数)).
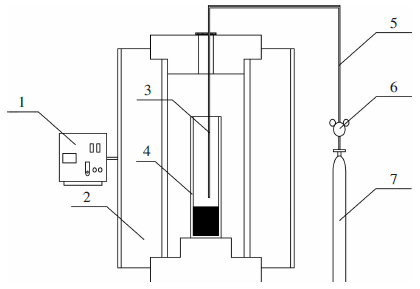 |
| 1.控制柜;2.程序控温高温坩埚电阻炉;3.刚玉管;4.反应器;5.胶皮管;6.减压阀;7.钢瓶. 图 2 实验装置 |
试验过程为:常温下将一定量铜渣、煤粉(粒度小于0.45 mm,加入量满足WC/WFe=1.33)、造渣剂于反应器中进行均匀混合,反应器置于电阻炉后进行随炉升温,达设定温度后进行特定时间保温.降温开始即将坩埚取出并用水冷,取样分析.试验中熔渣碱度按式(1)进行计算:
| $R = \frac{{w\left( {{\rm{CaO}}} \right)\% + 1.4w\left( {{\rm{MgO}}} \right)\% }}{{w\left( {{\rm{Si}}{{\rm{O}}_2}} \right)\% }}$ | (1) |
化学分析法用于表征铜渣元素组成、实验后渣样和铁水样中硫含量.
2 结果与讨论 2.1 碱度对铜渣熔融还原过程中硫行为规律的影响高温环境中,碱度对熔渣结构、黏度等性质影响较大,从而影响铜渣直接熔融还原过程中各元素的走向.研究中保温温度及保温时间分别设定为1 773 K和30 min,探讨熔渣碱度为0.8、1.0、1.2、1.4、1.6时铜渣中S元素的去除规律,并优化最优熔渣脱硫碱度.
渣脱硫反应可用以下两式进行表示[18]:
| $1/2{{\rm{S}}_2} + \left( {{{\rm{O}}^{2 - }}} \right) = 1/2{{\rm{O}}_2} + \left( {{{\rm{S}}^{2 - }}} \right)K_2^\Theta = w\left( {{{\rm{S}}_2}} \right) \times \frac{{{\gamma _{\left( {{{\rm{S}}^{2 - }}} \right)}}}}{{{\alpha _{\left( {{{\rm{O}}^{2 - }}} \right)}}}} \times {\left( {\frac{{p{{\rm{o}}_2}}}{{p{{\rm{s}}_2}}}} \right)^{1/2}}$ | (2) |
| $\left[ {\rm{S}} \right] + \left( {{{\rm{O}}^{2 - }}} \right) = \left( {{{\rm{S}}^{2 - }}} \right) + \left[ {\rm{O}} \right]\;\;K_3^\Theta = w\left( {{{\rm{S}}_3}} \right) \times \frac{{{\gamma _{\left( {{{\rm{S}}^{2 - }}} \right)}}}}{{{\alpha _{\left( {{{\rm{O}}^{2 - }}} \right)}}}} \times \frac{{{\alpha _{\left[ {\rm{O}} \right]}}}}{{{\alpha _{\left[ {\rm{S}} \right]}}}}$ | (3) |
w(S2)、w(S3)分别指式(2)和式(3)中渣中硫百分含量,γ(S2-)、α(O2-)指渣中(S2-)和(O2-)的活度系数及活度,po2和ps2分别指系统中氧势和硫势,α[O]和α[S]分别指铁水中[O]和[S]组元的活度.可用式(4)和式(5)表示式(2)和式(3)中渣中硫容量,式(4)和式(5)中CS、C’S 分别指式(2)和式(3)中硫容量.
| ${C_{\rm{s}}} = w\left( {\rm{S}} \right) \times {\left( {\frac{{p{{\rm{o}}_2}}}{{p{{\rm{s}}_2}}}} \right)^{1/2}} = K_2^\Theta \times \frac{{{\alpha _{{{\rm{O}}^{2 - }}}}}}{{{\gamma _{{{\rm{S}}^{2 - }}}}}}$ | (4) |
| $C_{\rm{s}}' = w\left( {\rm{S}} \right) \times \frac{{{\alpha _{\left[ {\rm{O}} \right]}}}}{{{\alpha _{\left[ {\rm{S}} \right]}}}} = K_3^\Theta \times \frac{{{\alpha _{{{\rm{O}}^{2 - }}}}}}{{{\gamma _{{{\rm{S}}^{2 - }}}}}}$ | (5) |
对于式(3),其反应平衡常数可表示为:
| $K_3^\Theta = \frac{{{\alpha _{{{\rm{S}}^{2 - }}}}{\alpha _{\left[ {\rm{O}} \right]}}}}{{{\alpha _{{{\rm{O}}^{2 - }}}}{\alpha _{\left[ {\rm{S}} \right]}}}} = \frac{{{\gamma _{{{\rm{S}}^{2 - }}}}w\left( {{{\rm{S}}_3}} \right){\alpha _{\left[ {\rm{O}} \right]}}}}{{{f_{\left[ {\rm{S}} \right]}}w\left[ {{{\rm{S}}_3}} \right]{\alpha _{{{\rm{O}}^{2 - }}}}}}$ | (6) |
对应熔渣和铁水间的硫分配比为:
| $\frac{{w\left( {{{\rm{S}}_3}} \right)}}{{w\left[ {{{\rm{S}}_3}} \right]}} = K_3^\Theta \times \frac{{{\alpha _{{{\rm{O}}^{2 - }}}}}}{{\alpha \left[ {\rm{O}} \right]}} \times \frac{{{f_{\left[ {\rm{S}} \right]}}}}{{{\gamma _{{{\rm{S}}^{{\rm{2 - }}}}}}}}$ | (7) |
由1/2S2(g)=[S]和1/2O2(g)=[O],分别可推得:
| $K_{\left[ {\rm{S}} \right]}^\Theta = \frac{{{f_{\left[ {\rm{S}} \right]}}\omega \left[ {\rm{S}} \right]}}{{{{\left( {\frac{{p{s_2}}}{{{p^\Theta }}}} \right)}^{\frac{1}{2}}}}},K_{\left[ {\rm{O}} \right]}^\Theta = \frac{{{\alpha _{\left[ {\rm{O}} \right]}}}}{{{{\left( {\frac{{p{{\rm{o}}_2}}}{{{p^\Theta }}}} \right)}^{\frac{1}{2}}}}}$ | (8) |
式(8)中,f[S]指[S]组元活度系数,ω[S]指铁水中[S]组元的质量浓度,
| $\lg \frac{{w\left( {{{\rm{S}}_3}} \right)}}{{w\left[ {{{\rm{S}}_3}} \right]}} = \lg {C_{\rm{s}}}' - \frac{1}{2}\lg p{{\rm{o}}_2} + \lg {f_{\left[ {\rm{S}} \right]}} - \lg K_{\left[ {\rm{O}} \right]}^\Theta $ | (9) |
式(9)中lgCS’可通过式(10)[18]计算得到.
| $\lg {C_s}' = \frac{{22\;690 - 54\;640\mathit{\Lambda } }}{T} + 43.6\mathit{\Lambda } - 25.2$ | (10) |
式(10)中,Λ指熔渣光学碱度.
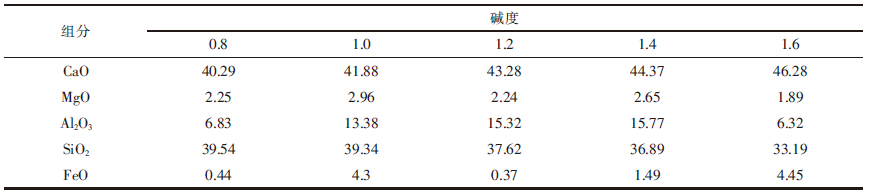
不同碱度条件下,试验中各组分质量浓度见表 2.
| 表2 碱度不同时废渣主要组分/wt% |
 |
| 点击放大 |
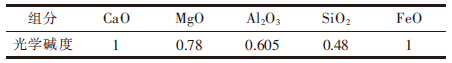
以上各组分的光学碱度如表 3.
| 表3 各组分光学碱度 |
 |
| 点击放大 |
将表 2中各组分质量浓度换算为摩尔浓度,并将各组分光学碱度(见表 3)代入式(11)[18]:
| $\Lambda = \sum {{x_{\rm{B}}}{\mathit{\Lambda } _{\rm{B}}}} $ | (11) |
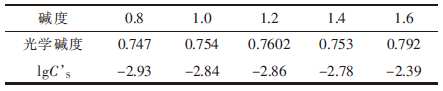
计算知各碱度下熔渣光学碱度及lgCS’见表 4.
| 表4 熔渣光学碱度及lgCS’随熔渣碱度的变化 |
 |
| 点击放大 |
表 4表明,熔渣碱度增大,渣硫容量相应增大,原是碱度升高,熔渣中O2-离子浓度增加,αO2-随之增大,又渣硫容量CS’与αO2-成正比(式(4)及式(5)).试验中,熔渣碱度从0.8增至1.4,熔融还原所得铁水中硫含量由0.6%降至0.13%(图 3[14]),较好的符合了表 4中显示随碱度增加渣硫容量升高的规律.但熔渣碱度进一步增高至1.6,铁水含硫反增至0.47%,原因可能是碱度过高,熔渣黏度大幅度升高,不利于渣脱硫动力学条件的提升,同时所生成的Ca2SiO4物相,可对CaO形成包裹阻碍其进一步离解,导致(O2-)离子浓度减小熔渣脱硫作用减弱,使铁水含硫升高.最大限度降低铁水含硫,熔渣碱度确定为1.4.
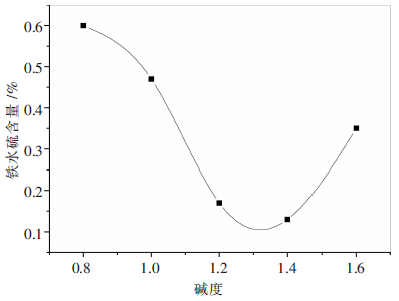 |
| 图 3 铁水中S含量随碱度的变化 |
2.2 保温温度对铜渣熔融还原过程中硫行为规律的影响
熔渣碱度为1.4、保温时间设定为30 min,实验主要从1 773 K、1 823 K、1 848 K、1 873 K 4个不同温度研究其对熔池中硫行为的影响规律.
熔渣脱硫反应属吸热反应,保温温度由1 773 K升至1 823 K,渣脱硫作用增强,铁水硫含量由0.13%降至0.089%(见图 4[14]),保温温度继续升高至1 848 K、1 873 K,铁水硫含量反分别增至0.12%、0.15%,原因可能是此过程中发生铁水回硫(见式(12)),源于熔渣为高含硫渣系[14](见表 5).最大限度降低铁水含硫,保温温度确定为1 823 K.
| $\left( {{{\rm{S}}^{2 - }}} \right) \to \left[ {\rm{S}} \right]$ | (12) |
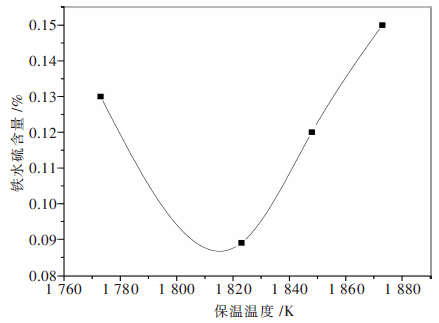 |
| 图 4 保温温度对铁水含硫的影响 |
| 表5 保温温度对渣中硫含量的影响 |
 |
| 点击放大 |
2.3 保温时间对熔融还原过程渣中硫行为的影响
熔渣碱度1.4、保温温度1 823 K条件下,研究保温时间分别为20 min、30 min、35 min、40 min对铜渣中S脱除效果的影响规律,并确定其最佳工艺取值.
保温时间延长有利于铁水除杂,对应铁水含硫逐步降低,渣含硫逐步增加,见图 5.
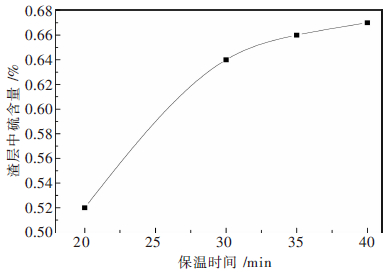 |
| 图 5 渣层中硫含量随保温时间的变化 |
保温时间为40 min时,熔渣基本成分见表 6.将表 6、表 3结果代入式(11)并进一步代入式(10),可得炉渣硫容量lgCS’=-2.769,又反应1/2S2=[S],其
| 表6 保温时间为40 min对应渣层成分 |
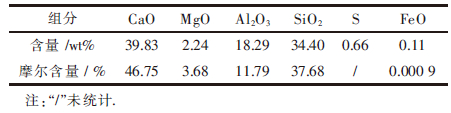 |
| 点击放大 |
| 表7 保温时间为40 min对应铁水组分 |
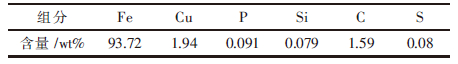 |
| 点击放大 |
| $\lg {f_{\rm{C}}} = {e}_{\rm{C}}^{\rm{S}}\omega \left[ {\rm{S}} \right] + {e}_{\rm{C}}^{{\rm{Si}}}\omega \left[ {{\rm{Si}}} \right] + {e}_{\rm{C}}^{\rm{P}}\omega \left[ {\rm{P}} \right] + {e}_{\rm{C}}^{\rm{C}}\omega \left[ {\rm{C}} \right] + {e}_{\rm{C}}^{{\rm{Cu}}}\omega \left[ {{\rm{Cu}}} \right]$ | (13) |
式(13)中,fC为铁水中[C]组元的活度系数,
| 表8 铁溶液内元素对[C]的活度作用系数 |
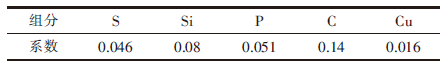 |
| 点击放大 |
结合熔融还原过程中所发生反应式(14),
| $\begin{array}{c} \left[ {\rm{C}} \right] + 1/2{{\rm{O}}_{\rm{2}}}{\rm{ = CO}}\;\;\;\Delta rG_{\rm{m}}^\Theta = - 114\;400 - 85.77T\\ K_{\left[ {\rm{C}} \right]}^\Theta = {P_{{\rm{CO}}}}/\left( {P_{{{\rm{O}}_{\rm{2}}}}^{1/2} \cdot {\alpha _{\left[ {\rm{C}} \right]}}} \right) \end{array}$ | (14) |
可推知T=1 823K时:
| $\begin{array}{l} \lg K_{\left[ {\rm{C}} \right]}^\Theta = 7.713\\ \lg {P_{{{\rm{O}}_{\rm{2}}}}} = - 16.02 \end{array}$ |
熔渣结构参考焦姆金完全离子溶液模型,fS=1, lgfS=0.
将lgCS’=-2.769,lgPO2=-16.02,lgfS=0及
综上,铜渣熔融还原炼铁工艺中脱硫的最佳工艺条件确定为:熔渣碱度1.4,保温温度1 823 K,保温时间 40 min,处理后铁水含硫为0.08%,含量仍较高,需进一步对铁水进行脱硫预处理才可用于转炉炼钢.
3 结论通过热力学理论计算和化学滴定分析,对铜渣熔融还原炼铁过程中硫的行为特征进行了实验研究. 得到如下结论:
1)熔渣碱度增大,渣硫容量相应增大.碱度从0.8增至1.4,渣硫容量增大,相应铁水中硫含量由0.6%降至0.13%;碱度进一步增高至1.6,熔渣黏度大幅度提高,渣脱硫动力学条件恶化,铁水含硫反增至0.47%.
2)保温时间延长有利于铁水脱硫.熔渣-铁水硫理论分配比远大于实验中实际硫分配比,即脱硫反应远没有达到平衡,保温时间延长有利于铁水脱硫.
3)熔渣碱度1.4、保温温度1 823 K和保温时间 40 min时,处理后铁水含硫为0.08%,含量仍较高,需进一步对铁水进行脱硫预处理才可用于炼钢.
| [1] | 陈远望. 智利铜炉渣贫化方法概述[J]. 世界有色金属, 2001(9): 56–62. |
| [2] |
Rudnik E, Burznska L, Gumowska W. Hydrometallurgical recovery of copper and cobalt from reduction-roasted copper converter slag[J].
Minerals Engineering, 2009, 22(1): 88–95. DOI: 10.1016/j.mineng.2008.04.016. |
| [3] |
Zhang Y, Man R L, Ni W D, et al. Selective leaching of base metals from copper smelter slag[J].
Hydrometallurgy, 2010, 103(112/314): 25–29. |
| [4] |
Carranza F, Iglesias N, Mazuelos A. Ferric leaching of copper slag floation tailings[J].
Minerals Engineering, 2009, 22(1): 107–110. DOI: 10.1016/j.mineng.2008.04.010. |
| [5] | 邓彤, 文震, 刘东. 硫酸介质中氯化物参与下氧化浸出铜渣过程[J]. 中国有色金属学报, 2001, 11(2): 302–306. |
| [6] |
Carranza F, Romero R, Mazuelos A, et al. Biorecovery of copper from converter slag: Slag characterization and exploratory ferric leaching tests[J].
Hydrometallurgy, 2009, 97(1/2): 39–45. |
| [7] | 朱祖泽, 贺家齐. 现代铜冶金学[M]. 北京: 科学出版社 , 2003: 75. |
| [8] |
Zhang L N, Zhang L, Wang M Y, et al. Oxidization mechanism in CaO-FeOX-SiO2 slag with high iron content[J].
Trans Nonferrous Met Soc China, 2005, 15(4): 938–943. |
| [9] | 张林楠.铜渣中有价组分的选择性析出研究[D].沈阳: 东北大学, 2005. |
| [10] | 韩伟, 秦庆伟. 从炼铜炉渣中提取铜铁的研究[J]. 矿冶, 2009, 18(2): 9–12. |
| [11] | 王珩. 炼铜转炉渣中铜铁的选矿研究[J]. 有色矿山, 2003, 32(4): 19–23. |
| [12] | 邓彤, 凌云汉. 含钴铜转炉渣的工艺矿物学[J]. 中国有色金属学报, 2001, 11(5): 881–885. |
| [13] | 倪文, 马明生, 王亚利, 等. 熔融还原法镍渣提铁的热力学与动力学[J]. 北京科技大学学报, 2009, 31(2): 163–168. |
| [14] | 李磊, 胡建杭, 王华. 铜渣熔融还原炼铁研究[J]. 过程工程学报, 2011, 11(1): 65–71. |
| [15] |
Shanmuganathan P, Lakshmipathiraj P, Srikanth S, et al. Toxicity characterization and long-term stability studies on copper slag from the ISASMELT process[J].
Resources, Conservation and Recycling, 2008, 52(4): 601–611. DOI: 10.1016/j.resconrec.2007.08.001. |
| [16] |
Muravyov M I, Fomchenko N V, Usoltsev A V, et al. Leaching of copper and zinc from copper converter slag flotation tailings using H2SO4 and biologically generated Fe2(SO4)3[J].
Hydrometallurgy, 2012, 119/120: 40–46. DOI: 10.1016/j.hydromet.2012.03.001. |
| [17] |
Maweja K, Mukongo T, Motombo I. Cleaning of a copper matte smelting slag from a water-jacket furnace by direct reduction of heavy metals[J].
Journal of Hazardous Materials, 2009, 164(2/3): 856–862. |
| [18] | 黄希祜. 钢铁冶金原理[M]. 北京: 冶金工业出版社 , 2002. |
 2014, Vol. 5
2014, Vol. 5


