| Fe(Ⅱ)-H2O2不同温度浸润改性活性炭吸附去除水中砷(V) |
2. 同济大学环境科学与工程学院,上海 200092
2. Tongji University, Shanghai 200092,China
砷是剧毒元素,对人类有致癌和突变作用,也是动物致畸和植物枯黄的影响因素[1-3].水中的砷主要来源于火山爆发、岩石侵蚀等自然源,以及工农业生产、 采矿等人为源[4].随着工业化快速发展,砷污染越来越严重,以及人们更加关注健康,现国内砷饮用水标准已由0.05 mg/L 变成0.01 mg/L[5].因此,人们对除砷技术提出越来越高的要求.
目前,国内外除砷技术主要有化学沉淀法、离子交换法、吸附法、膜分离法等[6-9].其中吸附法是-种经济而有效的方法,很多研究者采用铁盐改性活性炭制备优良的吸附剂(Fe-GAC)去除水中五价砷和三价砷,如Z M Gu 等[10]采用NaCl0、O2 和H2O2 氧化铁(Ⅱ)并加人碱负载起基铁在活性炭上吸附砷,M Jang 等[11] 采用三价铁盐直接浸润法负载起基铁在活性炭上吸附砷,G Muniz 等[12]先用过氧化氢和酸氧化活性炭,然后浸渍Fe3+和Fe2+吸附砷. 也有研究者对三价铁盐和氧化二价铁盐负载起基铁在颗粒活性炭上进行对比研究,研究结果发现氧化二价铁盐负载起基铁效果更好. 现H2O2 氧化Fe(Ⅱ)是-种被广泛应用在水处理技术中的芬顿反应,H R Dong 等[13]采用芬顿反应(Fe(Ⅱ)-H2O2) 混凝方法能有效去除砷,但最终产物砷和铁的废渣会再次污染环境.用Fe(Ⅱ)-H2O2 浸润法改性颗粒活性炭去除砷还未见报道.
本文采用FeSO4·7H2O 添加H2O2 通过芬顿反应浸润法改性颗粒活性炭,并改变浸润的温度和时间来制备2 种不同的铁盐改性颗粒活性炭.-种是在温度为100 ℃的条件下纯浸润24 h 制备材料(Fe(Ⅱ)-24 h),另-种是采用高温蒸发法制备材料(Fe(Ⅱ)-15 min). 通过对2 种方法制备的吸附剂进行SEM 表征,并对材料吸附砷(V)(1.1 mg/L)的铁效率和pH 值影响进行对比研究以及考察了离子强度对砷(V)(1.1 mg/L)去除率的影响,比较2 种材料性能优劣,从而选择材料.研究通过改进材料的制备方法来提高除砷(V)性能,具有很强的现实意义和环境保护价值,为后续改性材料的制备提供-定的参考价值.
1 试验部分 1.1 试剂与仪器本试验采用的化学试剂有: 七水合硫酸亚铁(FeSO4·7H2O,>99 %,指质量百分含量,下同)、氢氧化纳(Na0H,>99 %)、浓盐酸(HCl,>99 %)、 砷酸纳(Na3AsO4·12H2O,>99 % )、、 氯化纳(NaCl,>99 % )、 无水硫酸纳(Na2SO4,>99 %)、硝酸纳(NaNO3,>99 %),无水磷酸纳(Na3PO3,>99%)、高氯酸纳(Na2ClO4,> 99 %)、澳酸押(KBrO3,>99 %)、过氧化氢(H2O2,>3 %),均为分析纯试剂,购自国药集团化学试剂有限公司,活性炭(GAC),购置于杭州碳索公司,试验用水均采用Milli-Q出水.
本试验采用的试验仪器有: 电热恒温鼓风烘箱(DHG-9146 型); 电子天平(FA1004); 恒温振荡器(HZQ-X300C);pH 汁(METTLER T0LEP0);单联立式万用电炉(上海锦凯科学仪器有限公司);电感祸合Plasma-0ptical 发射光谱(ICP-0ES);场发射电子扫描显微镜(FESEM)(JSM-6701F).
1.2 试验方法 1.2.1 材料制备颗粒活性炭活化是采用蒸馆水和活性炭混合在电炉上煮沸 10min,然后用蒸馆水冲洗干净,烘干备用.恒温浸润法制备 Fe(Ⅱ)-24h:5 g 颗粒活性炭和2gFeSO4·7H2O 混合均匀在蒸馆水中,同时分别加人0.5-10 mL 的H2O2,再搅拌均匀,在温度100 ℃条件下浸润24 h,然后用水冲洗干净,干燥4-5 h,然后装袋密封保存. 测定不同铁含量的百分数在命名中用()表示,如铁含量为1.35 %,则表示为Fe(Ⅱ)(1.35 %)-24h.高温蒸发法制备 Fe(Ⅱ)-15min:5g活性炭和2 g FeSO4·7H2O 混合均匀在蒸馆水中,用电炉加热,边加热边搅拌,并缓慢加人0.5-10 mL 的H2O2,用水冲洗干净,干燥4-5 h,然后装袋密封保存.不同铁含量的表示方法同上.
1.2.2 吸附试验称取0.1 g 材料,置于-系列250 mL 细口瓶中,再分别加人100 mL 初始浓度为1.1 mg/L 的砷(V)溶液,放人恒温摇床中,在25 ℃的温度下,以150 r/min 频率振荡24 h,取样并用0.22 μm 微孔滤膜过滤,采用ICP-0ES 测定吸附前后溶液中砷(V)的浓度.
1.2.3 pH 值影响试验称取0.1 g 材料,置于-系列250 mL 细口瓶中,再分别加人100 mL 初始浓度为1.1 mg/L 的砷(V)溶液,用Na0H 和HCl 调节溶液至所需pH 值分别为2、4、5、6、8、10、12,放人恒温摇床中,温度25 ℃ 时,以150 r/min 频率振荡24 h,取样并用0.22 μm 微孔滤膜过滤,采用ICP-0ES 测定吸附前后溶液中砷(V)的浓度.
1.2.4 共存离子影响试验称取 0.1g 材料,置于-系列 250mL 细口瓶中,再分别加人100 mL 初始浓度为1.1 mg/L 的砷(V)溶液,然后分别投加NaCl、Na2SO4、NaNO3,Na3PO3、 Na2ClO4,KBrO3 几种物质,投加的质量浓度为100 mg/L、 500 mg/L、1 000 mg/L,放人恒温摇床中,温度25 ℃ 时,以150 r/min 频率振荡24 h,取样并用0.22 μm 微孔滤膜过滤,采用ICP-OES 测定吸附前后溶液中耐(V)的浓度.
1.2.5 铁离子含量测定称取0.2 g 材料,置于-系列250 mL 细口瓶中,再分别加人100 mL 的蒸馆水. 然后用2 M HCl 调节溶液的pH 值为2 左右,放人恒温摇床中,25 ℃温度时,以150 r/min 频率振荡12 h,取样并用0.22 μm 微孔滤膜过滤,采用 ICP-OES 测定铁离子含量.
1.2.6 计算公式采用式(1)、式(2)和式(3)计算吸附平衡容量、铁含量、去除率.
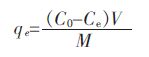
|
(1) |
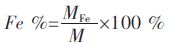
|
(2) |
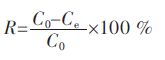
|
(3) |
式(1)、 式(2)、 式(3) 中,C0 为初始浓度,mg/L;Ce 为平衡浓度,mg/L;qe 为平衡吸附容量,mg/g;V 为溶液体积,L;M 为投人吸附剂的质量,g;MFe 为铁质量,g;M 为投人吸附剂的质量,g;Fe % 为铁含量;R 为去除率.
2 结果与讨论 2.1 材料SEM 表征图1 是高温蒸发法(图1(a))和纯浸润法(图1(b)) 所制备的2 个吸附剂的扫描显微镜图像.从图1(a)可知:Fe(Ⅱ)(1.35 %)-15 min 表面覆盖薄而均匀的棒状物质,但该棒状物质可能是被高温烧结而扭曲了形状.通过F町IR 表征,得知这些棒状物质为FeOHSO4和FeOOH[14].从图1(b)可知:Fe(Ⅱ)(0.485 %)-24 h表面覆盖-层厚而均匀的纳米FeOHSO4和FeOOH,或温度过高会引起纳米FeOHSO4 和FeOOH 变形; FeSO4·7H2O 和颗粒活性炭混合在100 ℃环境条件下浸润24 h 有利于形成纳米FeOHSO4 和FeOOH.
 |
| 图 1 Fe(Ⅱ)(1.35 %)-15 min 和 Fe(Ⅱ)(0.485 %)-24 h 的扫描电子显微镜图 |
2.2 H2O2 的作用
图2 反映铁含量随H2O2 投加量的变化情况.从图2 可知,Fe(Ⅱ)-24 h 和Fe(Ⅱ)-15 min 的铁含量均随H2O2 投加量的增加而增加,当H2O2投加量为5-10 mL 时,铁含量保持不变且达到最大,2 类吸附剂的铁含量随H2O2 投加量的变化趋势相似.铁含量随H2O2 投加量变化的原因为:H2O2 是强氧化剂,易将二价铁离子氧化为三价铁离子,三价铁离子易于结合水生成水合起基铁,更易负载在颗粒活性炭上,从而铁含量增多. 而且 Fe (Ⅱ )-15 min 的铁含量高于 Fe(Ⅱ)-24h.其原因可能是高温蒸发加速铁盐的水解,从而铁盐量流失少,负载的铁量大.
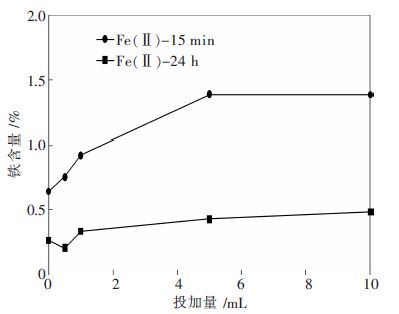 |
| 图 2 H2O2 投加量对Fe(Ⅱ)-24 h 和Fe(Ⅱ)-15 min铁含量的影响 |
2.3 铁效率比较
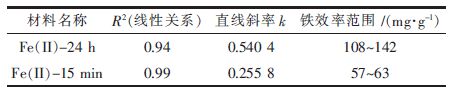
铁效率是指单位质量(g)浸渍铁上所吸附的碑(V) (mg),即铁效率表明了吸附容量与铁含量的关系.选取2 种方法制备的吸附剂进行进-步研究,考察它们的铁含量与碑(V)吸附容量的关系,即铁效率的大小.图3 为Fe(Ⅱ)-15 min 与Fe(Ⅱ)-24 h 的吸附容量随铁含量的变化情况. 从图3 可知,2 类吸附剂的吸附容量均随铁含量增加而增加,且吸附容量与铁含量成线性关系(R2>0.94).此外,Fe(Ⅱ)-24 h 吸附容量与铁含量的坡度很陡,斜率为0.540 4,Fe(Ⅱ)-15 min 的坡度很平缓,斜率为0.255 8.表1 为Fe(Ⅱ)-15 min 与Fe (Ⅱ)-24 h 2 类吸附剂的线性拟合参数和铁效率范围.从表1 可知,Fe(Ⅱ)-24 h 和Fe(Ⅱ)-15 min 的铁效率范围分别为108-142 mg/g Fe 和57-63 mg/g Fe,前者远远高于后者,这也完全说明对砷(V)吸附的铁效率和材料制备的方法有关.这可能是因为Fe(Ⅱ)-24 h 在完全浸润24 h,有大量的FeOHSO4和FeOOH 沉淀在活性炭的表面,并形成纳米粒径棒状起基铁,纳米FeOHSO4 和FeOOH 更容易与砷(V) (1.1 mg/L)有效碰撞,从而铁效率更高.
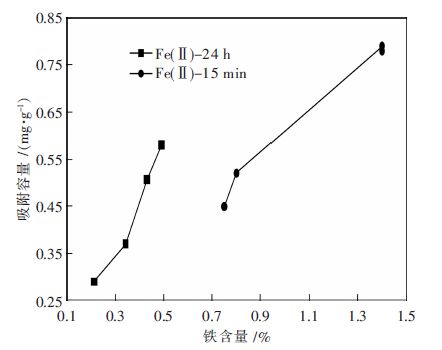 |
| 图 3 Fe(Ⅱ)-15 min 与Fe(Ⅱ)-24 h 吸附剂的铁含量与砷(V)(1.1mg/L)的平衡吸附容量关系图 |
| 表1 Fe(Ⅱ)-15 min 与Fe(Ⅱ)-24 h线性拟合参数和铁效率范围 |
 |
| 点击放大 |
2.4 pH 值影晌
高温蒸发法所制备铁含量最大的Fe(Ⅱ)(1.35 %)-15min和浸法所制备铁含量最大的Fe(Ⅱ)(0.485 %)-24 h 2 种吸附剂被选择进行pH值影响图4反映不同pH 值下,Fe(Ⅱ)(1.35%))-15min 和 Fe(Ⅱ)(0.485 %)-24 h 对砷(V)(1.1 mg/L)的平衡容量以及铁的溶出量变化情况.从图4 可知,2 种吸附剂的吸附容量受溶液pH 值影响趋势相似.当pH< 5 时,随着溶液pH 值上升,吸附容量升高,且pH 值在2-4,吸附容量快速升高;当4<pH<5 时,吸附容量达到最大;当pH>5 时,随着溶液pH 值上升,吸附容量下降.2 种材料对比分析可知,当2<pH<3.5 或9< pH<12 时,Fe (Ⅱ)(0.485 %)-24 h 的吸附容量优于Fe(Ⅱ) (1.35 %)-15 min,而在3.5<pH<9 时,Fe(Ⅱ) (1.35 %)-15 min 的吸附容量优于Fe(Ⅱ)(0.485 %) -24 h.图4 也表明不同pH 值条件下的铁量析出情况. 从图4 可知,在pH<4 或pH>8 时,Fe(Ⅱ)(1.35 %)-15 min 和Fe(Ⅱ)(0.485 %)-24 h 都有铁离子析出,但Fe(Ⅱ)(1.35 %)-15 min 的铁离子析出量大于Fe(Ⅱ) (0.485 %)-24 h;在4<pH<8 时,Fe(Ⅱ)(1.35 %)-15 min和Fe(Ⅱ) (0.485 %)-24 h 铁离子基本上不析出;由此可知,Fe (Ⅱ)(0.485 %)-24 h 在不同pH 值的条件下铁的溶出量低于Fe(Ⅱ)(1.35 %)-15 min,Fe(Ⅱ) (0.485 %)-24 h 稳定性更好.
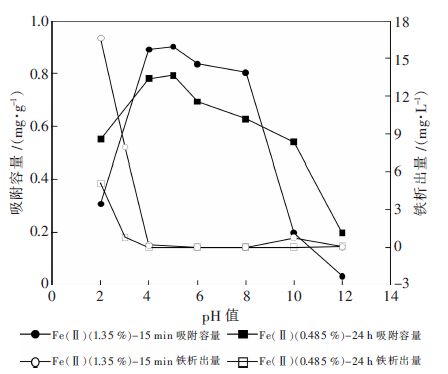 |
| 图 4 不同pH 值对Fe(Ⅱ)(1.35 %)-15 min 和Fe(Ⅱ)(0.485 %)-24 h 吸附砷(V)(1.1 mg/L)的影晌及其材料的稳定性分析 |
2.5 共存离子影晌
天然水体中共存离子与砷(V)存在竞争吸附,从而影响砷 (V)去除率. 在溶液pH=4 时,加入CI-、NO3-、PO43-、BrO3-、CIO4-几种阴离子,用Fe(Ⅱ)(0.485 %)-24 h 去除砷酸根(1.1 mg/L),考察共存离子对砷酸根(1.1 mg/L)去除率的影响,结果如图5 所示.从图5 可知,在无共存离子时,去除率为83%;在PO43-浓度为100 mg/L、500 mg/L、1 000 mg/L 时,去除率分别为8 %、0、3 %,其原因是PO43-与砷酸根都是四面体阴离子,可以与铁氧化物表面的官能团形成内层复合物,牢固地吸附在吸附剂表面从而占据吸附位点[15-18],因此PO43-吸附有明显的抑制作用.SO42-、NO3-、CIO4-对吸附有略微的抑制作用,且抑制效果随浓度的升高而先增强后减弱,其原因是高浓度(1000mg/L)的SO42-、NO3-、ClO4-、能压缩双电层,增大砷酸根离子与吸附剂接触的机会[19],因此去除率比离子强度500 mg/L 有所提高.在Cl-浓度为100 mg/L 时,去除率为88 %,但在Cl-浓度为500 mg/L、1 000 mg/L 时,去除率均为82 %;然而在BrO3-浓度为100 mg/L、500 mg/L、1 000 mg/L 时,去除率分别为 94%、91 %、86 %,BrO3-对吸附起促进作用[20],可能是因为BrO3-会对Fe(Ⅱ)(0.485 %)24 h中残存的 Fe2+ 起氧化作用,生成 Fe3+ 而形成更多 FeOOH,从而促进了对砷酸根离子的吸附.
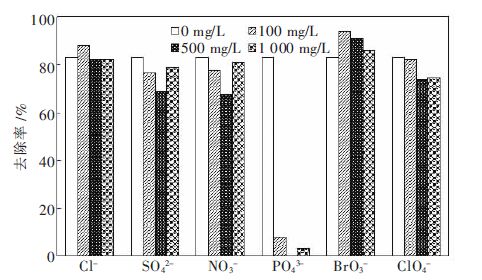 |
| 图 5 共存离子对去除率的影响 |
3 结论
1) Fe(Ⅱ)(0.485 %)-24 h 表面覆盖厚而均匀的纳米在基铁,Fe(Ⅱ)(1.35 %)-15 min 表面覆盖薄而均匀烧结扭曲的在基铁,温度100 ℃纯浸润24 h 更有利于形成纳米在基铁.
2) Fe(Ⅱ)-24 h 和Fe(Ⅱ)-15 min 2 类吸附剂的铁含量均随H2O2 投加量的增加而增加,高温蒸发法制备的Fe (Ⅱ)-15 min 铁含量高于温度100 ℃纯浸润24 h 制备的Fe(Ⅱ)-24 h 铁含量.
3) Fe(Ⅱ)-24 h 对砷(V)铁效率范围在108-142 mg/g Fe,而Fe(Ⅱ)-15 min 铁效率范围在57-63 mg/gFe,这也说明砷(V)吸附的铁效率和材料制备的方法有关,因为Fe (Ⅱ)-24 h 在完全浸润24 h,有大量的Fe0HSO4 和Fe00H 沉淀在活性炭的表面.
4) 在 2<pH<3.5 或 9<pH<12 时,Fe(Ⅱ)(0.485 6)- 24 h 对砷(V)(1.1 mg/L)吸附平衡容量高 Fe(Ⅱ)(1.35%)-15 min,在3.5<pH<9 时,Fe(Ⅱ)(0.485%)- 24 h吸附平衡容量低于Fe (Ⅱ)(1.35%) -15 min,但 Fe(Ⅱ)(0.485%)-24 h 铁效率高,且 Fe(Ⅱ)(0.485%)- 24 h在不同pH 的条件下铁的溶出量低于Fe (Ⅱ)(1.35%)-15 min;因此Fe(Ⅱ)(0.485%)- 24 h吸附砷(V)铁效率和稳定性要优于 Fe(II) (1.35 %)-15 min.
5) SO42-、NO3-、ClO4-、PO43-的存在会降低砷(V)的去除率,特别是PO43-对呻(V)去除率的影响较大,Cl-(100 mg/L)和 BrO3-的存在会提高砷(V)的去除率.
| [1] | National Research Council. Arsenic in Drinking Water[M]. Washington, DC: National Academy of Sciences , 1999. |
| [2] |
Smith A H. Cancer risks from As in drinking water[J].
Environ Health Persp, 1992, 97: 259–262. DOI: 10.1289/ehp.9297259. |
| [3] | 林志灵, 张杨珠, 曾希柏, 等. 土壤中砷的植物有效性研究进展[J]. 湖南农业科学, 2011(3): 52–56. |
| [4] | 缑星, 刘德汞, 曹珍, 等. 微波辅助酸改性粉煤灰处理含砷废水[J]. 河南师范大学学报(自然科学版), 2013, 41(3): 105–109. |
| [5] | 赵莹, 张振亚, 陈荣志, 等. 改性陶土颗粒吸附砷的实验研究[J]. 水资源保护, 2012, 28(2): 72–77. |
| [6] |
Chen W F, Parette R, Zou J Y, et al. Arsenic removal by iron-modified activated carbon[J].
Water Res, 2007, 41: 1851–1858. DOI: 10.1016/j.watres.2007.01.052. |
| [7] |
Sen M, Manna A, Pal P. Removal of arsenic from contaminated groundwater by membrane-integrated hybrid treatment system[J].
Journal of Membrane Science, 2010, 354: 108–113. DOI: 10.1016/j.memsci.2010.02.063. |
| [8] |
Pakzadeh B, Batista J R. Surface complexation modeling of the removal of arsenic from ion-exchange waste brines with ferric chloride[J].
J. Hazard. Mater, 2011, 188: 399–407. DOI: 10.1016/j.jhazmat.2011.01.117. |
| [9] |
Jegadeesan G, Mondal K, Lalvani S B. Arsenate remediation using nanosized modified zerovalent iron particles[J].
Environ, Prog, 2005, 24: 289–296. DOI: 10.1002/(ISSN)1547-5921. |
| [10] |
Gu Z M, Fang J, Deng B L. Preparation and Evaluation of GAC-Based Iron-Containing Adsorbents for Arsenic Removal[J].
Environ.Sci.Technol, 2005, 39(10): 3833–3843. DOI: 10.1021/es048179r. |
| [11] |
Jang M, Chen W F, Cannon F S. Preloading Hydrous Ferric Oxide into Granular Activated Carbon for Arsenic Removal[J].
Environ. Sci. Technol, 2008, 42(9): 3369–3374. DOI: 10.1021/es7025399. |
| [12] |
Muniz G, Fierro V, Celzard A, et al. Synthesis, characterization and performance in arsenic removal of iron-doped activated carbons prepared by impregnation with Fe(III) and Fe(II)[J].
Journal of Hazardous Materials, 2009, 165: 893–902. DOI: 10.1016/j.jhazmat.2008.10.074. |
| [13] |
Dong H R, Guan X H, Wang D S, et al. A novel application of H2O2-Fe(Ⅱ) process for arsenate removal from synthetic acid mine drainage (AMD)water[J].
Chemosphere, 2011, 85(7): 1115–1121. DOI: 10.1016/j.chemosphere.2011.07.029. |
| [14] |
Xu J H, Gao N Y, Deng Y. Nanoscale iron hydroxide-doped granular activated carbon (Fe-GAC) as a sorbent for perchlorate in water[J].
Chem.Eng.J, 2013, 222: 520–526. DOI: 10.1016/j.cej.2012.07.141. |
| [15] |
C Su, Puls.R. Arsenate and arsenite removal by zerovalent iron: effects of phosphate, silicate, carbonate,borate, sulfate,chromate,molybdate,and nitrate, relative to chlorider[J].
Environ. Sci.Technol, 2001, 35: 4562–4568. DOI: 10.1021/es010768z. |
| [16] |
Cui Y S, Weng L P. Arsenate and phosphate adsorption in relation to oxides composition in soils: LCD modelingr[J].
Environ. Sci. Technol, 2013, 47: 7269–7276. |
| [17] |
Mercer K L, Tobiason J E. Removal of arsenic from high ionic strength solutions:effects of ionic strength, pH, and preformed versus in situ formed HFO[J].
Environ. Sci.Technol,, 2008, 42: 3797–3802. DOI: 10.1021/es702946s. |
| [18] |
Zhang N, Lin L S, Gang D C. Adsorptive selenite removal from water using iron-coated GAC adsorbentsr[J].
Water Res, 2008, 42: 3809–3816. DOI: 10.1016/j.watres.2008.07.025. |
| [19] |
Cumbal L, SenGupta A K. Arsenic removal using polymer-supported hydrated iron(Ⅲ) oxide nanoparticles: role of donnan membrane effect[J].
Environ. Sci. Technol, 2005, 39: 6508–6515. DOI: 10.1021/es050175e. |
| [20] | 许建红, 高乃云, 唐玉霖, 等. 浅析水合氧化铁的研究进展[J]. 水处理技术, 2011, 9(28): 26–30. |
 2014, Vol. 5
2014, Vol. 5

