| 湿法分解钨酸钴的热力学分析 |
2. 江西理工大学冶金与化学工程学院,江西 赣州 341000
2. School of Metallurgical and Chemical Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China
硬质合金是钨的主要应用领域,每年约50 %~60 %的钨用于制造碳化钨基硬质合金[1].我国是钨的生产和消费大国,随着装备制造、矿山采掘、交通隧道等行业的快速发展,废旧硬质合金日益增多,合理利用此类二次资源对钨行业的可持续发展具有重要意义[2-4].目前,废旧硬质合金再生利用的技术手段较多[5-7],按照钨资源回用方式的不同,大体可分为两类:一类是采用锌熔法、酸溶法、选择性电溶法等手段将黏结相钴脱除,得到的碳化钨粉返回用于制造新的硬质合金.这类方法具有工艺流程短、试剂和能源消耗低等优点,但返回的碳化钨粉能否满足高性能硬质合金的需要,碳化钨粉循环使用的限度和回用机制等系列问题仍需深入研究.另一类方法则采用硝石氧化法、硫酸钠熔炼法、空气(氧气)氧化法等手段将碳化钨彻底分解,进而采用湿法冶金流程得到纯的仲钨酸铵.其中,硝石氧化法能使钨转变为可溶水的钨酸钠,有利于后续钨的浸出,但该工艺释放的氮氧化合物容易造成环境污染;硫酸钠熔炼法亦可获得钨酸钠,但也面临二氧化硫排放的问题.相比而言,空气(氧气)氧化法可避免有害气体的释放,处理块状原料可得到疏松多孔、易于破碎的氧化产物,具有较好的工业应用前景[8-9].然而,在空气(氧气)氧化的产物中,钨和钴将形成难溶于水的化合物钨酸钴,后续还需采取一定的处理方法,实现钨和钴的分别提取.钨酸钴为单斜晶系晶体,其晶体结构与黑钨矿类似[10],因而,可借鉴已有的钨矿分解方法,采用酸、碱或苏打作为分解试剂.针对湿法分解钨酸钴的问题,本文对Co-W-H2O体系和Co-W-C-H2O 体系进行热力学分析,研究钨酸钴在水溶液中的稳定性,并寻找较好的分解条件,为工业实践提供理论依据.
1 热力学数据的选取钨酸钴分解体系中,多数沉淀物的溶度积可从相关数据手册获得. 对于没有现成溶度积数据的沉淀物,其溶度积常数可通过该沉淀溶解平衡反应的吉布斯自由能变化△GΘ 求得,公式如下:
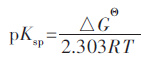
|
(1) |
其中,理想气体常数R 取8.314 5 J·K/mol,温度T 取298.15 K.利用表 1 数据,求得H2WO4(s)和CoWO4(s)溶解反应的△GΘ 分别为72.399 kJ/mol 和49.907 kJ/mol,代入公式(1)可求得H2WO4(s)和CoWO4(s)的pKsp分别为12.68 和8.74.
| 表1 Co-W-H2O 体系部分物种的热力学数据 |
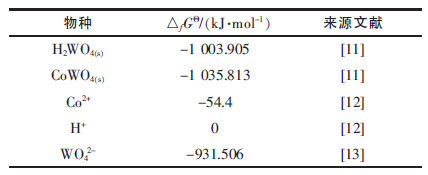 |
| 点击放大 |
钨酸钴分解过程可能发生的反应及其平衡关系式列于表 2.在缺少离子活度系数的情况下,后面计算时均以浓度代替活度.
| 表2 分解体系可能存在的反应及其平衡关系式(25 ℃) |
 |
| 点击放大 |
2 Co-W-H2O 体系的热力学分析
钨酸钴在不同pH 值溶液中游离钴和钨的存在形态有:Co2+、CoH-,Co(OH)2(aq)、Co(OH)3-、Co(OH)42-、 WO42-、HWO4-和H2WO4(aq),在一定条件下溶液中会生成各种沉淀,体系固相组分将发生改变,这时需根据固相组分的不同,分别考虑体系的平衡反应.
当体系中固体只有钨酸钴而无其它沉淀生成时,进入溶液的钴和钨均由钨酸钴提供,溶液中总钴浓度和总钨浓度相等,则有:
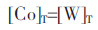
|
(15) |
根据同时平衡原理,此时,溶液中各游离组分满足方程(2)、(6)~(12)、(15).
当溶液pH 值较低时,体系会有钨酸生成,溶液中各游离组分满足方程(2)、(3)、(6)~(12);而在钨酸钴生成钨酸的边界pH 值时,各游离组分满足方程(2)、(3)、(6)~(12)、(15),通过计算,此时pH 值为4.1.当溶液pH 值升高时,体系会有氢氧化钴生成,溶液中各游离组分满足方程(2)、(4)、(6)~(12);而在钨酸钴生成氢氧化钴的边界pH 值时,各游离组分满足方程(2)、(4)、(6)~(12)、(15),通过计算,此时pH 值为9.1.根据以上计算和平衡关系,可以绘制25 ℃时Co-W-H2O体系各溶解组分的lgc-pH 图,如图 1 所示.
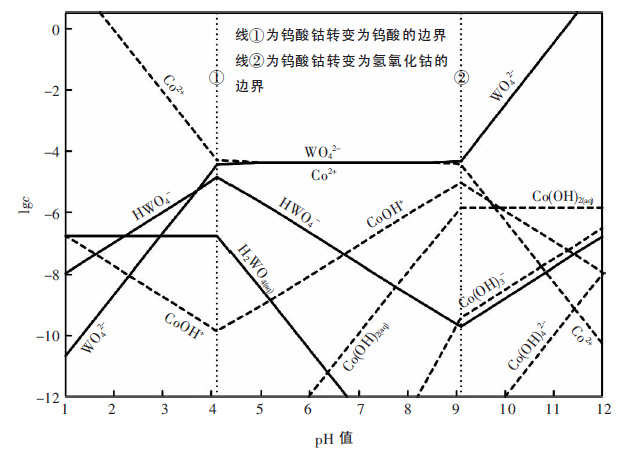 |
| 图 1 Co-W-H2O 体系各溶解组分的lgc-pH 图(25 ℃) |
由图 1 可见,钨酸钴仅在中性溶液中稳定存在.当pH 值小于4.1 时,钨酸钴便可分解为钨酸,随着酸度进一步升高,溶液中钴的浓度逐渐上升,当pH 值为2.0 时,总钴浓度可达1 mol/L,此时仅有微量可溶性钨存在;另一方面,当pH 值大于9.1 时,钨酸钴可分解为氢氧化钴沉淀,溶液中钨酸根的浓度随着pH 值升高迅速上升,当pH 值为11.2 时,溶液中总钨浓度可达1 mol/L.由此可见,采用酸分解或碱分解的方式,均可有效分解钨酸钴,并实现钨和钴的分离.
3 Co-W-C-H2O 体系的热力学分析当Co-W-C-H2O 体系中固相只有钨酸钴而无其它沉淀生成时,进入溶液的钴和钨均由钨酸钴提供,溶液中各游离组分满足方程(2)、(6)~(15).当溶液pH值较低时,体系会有钨酸生成,溶液中各游离组分满足方程(2)、(3)、(6)~(14);而在钨酸锰生成钨酸的边界pH 值时,各游离组分满足方程(2)、(3)、(6)~(15).
碳酸盐溶液中,体系在一定条件下可生成碳酸钴沉淀.在碳酸钴稳定区,溶液中各游离组分应满足方程(2)、(5)~(14); 而在钨酸钴生成碳酸钴的边界pH 值时,各游离组分满足方程(2)、(5)~(15).当溶液pH 值进一步升高,碳酸钴将被分解为氢氧化钴,体系进入氢氧化钴的稳定区,溶液中各游离组分满足方程(2)、(4)、(6)~(14); 而在碳酸钴生成氢氧化钴的边界pH值时,各游离组分满足方程(2)、(4)、(5)~(14).
根据以上平衡关系,可以计算并绘制25 ℃下总碳浓度[C]T为1×10-5 mol/L 时Co-W-C-H2O 体系各溶解组分的lgc-pH 图,如图 2 所示.采用这种方法亦可计算出25 ℃下总碳浓度分别为1×10-1 mol/L、1×10-2 mol/L、1×10-3 mol/L 和1×10-4 mol/L 时平衡后钨酸根和碳酸根的lgc-pH 图,如图 3 所示.
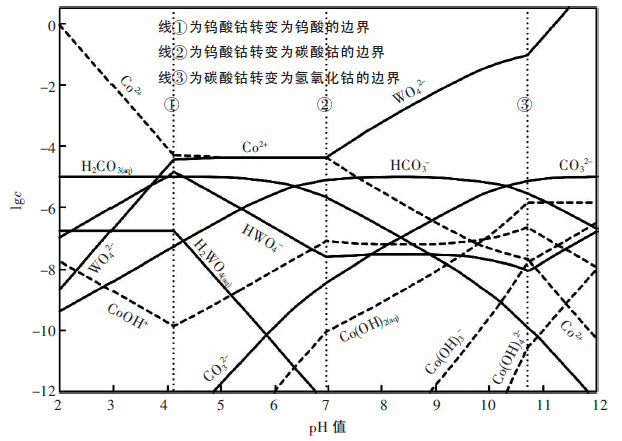 |
| 图 2 Co-W-C-H2O 体系各溶解组分的lgc-pH 图(25 ℃,lg[C]T=-5) |
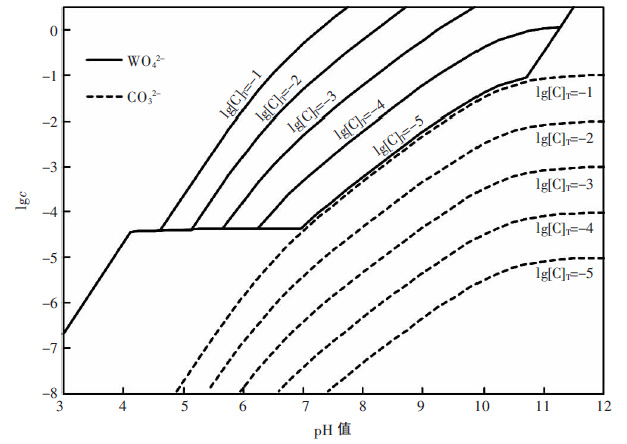 |
| 图 3 不同总碳浓度时钨酸根和碳酸根的lgc-pH 图(25 ℃) |
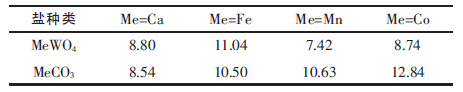
由图 2 可见,总碳浓度为1×10-5 mol/L、pH 值大于7.0 时,钨酸钴便可分解为碳酸钴,此后,钨酸根浓度随着pH 值升高而升高; 而当pH 值超过10.7 时,碳酸钴不能稳定存在,其将与碱反应生成氢氧化钴沉淀,这时,体系实际上进入碱分解阶段,碳酸根不起分解作用.表 3 列出了钙、铁、锰、钴的钨酸盐和碳酸盐的溶度积常数.通过对比,可以看出,碳酸钴的溶度积远小于钨酸钴的溶度积,表明钴的碳酸盐比其钨酸盐更为稳定.文献[15]对碳酸钠分解钨酸钙、钨酸亚铁和钨酸锰进行了热力学分析.相比而言,在相同总碳浓度下,钨酸钴分解为碳酸钴的起始pH 值更低. 这表明,在热力学上钨酸钴更易被碳酸盐分解.
| 表3 部分钨酸盐和碳酸盐的溶度积常数pKsp |
 |
| 点击放大 |
如图 3,pH 值对碳酸盐分解钨酸钴具有显著影响.溶液中钨酸根和碳酸根的浓度在弱碱性区域变化趋势一致,均随着pH 值升高而升高.这是由于pH 值过低,碳酸根将水解为碳酸氢根而失去分解钨酸钴的作用;但若pH 值过高,碳酸钴将与碱反应转变为氢氧化钴,使碳酸根起不到分解作用.因此,如果采用碳酸盐为分解试剂,体系仍需加入一定量的碱,使pH值控制在一定范围之内.由图 3 可见,当总碳浓度为1×10-1 mol/L、pH 值大于7.3 时,溶液中钨酸根浓度便可达1 mol/L,这表明,碳酸盐分解钨酸钴的热力学趋势较大,反应后溶液不必维持较高的总碳浓度,因而,可采用较低碳酸盐的过量系数.
4 结论(1)运用现有热力学数据,计算得钨酸钴和钨酸的溶度积常数pKsp分别为8.74 和12.68.基于同时平衡原理,计算并绘制了25 ℃下Co-W-H2O 体系各溶解组分的lgc-pH 图,总碳浓度为1×10-5 mol/L 时 Co-W-C-H2O 体系各溶解组分的lgc-pH 图以及不同总碳浓度时平衡后钨酸根和碳酸根的lgc-pH 图.
(2)由Co-W-H2O 体系的热力学分析可知,钨酸钴在中性溶液中稳定存在,采用酸分解或碱分解的方式,均能有效地分解钨酸钴,并实现钨和钴的分离.当 pH 值小于4.1 时,钨酸钴便可分解为钨酸,溶液中钴含量随着酸度增加而上升;而当pH 值大于9.1 时,钨酸钴可分解为氢氧化钴,溶液中钨含量随着碱度增加而上升.
(3) 由Co-W-C-H2O 体系的热力学分析可知,pH 值对碳酸盐分解钨酸钴影响较大.pH 值过低,碳酸根将水解为无分解作用的碳酸氢根;pH 值过高,碳酸钴将与碱反应生成为氢氧化钴而不能稳定存在.此外,与碳酸盐分解钨酸钙、钨酸亚铁、钨酸锰相比,碳酸盐分解钨酸钴的热力学趋势较大,分解反应可在较低碳酸盐过量系数下完成.
| [1] | 李洪桂, 羊建高, 李昆, 等. 钨冶金学[M]. 长沙: 中南大学出版社 , 2010. |
| [2] | 林伯颖. 简述我国硬质合金工业发展趋势[J]. 中国钨业, 2006, 21(1): 5–6. |
| [3] | 张文朴. 钨资源综合利用与再生研发进展评述[J]. 中国资源综合利用, 2006, 24(9): 3–6. |
| [4] | 夏文堂. 钨的二次资源及其开发前景[J]. 再生资源研究, 2006(1): 11–17. |
| [5] | 陈立宝, 贺跃辉, 黄伯云, 等. 钨合金废料的资源再生利用技术[J]. 粉末冶金材料科学与工程, 2002, 7(1): 38–49. |
| [6] | 胡宇杰, 孙培梅, 李洪桂, 等. 废硬质合金的回收再生方法及研究进展[J]. 稀有金属与硬质合金, 2004, 32(3): 53–57. |
| [7] | 陈颢, 李剑波, 羊建高. 硬质合金回收研究进展及发展趋势[J]. 有色金属科学与工程, 2012, 3(5): 18–22. |
| [8] |
Basu S N, Sarin V K. Oxidation behaviour of WC-Co[J].
Materials Science and Engineering A, 1996, 209(1): 206–212. |
| [9] |
Gu W H, Jeong Y S, Kim K, et al. Thermal oxidation behavior of WC-Co hard metal machining tool tip scraps[J].
Journal of Materials Processing Technology, 2012, 212(6): 1250–1256. DOI: 10.1016/j.jmatprotec.2012.01.009. |
| [10] |
Sleight A W. Accurate cell dimensions for ABO4 molybdates and tungstates[J].
Acta Crystallographica Section B, 1972, 28(10): 2899–2902. DOI: 10.1107/S0567740872007186. |
| [11] | Barin I. Thermochemical data of pure substances[M]. 3rd edition. Weinheim: Verlagsgesellschaft mbH , 1995. |
| [12] | Speight J G. Lange’s handbook of chemistry[C]//16th Edition.New York : McGraw-Hill Professional, 2005. |
| [13] | 林传仙, 白正华, 张哲儒. 矿物及有关化合物热力学数据手册[M]. 北京: 科学出版社 , 1985: 36. |
| [14] | Martell A E, Smith R M. Critical stability constants volume 5[M]. New York: Plenum Press , 1982: 393. |
| [15] | 赵中伟. 钨冶炼的理论与应用[M]. 北京: 清华大学出版社 , 2013: 75-90. |
 2013, Vol. 4
2013, Vol. 4


