| Na2WO4与CaWO4在电解制钨过程中的解离及离子运动形式分析 |
目前,国内外从黑、白钨精矿到制取金属钨粉的工业生产过程主要采用湿法冶金路线,即:钨精矿的酸、碱分解制取钨酸钠→通过离子交换或萃取等转型制成仲钨酸铵(APT)结晶→煅烧制取三氧化钨并用氢气还原获得金属钨粉[1],而只要采用酸碱分解→转型工艺,就会产生废水排放的问题.国家环境保护部于2008 年3 月发布的新规,钨冶炼为一类元素排放废水,强制执行零排放要求.随着国家环保政策日趋严厉,现行的钨冶炼工艺面临的形势非常严峻[2].因此,实现钨与杂质的绿色分离和废水零排放的无酸碱钨冶炼工艺,火法直接制取钨粉的方法进入了国内外学者的视线[3-4].其中,由于熔盐电解法在制备金属及其合金方面具有设备的资源占用少,工艺操作简单,同时对环境的副作用小[5-8]的独特优势和潜力而备受科研工作者的关注.
作者采用熔盐电解法以钨酸钠或钨酸钙为活性物,以CaCl2、NaCl、KCl 混合熔盐体系为电解质,直接电解制取金属钨粉,通过对产物的表征及电解过程动力学机理的初步研究,取得了一系列研究成果[9-12],目前的研究将(Na2WO4或CaWO4)-(CaCl2、NaCl、KCl)熔盐中适合的体系按活性物分为两大部分,即:Na2WO4或CaWO4系统.为了进一步深入探索Na2WO4或 CaWO4在体系中的电解机理,对电极过程有更确切的认识,有3 个问题必须回答,即:电解过程中主要的活性基团种类、活性基团解离方式、活性离子的运动形式.本文主要采用(Na2WO4或CaWO4)-(NaCl、KCl)体系,通过实验及理论分析来研究Na2WO4和CaWO4两种钨酸盐在电解过程中的活性基团解离及离子运动形式及作用机理.
1 实验 1.1 实验装置实验装置如图 1 所示,采用耐腐蚀密封不锈钢管作为反应器,内置盛装电解原料的刚玉坩埚,采用铜作为电极引线,通入经过净化的氩气为保护气,阴、阳极根据实验要求选用.
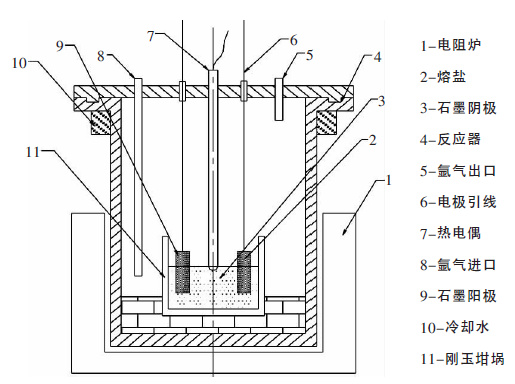 |
| 图 1 实验装置示意图 |
1.2 实验方法
实验原料: 分析纯NaCl、KCl、CaWO4、Na2WO4粉末150 ℃烘干24 h 备用.由文献[13]提供的数据得到实验体系中物质的相关物理化学参数列于表 1.
| 表1 实验体系中物质的相关物理化学参数 |
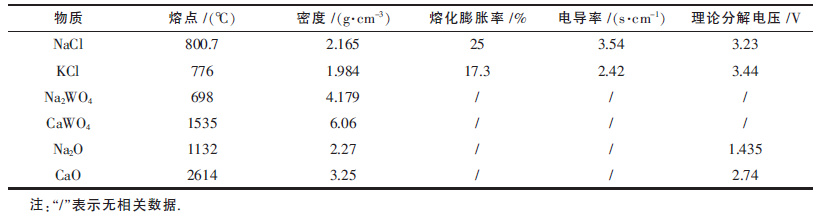 |
| 点击放大 |
实验1:取KCl-NaCl(质量比1∶1),30 g Na2WO4充分混合;直径10 mm 石墨棒为阳极,直径5 mm 石墨棒为阴极;在温度750 ℃和槽电压2.5 V 条件下电解,取2 h 后阴极周围富集物,经热蒸馏水清洗后取不溶物,再经稀氢氧化钠溶液清洗烘干得到阴极产物.实验过程中出口尾气经酸碱试纸检验其酸碱性,随后,将尾气通入澄清的石灰水和硝酸银溶液以定性检测气体成分中是否存在氯气.
实验2:取KCl-NaCl(质量比1∶1); 30 g CaWO4;直径10 mm 石墨棒为阳极,直径5 mm 铜丝为阴极;在温度750 ℃和槽电压2.5 V 条件下电解,分别取2 h、5 h 后阴极周围富集物经定量热蒸馏水清洗(清洗液经酸碱指示剂检验并通入CO2气体),阴极不溶物经稀氢氧化钠清洗烘干.实验过程中出口尾气经酸碱试纸检验其酸碱性,随后分别通入澄清的石灰水和硝酸银溶液检测气体成分中是否存在氯气.采用瞬时断电法估测系统电解过程的极化电压.
上述实验产物采用Miniflex 型X 射线衍射分析仪进行XRD 分析.
2 结果与讨论 2.1 实验产物及过程的表征图 2为NaCl-KCl-Na2WO4体系产物XRD 谱(图 2 中1# 和2# 谱线分别对应石墨阴极和铜阴极产物).1# 谱线表明在实验1 条件下阴极产物中存在单质W,但同时存在相当多份额的W2C、C、WC 杂质.石墨晶体是由碳原子组成的六角环形层状叠合体,无论是天然石墨还是人造石墨,由于机械的和化学的原因,在石墨晶体的六角环状网格边缘和孔洞之中,都存在不同的缺陷,而使石墨的表面呈不规律形状.文献[14]表明:石墨阳极中的孔隙彼此相互连通,形成复杂空间孔隙网.石墨电极表面的性质不是完全单一,有结合不太紧密的石墨颗粒出现,也有微小的表面突起形成尖端的过电压,成为活性部位.在实验1 过程中观测到阴极周围存在较为强烈的放电,取出阴极收集产物时均发现阴极已破碎,说明在电解过程中活性很高的K+在尖端活性部位易放电,使其周围的石墨极颗粒受应力不平衡而发生物理破损.脱落的石墨扩散到电解体系中,部分由于电吸附作用容易在阴极周围富集,进而与W 作用形成W2C、WC.2# 谱线表明采用金属铜为阴极有效避免了阴极破碎而带来的杂质,得到了较纯净的单质钨.热蒸馏水清洗液经酸碱指示剂检验为强碱性,通入CO2后未见明显变化.氩气出口尾气为弱酸性,通入石灰水后有白色沉淀生成,加入盐酸白色沉淀溶解,尾气通入硝酸银后未见沉淀物生成,可以推断阳极产物中有CO2的存在,熔盐保持着稳定,没有Cl2生成.同样,阳极损耗较大.
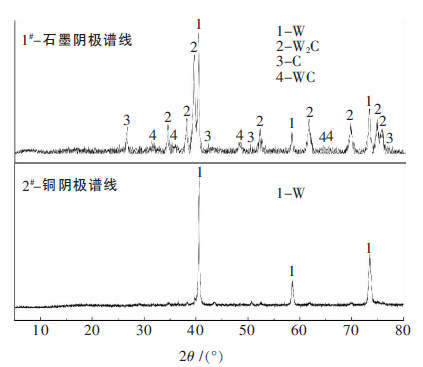 |
| 图 2 实验1 阴极产物XRD 谱 |
图 3为实验2 的产物XRD 谱.电解2 h 后阴极周围存在CaWO4,经过5 h 电解产物基本相组成为 W.阴极清洗液和尾气及阳极的表征结果与实验1 结果类似,阳极产物中有CO2的存在,熔盐保持着稳定,未见Cl2生成,阳极损耗严重.
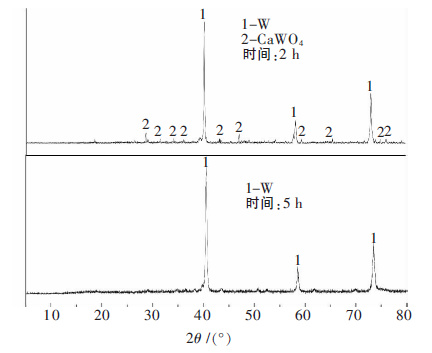 |
| 图 3 实验2 阴极产物的XRD 谱 |
2.2 电极过程的对比分析
根据实验的表征结果和文献[15]提供的数据和表 1 中实验体系中物质的相关物理化学参数.对 Na2WO4和CaWO4的活性基团解离及离子运动形式及作用机理做如下分析:
图 4为NaCl-KCl-Na2WO4体系电极过程的示意图.温度达到750 ℃时,NaCl-KCl 混合盐已熔化,Na2WO4也达到熔点,应以Na+和WO42-状态存在于熔体中,其中WO42-与2 个钠离子离解后呈图 4 中所示的平面结构,空间为正四面体结构.由于NaCl-KCl是作为电解质在体系中含量较多,决定了整个体系的电导率,二者同为碱金属卤化物,为二元共晶体系,在质量比1∶1 状态下电导不会低于KCl,电导率一定高于2.42 s/cm,导电性能较好.对比熔融NaCl、KCl 和 Na2WO4的密度及熔化膨胀率可以判断,在静置状态下,WO42-与其配位的Na+会沉降在电解槽底部,不会自动扩散至电极周围.
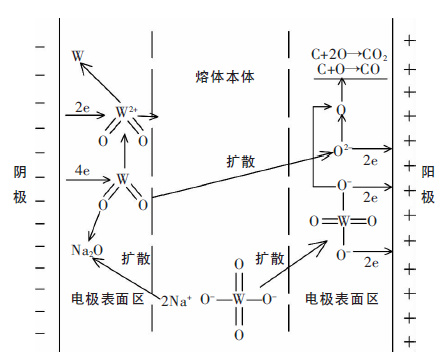 |
| 图 4 Na2WO4体系电极过程示意图 |
当2.5 V 槽电压加至电极两端,电流通过开始搅拌熔体,Na+在电极作用下向阴极移动,富集在阴极表面区,WO42-开始向熔体本体扩散,在电极作用下向阳极移动,到达阳极表面区后,根据实验2 的表征结果,NaCl-KCl 保持稳定,阳极气体中有CO2的存在,其中的C 只能来源于被损耗的碳质阳极,而O 则来源于WO42-,由于脱离了Na+两个氧原子活性较强,优先会进行电子传递形成O 原子,进而与电极作用会形成CO2或CO.脱离了两个氧原子的WO42-的存在形式为WO22+,在电极和扩散作用下向阴极移动,到达阴极表面区后,能够在电极表面还原而最终生成单质钨(以WO3和WO2来计算,W6+和W4+的还原电位分别为-0.98 V 和-1.02 V),部分离解出的自由O2-会与熔体中富集的Na+配位形成Na2O,部分过剩的氧离子则扩散至阳极参与阳极过程.从前述表征结果可以知道阴极清洗液为强碱性,表明阴极周围在电解过程中一定存在碱金属元素的富集,表 1 数据虽然表明在电解过程中Na2O 也可以在阴极还原出单质Na,但即使有单质Na 析出也会进一步发生后置反应生成W,最终阴极产物的表现形式为Na2O.
瞬时断电计量显示系统的极化电压为0.8~1.1 V,按式(1)可估算系统的电压损耗.
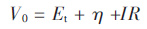
|
(1) |
式(1) 中V0为系统槽电压,Et为活性物理论分解电压,η 为极化电压,I 为断电前系统的整体电流,R 为断电前系统的电阻.此时V0=2.5 V,Et=0.98~1.02 V,η=0.8~1.1V,因此IR=0.38~0.44V,占总电压的15.2 %~17.6 %,说明系统的电极极化的阻力较大,但还不能具体确定电极反应速度、浓差极化、化学极化的动力学参数,只能推测在电极过程中存在两级间O2-的反复扩散,电极的浓差极化应该是电解的控制步骤.
图 5为CaWO4体系电极过程的示意图.碱金属卤化物与碱土金属卤化物形成的体系多形成一个化合物,NaCl-KCl 体系在含50 % NaCl 摩尔分数时会生成NaCl·KCl,生成NaCl·KCl 的反应对支持电解质 NaCl-KCl 的组分有一定的影响,偏离了摩尔比1∶1,但偏移量小,不会对体系混合盐的导电性产生太大影响.表 1 的数据表明参加反应的KCl 体积膨胀率低,不会对体系混合盐的密度影响很大.体系中的CaWO4有高熔点和高密度,作为独立的分子团沉降在电解槽的底部,另外CaWO4的分子结构也将发生变化,不会像 Na2WO4形成自由的WO42-.当2.5 V 槽电压加至电极两端,电流通过开始搅拌熔体,CaWO4在搅拌作用下向熔体本体扩散,由于CaWO4可视为中性分子团,向两极移动的几率相同,富集在阴极表面区的CaWO4分子团中在2.5 V 的电位下只有钨为活性点,将CaWO4等价为CaO·WO3则便于理解,由于CaO(理论分解压2.74V) 稳定,WO3经过电子传递还原为单质W,离解的O2-向阳极扩散,随后生成O 原子与电极作用生成阳极气体CO2或CO.同时,扩散至阳极表面区的CaWO4分子团中的氧失去电子,脱离了一个氧原子的CaWO4分子团分解为CaO 和WO22+,WO22+在电极和扩散作用下向阴极移动,和NaCl-KCl-Na2WO4体系类似,WO22+在电极表面还原而最终生成单质钨,部分离解出的自由O2-会扩散回阳极参与阳极过程.
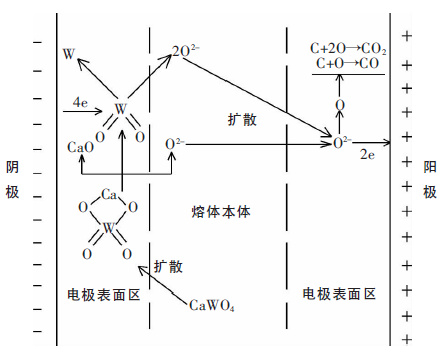 |
| 图 5 CaWO4体系电极过程示意图 |
瞬时断电计量显示系统的极化电压为1.0~1.3 V范围内,同样按式(1)估算系统的电压损耗.电路的消耗电压占总电压的7.2 %~16.8 %,说明系统的电极极化的阻力比NaCl-KCl-Na2WO4体系更大,电极的浓差极化仍是电解的控制步骤.
3 结论(1)以Na2WO4为活性物,在温度750 ℃,槽电压2.5 V 下,在NaCl-KCl 体系采用碳质和非碳质电极材料均可在阴极制备出单质钨粉,但是采用金属制阴极可以有效避免活性的K+对电极的破坏,获得的产物也更理想.
(2)Na2WO4和CaWO4在NaCl-KCl 熔体中的电解机制不同,Na2WO4以Na+和WO42-为活性离子基,而CaWO4可视为中性分子团,其中的活性基团可近似为CaO·WO3.电极的浓差极化仍是Na2WO4和CaWO4 电解过程的主要控制步骤.
| [1] | 李洪桂, 羊建高, 李昆. 钨冶金学[M]. 长沙: 中南大学出版社 , 2010: 1-3. |
| [2] | 万林生. 钨冶金[M]. 北京: 冶金工业出版社 , 2011: 1-15. |
| [3] |
Fray D J. Emerging molten salt technologies for metals production[J].
JOM, 2001, 53(10): 27–31. |
| [4] |
Omel’chuk A A. Electrorefining of heavy nonferrous metals in molten electrolytes[J].
Russian Journal of Electrochemistry, 2010, 46(6): 680–690. DOI: 10.1134/S1023193510060133. |
| [5] |
Tripathy P K, Gauthier M, Fray D J. Electrochemical deoxidation of titanium foam in molten calcium chloride[J].
Metallurgical and Materials Transactions B, 2007, 38(6): 893–900. DOI: 10.1007/s11663-007-9094-6. |
| [6] |
Mohandas K S, Fray D J. Electrochemical deoxidation of solid zirconium dioxide in molten calcium chloride[J].
Metallurgical and Materials Transactions B, 2009, 40(5): 685–699. DOI: 10.1007/s11663-009-9263-x. |
| [7] | 邓丽琴, 许茜, 李兵, 等. 电脱氧法由Nb2O5直接制备金属铌[J]. 中国有色金属学报, 2005, 15(4): 541–545. |
| [8] |
Erdoĝan M, Karakaya I. Electrochemical reduction of tungsten compounds to produce tungsten powder[J].
Metallurgical and Materials Transactions B, 2010, 41(4): 798–804. DOI: 10.1007/s11663-010-9374-4. |
| [9] | 王旭, 廖春发, 杨文强, 等. CaWO4-NaCl-CaCl2体系熔盐电解制备钨粉的表征与电化学分析[J]. 中国有色金属学报, 2012, 22(5): 1482–1487. |
| [10] | 王旭, 廖春发, 汪浩. NaCl-CaCl2-Na2WO4体系电解制备钨粉过程表征[J]. 北京工业大学学报, 2012, 38(6): 938–954. |
| [11] | 王旭. 一种熔盐电解制备钨基合金粉末的方法: 中国, ZL 2010105274349[P]. 2012-04-18. |
| [12] | 廖春发. 一种熔盐电解制备钨粉的方法: 中国, ZL 2010105274495[P]. 2012-07-04. |
| [13] | 梁英教, 车荫昌. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社 , 1993: 16-42. |
| [14] | 张明杰, 王兆文. 熔盐电化学原理与应用[M]. 北京: 化学工业出版社 , 2006: 1-10. |
| [15] | 阿伦.J. 巴德, 拉里.R. 福克纳. 电化学原理: 方法与应用[M]. 北京: 化学工业出版社 , 2005: 121-138. |
 2013, Vol. 4
2013, Vol. 4

