| NaCl-CaCl2-CaWO4熔盐体系电导率的研究 |
钨以其优异的物理化学性能,在国民经济中的使用范围愈来愈广.目前工业上由黑、白钨原矿制取钨粉的过程较长,又不可避免的出现废水排放问题.2008 年国家相关政策出台,强制要求钨冶炼废水达到零排放.因此,在冶金工业发展要求短流程、低成本、环境友好的大趋势下,许多学者一直在探索其它的工艺方法来解决日益面临的资源与环境问题.采用熔盐电解法制取钨粉的研究一直没有间断,笔者曾提出采用钨酸盐(主要是钨酸钙或钨酸钠)为活性物质一步直接电解制取钨粉,能大幅度缩短现有的工艺流程,降低生产成本,提高钨资源的利用率.笔者的前期研究采用NaCl-CaCl2-CaWO4熔盐体系电解能够获得纯度99 %的钨粉,关于NaCl-CaCl2-CaWO4熔盐体系物理化学性质的研究,对深入研究其电解机理非常重要,电导率作为重要的物理化学参数之一,对熔盐电解选择最佳电解质及电解温度等具有重要指导意义.熔盐导电能力差,会导致大量的电能消耗在熔盐体系本身的电阻上,使电能效率大幅降低,而其产生的热量会使电解温度升高,导致熔体的挥发损失增加,进而使熔体组分发生变化,迫使电解生产无法长时间进行[1-3].此外,通过对熔盐电导率的研究,可以间接地了解熔盐体系的离子结构,更好地了解离子迁移过程机理.因此,电导率的研究不仅对工业生产有重要意义,还有助于熔体理论的分析[4-6].文章主要通过连续变化电导池常数法(CVCC)[7-8]测定了该体系的电导率.并利用正交试验方法,分析熔盐组分摩尔比和温度对电导率的影响,为进一步研究NaCl- CaCl2-CaWO4熔盐体系电解制备钨粉的工艺及理论奠定基础.
1 实验 1.1 实验原料及设备本实验使用的NaCl、CaCl2、CaWO4均为分析纯试剂,使用前按照实验方案准确称量后放入坩埚中混合均匀,于120 ℃下烘干16 h[9].采用东北大学制造的 RTW-08 熔体综合物性测定仪测定电导率,测定方法为交流阻抗谱法,主要设备参数为:高温炉控温区间为室温到1 200 ℃;恒温区长度>50 mm;测温热电偶和温度变送器精度为±0.5 %[10].所用的实验装置如图 1 所示.
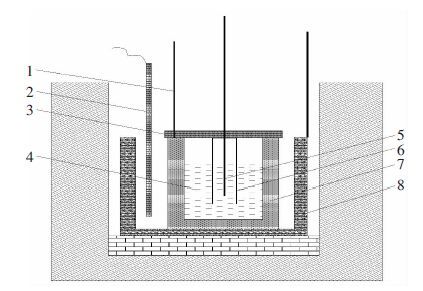 |
| 1.不锈钢杆;2.控温热电偶;3.石墨盖;4.熔盐;5.铂丝;6.氮化硼管;7.石墨坩埚;8.不锈钢坩埚 图 1 实验装置示意图 |
实验采用双电极体系,其中工作电极为1 根位置固定的铂丝;参比电极和对电极同为连有不锈钢杆的石墨坩埚,电极与BN 管一起组成毛细管电导池,石墨坩埚的位置可以随炉体通过自动升降装置精确地上下移动,使其与铂丝电极的相对位置发生变化,从而改变电导池的长度.将电路连接到Autolab PGSTAT30恒电位仪上(BOOSTER 20 A 电流扩展),交流频率信号的施加和阻抗记数均由电脑控制,电压微扰为10 mV,施加的频率范围为10~100 kHz,读取不同条件下的阻抗值.
电导池的内截面积通过测定800 ℃下KCl 熔盐的电导率(2.25 S/cm)来标定,测定结果如图 2 所示.
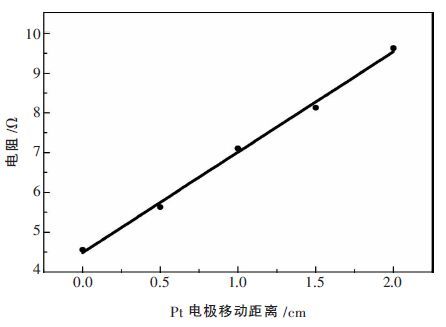 |
| 图 2 熔盐体系电阻与电导池长度变化关系图 |
熔盐体系电阻与电导池长度变化关系为:Y=4.484+2.527 3X,其中Y 为熔盐电阻,X 为参比电极移动距离(单位:cm),相关系数R=0.995 12.将斜率 dRm/dL=2.527 3 代入式(1)求得此处A=0.179 5 cm2.进而通过式(1)进行电导率计算[11].
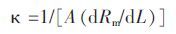
|
(1) |
其中:κ 为电导率;dRm/dL 为电阻随参比电极移动距离变化斜率;A 为电导池内截面积.
1.2 实验方法熔盐电导率一般受温度和电解质成分影响,因此,本文通过2 因素3 水平正交试验分析,研究NaCl-CaCl2-CaWO4熔盐体系电导率与温度和NaCl 对CaCl2摩尔比的关系,温度选定700 ℃、750 ℃、800 ℃ 3 个水平;NaCl 与CaCl2摩尔比选定6∶4、5∶5、4∶6 共3 个水平,在CaWO4过饱和条件下,按照正交表L9(34)安排实验.尽管实验只考虑了2 个因素,按正交设计达不到减少实验次数的目的,但可以通过这种方法进行相应的数据处理,以了解温度和熔盐组分摩尔比这两个因素对熔盐体系电导率影响程度的相对大小.
2 实验结果与分析 2.1 正交试验结果以熔盐组分摩尔比、温度和熔盐体系电导率为指标,按照正交表L9(34)安排实验,实验安排及测定结果如表 1 所示.
| 表1 正交试验安排及结果 |
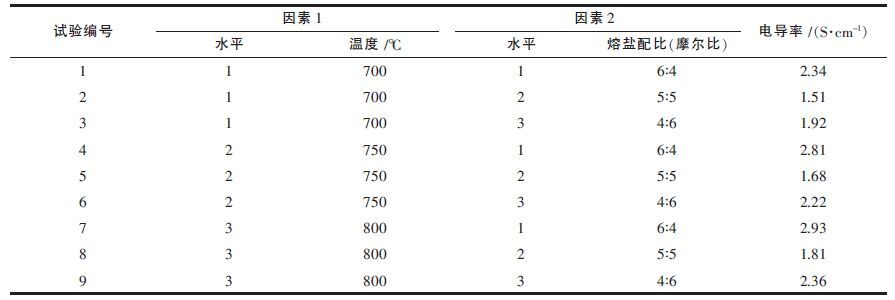 |
| 点击放大 |
2.2 极差分析
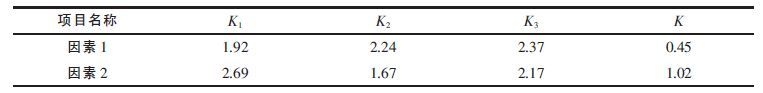
按照正交设计实验规律对表 1 中数据进行处理,所得数据见表 2,其中K1、K2、K3分别为各因素在不同水平下电导率的平均值.极差K 表示K1、K2、K3之间的最大差值.差值越大,表明该因素对熔盐体系电导率的影响越重要.
| 表2 极差分析结果 |
 |
| 点击放大 |
由表 2 可知,熔盐组分配比对熔盐体系电导率的影响要强于温度对其的影响.利用正交试验结果绘图,可进行直观分析.
图 3为温度和熔盐配比对电导率的影响.从图 3结果看出,CaCl2-NaCl-CaWO4体系电导率随温度的增加而增加,这是因为温度升高,粒子的热运动加快,当粒子的动能超过其活化能时,粒子将离开平衡位置运动,这种运动会导致电导率有所降低,但由于熔盐体系是正负离子组成的离子体系,在该体系中,粒子动能的增加会使异号离子之间的键能减弱,从而使离子的定向迁移更容易进行[12].此外,高温条件下络合离子的解离度也会增大,体系中的自由离子将增多,这些因素都会对电导率有较大的贡献,因此温度升高会导致电导率增大.在相同的温度下,NaCl与CaCl2的摩尔比为1∶1 时相对电导率较低,对比纯 NaCl(805 ℃下电导率为3.54 S/cm)和CaCl2(800 ℃下电导率为2.02 S/cm),可以看出在CaCl2-NaCl 混合状态下,熔盐电导率应存在一个最低值,而本实验结果可推断出最低值应该在NaCl 与CaCl2的摩尔比为1∶1 附近.
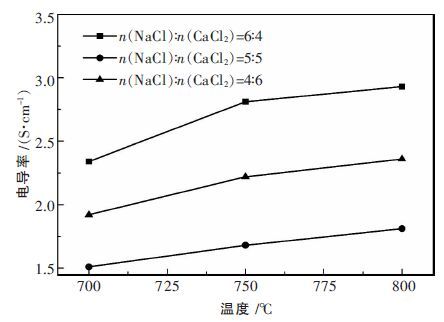 |
| 图 3 温度及熔盐配比对 CaCl2-NaCl-CaWO4体系电导率影响 |
研究混合熔盐电导也与研究其他的熔盐性质一样,常常与相应的熔度图联系起来进行比较,为更好地说明电导率与熔度图的关系,将800 ℃下熔盐电导率和熔度图合并在一起,图 4 为800 ℃下熔盐体系电导率与熔度图.
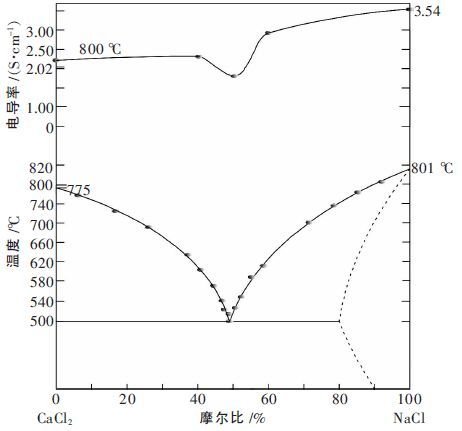 |
| 图 4 800 ℃下熔体的电导率与熔度图 |
由碱金属卤化物与碱土金属卤化物形成的体系,多形成具有一个化合物的二元系熔度图,在这种体系中电导往往有最低点[13],由图 4 可以看出,在最低共熔点附近电导率也出现了最低值,说明本体系遵守该条规律.但值得注意的是,CaCl2-NaCl 熔盐体系属于共晶型熔体,并不存在包晶反应,而且颇具争议的4NaCl·CaCl2也被学者证明不存在于该体系中[14-15].根据本实验结果推断,在最低共熔点附近并没有形成新的化合物,而是形成了一种共融混合物,混合物中的两相分子通过搭桥连接且微观结构没有纯的NaCl或CaCl2那么致密,因为熔盐中各种物质的离子大小及电荷属性都不同,排列就更加混乱,使络合离子的解离度降低,体系中自由离子减少,从而导致电导率降低.当两者摩尔比偏离最低值附近时,熔体中NaCl含量对熔体电导率影响起到了主要作用,分析原因认为,在最低值附近,如果增加NaCl 的比例,Na+的比例会增加;增加CaCl2的比例,Cl-的数量增多,熔体中负离子的迁移数增大,从而使导电性增强.而且Na+导电性要强于Ca+,因此当熔体中Na+含量较多时,体系电导率相对较大.
此外根据笔者前期研究结果可知:CaWO4在 NaCl+CaCl2体系中的溶解度很低,只有2 %左右.其溶解过程包括物理溶解和化学溶解两部分,其中物理溶解后的CaWO4是以分子形式存在的,不会对电导率产生影响; 化学溶解后生成的WO42-稳定性较好,即其中的O 不会被Cl 替换[16].而本研究认为熔盐体系导电主要受Na+和Cl-控制,因此,CaWO4化学溶解后产生的微量Ca+和WO42-不会对体系电导率产生过多的影响,固在本实验中不予讨论.
3 结论(1)当熔盐组分摩尔比相同时,CaCl2-NaCl - CaWO4体系电导率随温度的增加而增大.
(2) NaCl 和CaCl2的摩尔比对熔盐体系电导率的影响比温度对其的影响更强一些.
(3)当n(NaCl)∶n(CaCl2)为1∶1 时,即体系最低共熔点附近出现了电导率的最低值,随着NaCl 或 CaCl2的增加,电导率也增加.
(4)由于CaWO4的溶解度很低,因此溶解在熔盐中的CaWO4不足以对体系电导率产生过多的影响.
| [1] | 黄有国, 赖延清, 田忠良, 等. 高温熔盐电导率测试方法[J]. 轻金属, 2007(10): 33–37. |
| [2] | 曾水平, 蔡祺凤, 李荐, 等. 2.1NaF·AlF3-NaCl-MgF2熔盐体系初晶点及电导率的研究[M]. , 1994: 30-32. |
| [3] | 陈建设, 徐秀芝, 黄永春. NdF3-NaF-LiF熔盐电导率的研究[J]. 稀有金属与硬质合金, 1998(4): 28–30. |
| [4] | 高炳亮, 刘风国, 王兆文, 等. KNO3-NaNO2-NaNO3三元熔盐体系的电导率研究[J]. 东北大学学报: 自然科学版, 2010, 31(5): 696–699. |
| [5] | 吴其山. Nd2O3-NdF3-LiF熔盐体系中电导率及钕溶解度的测定[J]. 稀有金属与硬质合金, 2006, 34(1): 52–54. |
| [6] | 罗丽芬. 熔盐电导率的测试研究[J]. 铝镁通讯, 2008(1): 14–17. |
| [7] | 王兆文, 胡宪伟, 高炳亮, 等. CVCC法测定冰晶石系熔盐电导率的应用研究[J]. 东北大学学报: 自然科学版, 2006, 27(7): 786–788. |
| [8] | 胡宪伟, 王兆文, 高炳亮, 等. NdF3-LiF-Nd2O3系熔盐电导率的CVCC法研究[J]. 东北大学学报: 自然科学版, 2008, 29(9): 1294–1297. |
| [9] | 李运刚, 翟玉春, 王娜, 等. Na2WO4-ZnO-WO3熔盐体系的电导率[J]. 中国有色金属学报, 2005, 15(7): 1139–1144. |
| [10] | 何小凤, 李运刚, 李智慧. NaCl-KCl-NaF-SiO2熔盐体系电导率的研究[J]. 湿法冶金, 2010, 29(1): 12–15. |
| [11] |
YANG Shao-hua, YANG Feng-li, WANG Guo-cheng, et al. Effect of KCl on conductivity of BaF2-LiF-MgF2 molten salts[J].
Magnesium Technology, 2010(2): 111–114. |
| [12] | 孙本良, 翟玉春, 田彦文. NaCl-KCl(1∶1)-ScCl3体系电导率及初晶温度的测定[J]. 稀土, 1999, 20(2): 26–28. |
| [13] | 张明杰, 王兆文. 熔盐电化学原理与应用[M]. 北京: 化学工业出版社 , 2006: 34-35. |
| [14] | 乔芝郁, 杜爱玲, 莫雯静, 等. NaCl-CaCl2二元系的研究[J]. 稀有金属, 1989(1): 67–70. |
| [15] | 杜爱玲. NaCl-CaCl2二元相图测定[J]. 山东工业大学学报, 1988, 18(2): 95–97. |
| [16] | 王旭, 廖春发, 杨文强, 等. CaWO4-NaCl-CaCl2体系熔盐电解制备钨粉的表征与电化学分析[J]. 中国有色金属学报, 2012, 22(5): 1482–1487. |
 2013, Vol. 4
2013, Vol. 4

