| Mn对海水激活电池用AP65镁合金阳极材料电化学性能的影响 |
镁合金阳极材料由于具有激活快、电压范围广、能量密度大、相对密度较小、电极电位较负以及未被激活时存储时间长等优点[1-4],广泛应用于海水电池系统,如海底声音测试装置、潜水艇、警告浮标、球状电池和紧急救生设备等领域[5-8].镁合金海水电池采用活性较强的金属如镁合金作为阳极,采用AgCl、Cu2Cl2等惰性电极作为阴极,海水作为腐蚀电解液,通过镁合金在海水中的腐蚀溶解提供阳极电流,而阴极则主要依靠海水中的溶解氧在惰性电极上进行还原反应提供阴极电流[9-10].AP65是这些镁合金阳极材料中的一种,其名义成分为Mg-6 %Al-5 %Pb (质量分数).研究表明Al能提高镁合金在NaCl溶液中的表面活性并影响其耐蚀性[11-14],适量的Pb也能增强镁基体的活性[15],尽管Pb对环境存在污染.Udhayan等研究了AP65阳极在不同浓度的高氯酸镁溶液中的电化学行为,发现其电化学过程主要受活化反应控制[16].前期的研究工作表明,AP65阳极的活化机理为溶解-再沉积,且Al和Pb对镁基体的活化存在协同效应:放电过程中沉积在阳极表面的氧化铅能促进Al (OH)3的沉积,而Al (OH)3则以Al (OH)3·2Mg (OH)2的形式剥落Mg (OH)2腐蚀产物膜,对镁基体起到活化作用[17].
从热力学的角度讲,镁阳极应该具备较负的电极电位.但由于以下两个原因,导致镁阳极在实际应用过程中达不到热力学上较负的电位值:①镁阳极在放电过程中表面通常覆盖一层腐蚀产物膜,推迟其放电过程进入稳态并减小其放电速率;②镁阳极在放电过程中表面易发生自腐蚀反应,导致氢气的析出[3-4].一般来说有2种方法可以改善镁阳极的电化学性能,一种是通过合金化在镁阳极中加入合金元素,另一种是往电解液中加入添加剂.这两种方法能抑制镁阳极在放电过程中腐蚀产物膜的形成并减小其自腐蚀反应速率.Mn是一种能提高镁阳极性能的合金元素,Cao D X等研究了Mg-Li-Al-Ce-Zn和Mg-Li-Al-Ce-Zn-Mn阳极在NaCl溶液中的电化学氧化行为,发现Mn能阻止放电过程中氧化膜在阳极表面的形成并加速氧化产物的剥落[3].此外,Mn还能抑制氢气的析出,提高阳极的使用效率[3].前期的研究工作表明,在未放电的条件下Zn和Mn能缩短AP65阳极在NaCl溶液中的腐蚀孕育期并促进氢气的析出[18].这说明Zn和Mn共同加入到AP65阳极中能缩短放电电位达到稳态所需的时间,但会加速其自腐蚀反应,降低其使用效率.因此,AP65阳极的电化学性能有待提高.目前关于添加Mn的AP65阳极放电行为的报道较少,且Mn对AP65阳极在NaCl溶液中的活化机理还不是很清楚.本文作者研究Mn的单独加入对AP65阳极放电行为的影响,目的在于提高AP65阳极的电化学性能,并分析在放电过程中Mn对AP65阳极的活化机理.
1 实验方法采用熔炼铸造法制备AP65镁合金阳极材料,其中未添加Mn和添加Mn的AP65阳极分别计为阳极A和阳极B.将高纯的Mg、Al、Pb (纯度99.99 %)和Al-30 %Mn (质量分数)合金按配比放入高纯石墨坩埚,在感应炉中于750 ℃熔炼,充氩气保护.金属熔体在氩气保护下浇铸于200 mm×150 mm×20 mm的铁模中,空冷至室温.采用原子吸收光谱测定阳极的化学成分,结果见表 1.所得试样在氩气保护下于箱式炉中400 ℃退火24 h,水淬.各试样经打磨抛光后,用1 %的硝酸酒精溶液作为金相侵蚀液揭示试样的晶界.采用Quanta-200扫描电镜背散射像观察试样的显微组织.采用能谱仪(EDX)分析添加Mn的AP65阳极试样中第二相的化学成分(未经过金相侵蚀).
| 表1 AP65阳极试样的化学成分/wt% |
 |
| 点击放大 |
采用IM6ex电化学工作站结合三电极体系测定各试样的电化学行为.其中,工作电极为AP65镁合金阳极,辅助电极为铂电极,参比电极为饱和甘汞电极.将各试样用同型号SiC砂纸打磨去除表面氧化层,保留其经打磨的工作面并使其呈10 mm×10 mm的矩形.然后用铜导线捆绑样品,非工作面用环氧树脂密封.电化学测试的温度为25 ℃,电解液为3.5 %(质量分数)的NaCl中性溶液,采用该电解液模拟海水[3-5].采用动电位极化扫描法研究AP65阳极的极化行为,其扫描速度为0.5 mV/s,电压范围为开路电位±0.8 V.采用交流阻抗法研究AP65阳极的电化学机理,其电位分别为开路电位(OCP)和开路电位+100 mV,电压振幅为5 mV,频率范围为100 kHz~0.05 Hz.采用恒电流极化法研究AP65阳极的恒电流放电行为,电流密度为180 mA/cm2,放电时间分别为5 s和600 s.试样放电5 s后,采用铬酸溶液清除其腐蚀产物,并采用扫描电镜背散射像和二次电子像观察试样放电5 s (不含腐蚀产物)和600 s (含腐蚀产物)后的腐蚀表面形貌.采用硝酸溶液溶解试样放电600 s后电解液中沉淀的腐蚀产物,然后用250 mL的容量瓶和去离子水将该电解液调至250 mL,采用原子吸收光谱测定该电解液中镁离子的浓度,从而得出AP65阳极各试样放电过程中溶解镁离子的多少.
采用化学浸泡法,通过测定试样浸泡过程中析出氢气的体积得出试样的自腐蚀速率.将各试样用同型号SiC砂纸打磨后,保留其经打磨的工作面并使其呈10 mm×10 mm的矩形,非工作面用环氧树脂密封.将试样浸泡在装500 mL 3.5 %NaCl溶液的烧杯中,温度为25 ℃,浸泡时间为72 h.在试样上方倒扣一个漏斗,漏斗上插有装满3.5 %NaCl溶液的滴定管.在浸泡过程中,从试样表面析出的氢气通过漏斗进入到滴定管中,逐渐取代滴定管中的NaCl溶液.通过读取滴定管中液面的高度随浸泡时间的变化规律,就能知道各试样的析氢规律.所有的电化学实验和化学浸泡实验都进行3次,以确保实验的可重复性.
2 结果与讨论 2.1 Mn对AP65阳极显微组织的影响由于AP65阳极的显微组织对其电化学性能有重要影响,因此,首先通过观察显微组织和鉴定第二相来分析AP65阳极的组织结构和电化学性能之间的关系.图 1(a)和(b)分别为阳极A和B的背散射像.从中可以看出阳极A和B都呈现出比较均匀的等轴晶,其大小分别为206.12 μm和118.35 μm.阳极B是添加了Mn的AP65阳极,因此可以得出Mn能细化AP65阳极的晶粒.S Liu等报道了Mn能细化掺杂了Al4C3的AZ91D镁合金晶粒,其晶粒细化的机制是以Al-C-O-Mn-Fe颗粒作为初晶α-Mg的形核中心,该颗粒被Al-C-O膜包围[19].Robson等发现细小的Mn颗粒能细化经过热轧后Mg-Mn二元合金的晶粒,原因在于该Mn颗粒能阻碍Mg-Mn合金的静态再结晶过程[20].在本文中,Mn以Al-30 %Mn中间合金的形式加入到AP65阳极中,其细化晶粒的机制可归因于Al-Mn熔体残渣中的ε-AlMn相,该相在熔体中相对稳定,且具有类似于α-Mg的密排六方结构,能作为α-Mg晶粒在凝固过程中非均匀形核的核心,因此能提高AP65阳极晶粒细化的效率[21-22].由图 1(b)可知,在阳极B中存在很多均匀分布在晶内和晶界的白色颗粒,采用能谱(EDX)分析这些颗粒的化学成分.大约5个颗粒已经过详细分析,发现其成分基本一致.具有代表性的第二相颗粒的EDX结果如图 1(c)所示,从中可以看出该白色第二相颗粒为Al-Mn颗粒,Al和Mn的含量分别为46.89 %和43.81 %(质量分数).
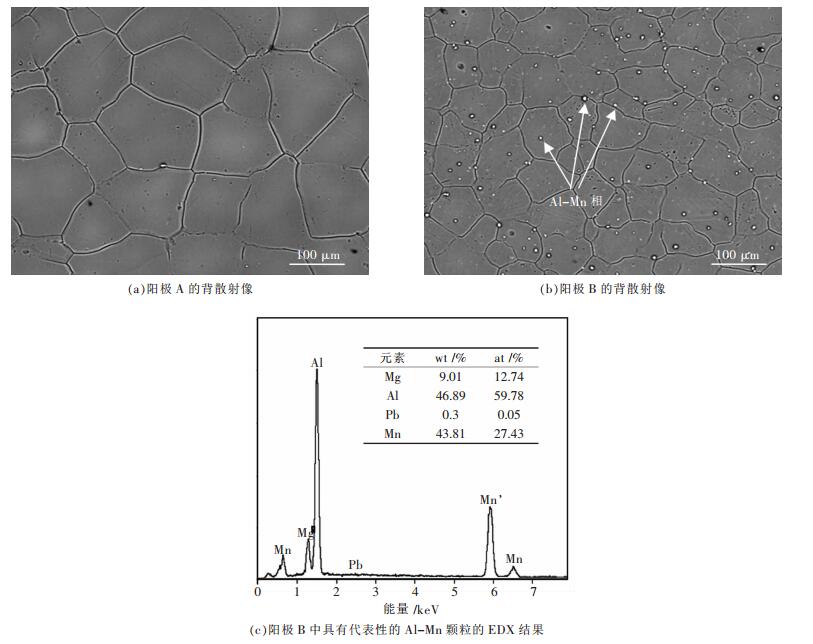 |
| 图 1 AP65阳极的背散射像和Al-Mn颗粒的EDX结果 |
2.2 Mn对AP65阳极动电位极化行为和恒电流放电行为的影响
图 2(a)所示为阳极A和B的动电位极化行为.该极化曲线能反映出试样在较大电压范围内的稳态电化学过程,对研究AP65阳极的极化行为有帮助.这些极化曲线的阳极支和阴极支不对称,阳极支电流密度随电位增加的速率明显大于阴极支.当电位比腐蚀电位(Ecorr)更负时,电极反应为析氢反应,形成阴极电流;当电位比腐蚀电位(Ecorr)更正时,电极反应为金属的阳极溶解反应,形成阳极电流.根据图 2(a)可知,阳极A和B呈现出不同的极化行为.在同一阴极电位下(横线所示),阳极B的阴极电流密度大于阳极A,表明在阴极极化过程中阳极B上的析氢速率大于阳极A.该现象可归因于阳极B中存在的Al-Mn颗粒,根据Merino等的研究结果可知Al-Mn颗粒的电位比镁基体高300 mV[23],因此可以作为强阴极相加速阴极反应过程中氢气的析出,使得阳极B在阴极极化过程中具有比阳极A更大的析氢速率.
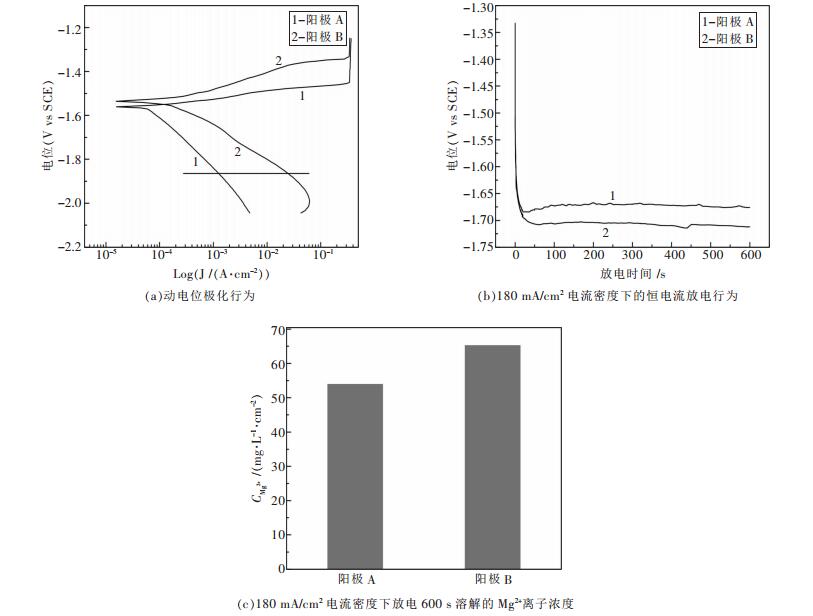 |
| 图 2 Mn对AP65阳极动电位极化行为和恒电流放电行为影响 |
图 2(b)所示为阳极A和B在180 mA/cm2电流密度下放电600 s的恒电流放电行为,在放电过程中黑色的腐蚀产物不断从试样表面剥落.两条放电曲线经过短时间放电后变得平坦,表明经短时间放电后腐蚀产物的形成、积累和剥落的动态平衡已建立,两个阳极试样的放电电位已进入稳态.根据图 2(b)可知,阳极B的平均放电电位为-1.71 V (相对于饱和甘汞电极),比阳极A更负(-1.66 V),表明阳极B与阳极A相比具有更强的放电活性.因此添加Mn的AP65阳极在放电过程中能提供更高的能量,适合用于海水电池系统的阳极材料.在相似的条件下,阳极B的平均放电电位接近于Mg-Ga-Hg阳极,比AZ31镁合金更负[10],表明添加Mn的AP65阳极适合用于海水电池系统.图 2(c) 所示为阳极A和B放电600 s后溶解的Mg2+离子浓度,这些浓度通过原子吸收光谱测得.镁阳极的放电活性可以根据放电过程中溶解的Mg2+离子浓度来衡量,Mg2+离子浓度越大则放电活性越强.根据图 2(c)可知,阳极B在放电过程中溶解的Mg2+离子浓度为65.2 mg/L,高于阳极A (53.92 mg/L),表明阳极B与A相比具有更强的放电活性,与两者的平均放电电位相符.这个现象可以归因于2个阳极材料不同的化学成分和显微组织.阳极B中添加的Mn能导致Al-Mn相的形成,该Al-Mn相可作为活性点加速放电过程.此外,阳极B中细小的晶粒和均匀的晶界同样有利于得到较负的放电电位[9].因此,AP65阳极的放电性能可以通过添加Mn来得到提高.
2.3 Mn对AP65阳极电化学阻抗谱的影响为了进一步研究添加Mn和未添加Mn的AP65阳极放电行为的不同,采用电化学阻抗谱研究这些阳极的放电行为,其不同电位下的Nyquist图如图 3所示.根据图 3(a)可知,开路电位下两个阳极在高频区存在一个较大的容抗弧,低频区存在一个较小的容抗弧.阳极A和B的开路电位分别为-1.71 V和-1.74 V (相对于饱和甘汞电极),表明单独添加Mn能使AP65阳极的开路电位负移,这与我们前期的研究结果不同.前期的工作表明Zn和Mn共同加入到AP65阳极中能使其在NaCl溶液中的开路电位正移[18].当电位比开路电位正100 mV时,各试样在高频区存在一个较大的容抗弧,在中频区存在一个感抗弧,在低频区存在一个较小的容抗弧(见图 3(b)).对每一个电位而言,高频区较大的容抗弧等价于双电层电容Cdl和电荷转移电阻Rt,与发生在电极和溶液界面的电化学反应有关,该电化学反应受电极电位控制.当电位比开路电位正100 mV时,中频区的感抗弧表明阳极表面存在局部腐蚀的孕育期[24-25].两个电位下低频区较小的容抗弧可归因于腐蚀产物如沉积在阳极表面的Mg (OH)2膜或逐渐增长的Mg (OH)2膜中传质物(如Mg+)的释放过程[3].该Mg (OH)2膜通过沉降反应形成,当阳极表面附近溶解的Mg2+离子浓度超过其溶解度极限时,将以Mg (OH)2的形式在阳极表面沉积[25].
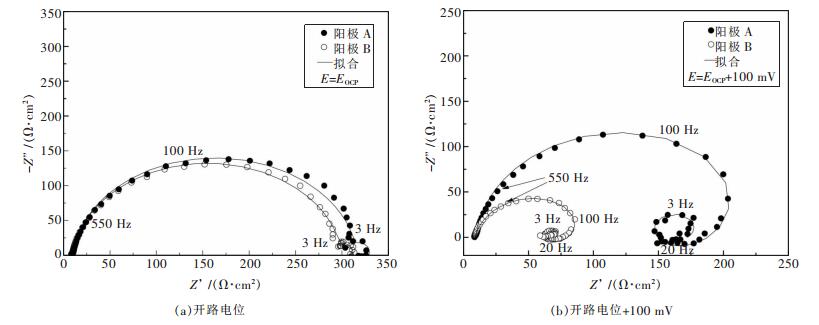 |
| 图 3 阳极A和B在不同电位下的电化学阻抗谱 |
镁阳极的放电活性能从电化学阻抗谱高频区容抗弧的直径反映出来,该直径的大小相当于电极系统的电荷转移电阻.直径越小,则镁阳极的放电活性越强.根据图 3(a)可知,阳极A和B在各自的开路电位下,高频区容抗弧的直径大小没有明显的区别,表明这两个阳极在开路电位下显示出相似的活性.当电位比开路电位正100 mV时(图 3(b)),2个阳极在高频区的容抗弧直径都减小,放电活性都得到提高.根据图 3(b)可知,阳极B的直径比阳极A小得多,表明在阳极极化电位下阳极B与A相比表现出更强的活化行为.这说明合金元素Mn在阳极极化条件下能显著提高AP65阳极的放电活性.各阳极不同电位下的电化学阻抗谱经拟合得到的电化学参数列于表 2和表 3,对应的等效电路见图 4. 2个阳极在相同的电位下具有相同的等效电路,表明2个阳极在同一条件下遵循相同的电化学反应步骤.在图 4中,Rs是溶液电阻,RL是感抗电阻,L是感抗,与金属的溶解导致腐蚀产物膜的形成以及电解质中活性物质在阳极表面缺陷位置的吸附有关[24].Cf和Rf分别是Mg (OH)2膜的电容和电阻.由于电极系统存在不均匀性,双电层和Mg (OH)2膜的电容分别用常相位角原件CPEdl和CPEf取代.在表 2和表 3中,CPEdl-T和CPEf-T分别为双电层和Mg (OH)2膜的电容值,CPEdl-P和CPEf-P分别为双电层和Mg (OH)2膜的指数,用于补偿电极系统的不均匀性.根据表 2和表 3可知,2个阳极的Rt值均随电位的增加而减小,该现象对于阳极B而言更为明显.由表 3可知,阳极B的Mg (OH)2膜电阻值(Rf)为6 Ω·cm2,小于阳极A (20·Ω cm2),表明阳极B上的腐蚀产物在阳极极化过程中更容易剥落.因此,往AP65阳极中添加Mn能在阳极极化条件下提高其放电活性,同时加速腐蚀产物膜的剥落.
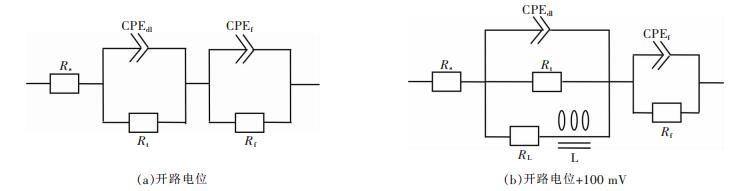 |
| 图 4 根据不同电位下阳极A和B的电化学阻抗谱得到的等效电路图 |
| 表2 根据拟合开路电位下阳极A和B的电化学阻抗谱得到的电化学参数 |
 |
| 点击放大 |
| 表3 根据拟合比开路电位正100 mV情况下阳极A和B的电化学阻抗谱得到的电化学参数 |
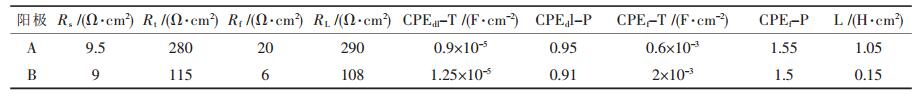 |
| 点击放大 |
2.4 Mn对AP65阳极析氢速率的影响
镁合金的自腐蚀速率能通过化学浸泡过程中析出氢气的体积来测定,用该方法得到的自腐蚀速率比用失重法和动电位极化扫描法得到的更为可靠[26].图 5所示为各阳极在3.5 %的NaCl溶液中浸泡时析出氢气的体积随浸泡时间的变化规律,其温度为25 ℃,浸泡时间为72 h.从图 5中可以看出,析出氢气的体积随浸泡时间的延长呈线性增加,在前10 h内两个阳极的析氢体积无较大的差别.随着浸泡时间的延长,阳极A上析出氢气的体积比阳极B大,表明Mn能抑制浸泡过程中氢气从AP65阳极表面析出,这与试样在阴极极化条件下得出的结果是不同的(见图 2(a)).因此,添加Mn能减小AP65阳极的自腐蚀速率,这一点与基于图 2(a)所示的极化曲线得到的自腐蚀速率相矛盾.所以测定镁合金的自腐蚀速率不能仅凭极化曲线,这一点与Song报道的AM70和AT72镁合金腐蚀行为一致[26].镁阳极的使用效率取决于其自腐蚀速率,自腐蚀速率越小则使用效率越高.因此,Mn能减小AP65阳极的自腐蚀速率并提高其使用效率.根据Yamauchi等的研究结果可知,位于Mg-1 %Mn-0.5 %Ca阳极晶界处的含Mn化合物(如Mn-Si-C)能作为局部阴极相加速镁阳极的自腐蚀反应,导致其电流效率的降低[27].在本文中,Al-Mn颗粒在AP65阳极中均匀分布(见图 1(b)),因此文献[27]中提到的局部阴极效应得到抑制,镁阳极的自腐蚀速率减小.此外,Mn能细化AP65阳极的晶粒(见图 1(b)),导致析氢过电位的增加和析氢速率的减小[3-4].因此,单独添加Mn能减小AP65阳极的自腐蚀速率,提高其使用效率.这一点与我们前期的研究结果不同,我们前期的研究表明Zn和Mn共同加入到AP65阳极中能增加其析氢速率并减小其使用效率[18].
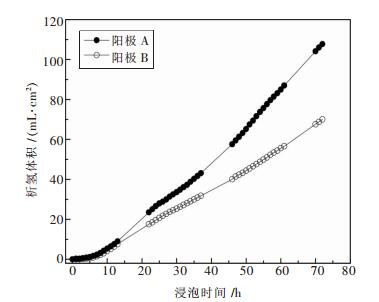 |
| 图 5 阳极A和B在25 ℃的3.5 %NaCl溶液中浸泡时析出氢气的体积随浸泡时间的变化规律 |
2.5 Mn对AP65阳极经恒电流放电后腐蚀表面形貌的影响
镁阳极在NaCl溶液中经恒电流放电后的腐蚀表面形貌能揭示其在放电过程中的活化机理.图 6(a)所示为阳极B在180 mA/cm2电流密度下放电5 s后腐蚀表面形貌的二次电子像,腐蚀产物已用铬酸溶液清除.从图 6(a)中可以看出在阳极B的表面分布着很多由腐蚀造成的小孔.此外,从图 6(a)还可以看出阳极B的表面有很多腐蚀坑,这些坑主要分布在Al-Mn颗粒的周围,是由Al-Mn颗粒和镁基体之间的微电偶腐蚀造成的,表明Al-Mn颗粒能作为活性点加速阳极的放电过程.一些Al-Mn颗粒在放电过程中已从阳极表面剥落,另一些颗粒仍处于基体中,这可以从图 6(b)所示的对应的背散射像明显看出来.均匀分布的Al-Mn颗粒由于具有比镁基体高300 mV的电极电位[23],在放电过程中能作为强阴极相或活性点加速镁基体的优先溶解,导致溶解的Al3+和Pb2+离子浓度增大并加速Al-Mn颗粒剥落,剥落的Al-Mn颗粒同样可以溶解在NaCl溶液中.溶解的Pb2+离子能以氧化铅的形式沉积在AP65阳极表面,这一过程有利于Al3+离子以Al (OH)3的形式沉积,而Al (OH)3则以Al (OH)3·2Mg (OH)2的形式剥落Mg (OH)2腐蚀产物膜,对镁基体起到活化作用[17].因此,添加Mn能提高AP65阳极的放电活性.图 6(c)所示为阳极A在180 mA/cm2电流密度下放电5 s的腐蚀表面形貌.可以看出阳极A在放电过程中遭受均匀腐蚀,由腐蚀造成的小孔均匀分布在阳极表面.微电偶腐蚀在阳极A中不存在,因此不能观察到镁基体的优先溶解,导致放电过程中阳极A溶解的Al3+和Pb2+离子浓度减小,放电活性相比阳极B较弱.
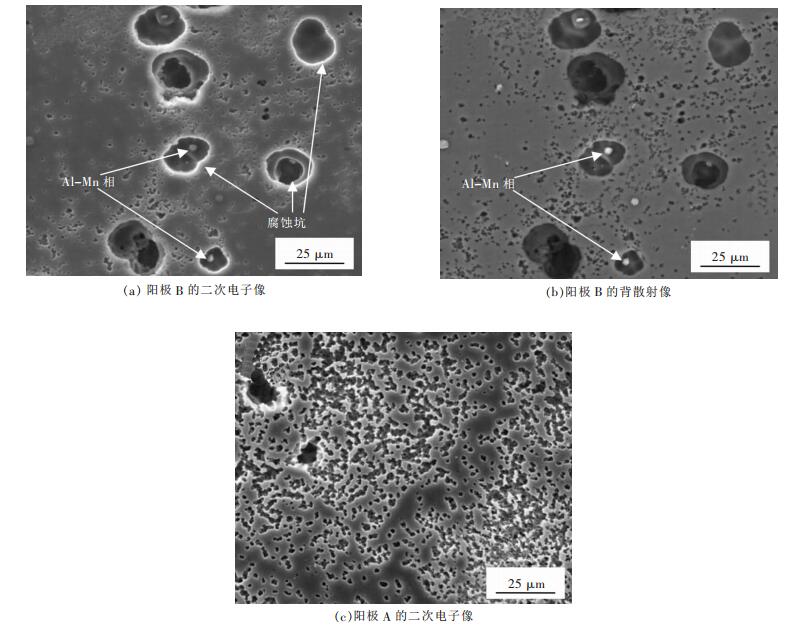 |
| 图 6 AP65阳极在180 mA/cm2电流密度下放电5 s后清除腐蚀产物的腐蚀表面形貌 |
图 7所示为AP65在180 mA/cm2电流密度下放电600 s后腐蚀表面形貌的二次电子像,其腐蚀产物未被清除.AP65阳极放电过程中形成的腐蚀产物主要是Mg (OH)2,当阳极表面附近溶解的Mg2+离子的浓度超过其溶解度极限时,将以Mg (OH)2的形式在阳极表面沉积[24].附着在阳极表面的腐蚀产物阻碍阳极表面与NaCl溶液的接触,导致电极活化面积减小[3-4].当腐蚀产物从阳极表面剥落时,则露出新的表面,使得AP65阳极的放电活性得到提高.由图 7(a)可知,阳极A的腐蚀产物呈较大而致密的块状且裂纹较少,表明阳极A的活化面积较小,NaCl溶液不能和阳极表面有效接触,导致阳极A的放电活性较弱.图 7(b)所示为阳极B在NaCl溶液中放电600 s后的腐蚀表面形貌.从图 7(b)中可以看出腐蚀产物Mg (OH)2膜较薄且裂纹较多,与阳极A明显不同.附着在阳极B上较薄且裂纹较多的腐蚀产物膜有利于NaCl溶液与阳极表面有效接触.此外,该腐蚀产物膜在放电过程中容易剥落,表明阳极B在放电过程中能维持较大的活化反应面积,因而具有比阳极A更强的放电活性.因此,Mn能阻止AP65阳极在放电过程中致密腐蚀产物膜的形成,同时加速该膜的剥落,与图 3所示的电化学阻抗谱一致.
 |
| 图 7 AP65阳极在180 mA/cm2电流密度下放电600 s后未清除腐蚀产物的腐蚀表面形貌二次电子像 |
3 结论
采用电化学方法、化学浸泡法和观察腐蚀表面形貌的方法研究添加Mn与未添加Mn的AP65阳极在3.5 %NaCl溶液中的放电行为和腐蚀行为.结果表明Mn能细化AP65阳极的晶粒,同时抑制浸泡过程中氢气的析出,提高其使用效率.添加Mn的AP65阳极与未添加Mn的相比能提供更负的放电电位.均匀分布的Al-Mn颗粒能作为活性点在放电过程中加速镁基体的阳极溶解.此外,Al-Mn颗粒有利于放电过程中腐蚀产物膜的剥落,导致AP65阳极在放电过程中具有更强的活性.这意味着添加Mn能提高AP65阳极材料的电化学性能.
| [1] |
Feng Y, Wang R C, K. Yu, et al. Influence of Ga and Hg on microstructure and electrochemical corrosion behavior of Mg alloy anode materials[J].
Trans. Nonferrous Met. Soc. China, 2007, 17(6): 1363–1366. DOI: 10.1016/S1003-6326(07)60278-7. |
| [2] | 王乃光, 王日初, 彭超群, 等. 固溶处理对AP65镁合金阳极放电活性的影响[J]. 中南大学学报:自然科学版, 2012, 43(6): 2120–2127. |
| [3] |
Cao D X, Wu L, Wang G L, et al. Electrochemical oxidation behavior of Mg-Li-Al-Ce-Zn and Mg-Li-Al-Ce-Zn-Mn in sodium chloride solution[J].
J. Power. Sources, 2008, 183(2): 799–804. DOI: 10.1016/j.jpowsour.2008.06.005. |
| [4] |
Cao D X, Wu L, Sun Y, et al. Electrochemical behavior of Mg-Li, Mg-Li-Al and Mg-Li-Al-Ce in sodium chloride solution[J].
J. Power. Sources, 2008, 177(2): 624–630. DOI: 10.1016/j.jpowsour.2007.11.037. |
| [5] |
Feng Y, Wang R C, Peng C Q, et al. Influence of Mg21Ga5Hg3 compound on electrochemical properties of Mg-5 % Hg-5 % Ga alloy[J].
Trans. Nonferrous Met. Soc. China, 2009, 19(1): 154–159. DOI: 10.1016/S1003-6326(08)60244-7. |
| [6] | 姜忆初. 电动鱼雷用动力电源及其发展方向[J]. 船电技术, 2005(5): 46–48. |
| [7] | 宋玉苏, 王树宗. 海水电池研究及应用[J]. 鱼雷技术, 2004, 12(2): 4–8. |
| [8] |
Fidel G M, Juan M F, Ruben D R, et al. Electrochemical study on magnesium anodes in NaCl and CaSO4-Mg (OH)2 aqueous solutions[J].
Electrochim.Acta, 2006, 51(8/9): 1820–1830. |
| [9] |
Zhao H, Bian P, Ju D. Electrochemical performance of magnesium alloy and its application on the sea water battery[J].
J. Environ. Sci, 2009, 21(1): S88–S91. |
| [10] |
Yu K, Tan X, Hu Y, et al. Microstructure effects on the electrochemical corrosion properties of Mg-4.1 % Ga-2.2 % Hg alloy as the anode for seawater-activated batteries[J].
Corros. Sci, 2011, 53(5): 2035–2040. DOI: 10.1016/j.corsci.2011.01.040. |
| [11] |
Shi Z M, Song G L, Atrens A. Corrosion resistance of anodised single-phase Mg alloys[J].
Surf and Coat Technol, 2006, 201(1/2): 492–503. |
| [12] |
Pardo A, Merion M C, Coy A E, et al. Influence of microstructure and composition on the corrosion behaviour of Mg/Al alloys in chloride media[J].
Electrochim.Acta, 2008, 53(27): 7890–7902. DOI: 10.1016/j.electacta.2008.06.001. |
| [13] |
Gu X N, Zheng Y F, Cheng Y, et al. In vitro corrosion and biocompatibility of binary magnesium alloys[J].
Biomaterials, 2009, 30(4): 484–498. DOI: 10.1016/j.biomaterials.2008.10.021. |
| [14] |
Shi Z M, Song G L, Atrens A. Influence of the β phase on the corrosion performance of anodised coatings on magnesium-aluminium alloys[J].
Corros. Sci, 2005, 47(11): 2762–2777. |
| [15] |
Candan S, Unal M, Turkmen M, et al. Improvement of mechanical and corrosion properties of magnesium alloy by lead addition[J].
Mater. Sci. Eng. A, 2009, 501(1/2): 115–118. |
| [16] |
Udhayan R, Bhatt D P. On the corrosion behavior of magnesium and its alloys using electrochemical techniques[J].
J. Power. Sources, 1996, 63(1): 103–107. DOI: 10.1016/S0378-7753(96)02456-1. |
| [17] |
Wang N G, Wang R C, Peng C Q, et al. Influence of aluminium and lead on activation of magnesium as anode[J].
Trans. Nonferrous Met. Soc. China, 2010, 20(8): 1403–1411. DOI: 10.1016/S1003-6326(09)60312-5. |
| [18] |
Wang N G, Wang R C, Peng C Q, et al. Corrosion behaviour of Mg-Al-Pb and Mg-Al-Pb-Zn-Mn alloys in 3.5 % NaCl solution[J].
Trans. Nonferrous Met. Soc. China, 2010, 20(10): 1936–1943. DOI: 10.1016/S1003-6326(09)60398-8. |
| [19] |
Liu S, Zhang Y, Han H. Role of manganese on the grain refining efficiency of AZ91D magnesium alloy refined by Al4C3[J].
J Alloys Compd, 2010, 491(1/2): 325–329. |
| [20] |
Robson J D, Henry D T, Davis B. Particle effects on recrystallization in magnesium-manganese alloys: Particle pinning[J].
Mater. Sci. Eng. A, 2011, 528(12): 4239–4247. DOI: 10.1016/j.msea.2011.02.030. |
| [21] |
Cao P, Qian M, Stjohn D H. Effect of manganese on grain refinement of Mg-Al based alloys[J].
Scripta Mater, 2006, 54(11): 1853–1858. DOI: 10.1016/j.scriptamat.2006.02.020. |
| [22] |
Qin G W, Ren Y, Huang W, et al. Grain refining mechanism of Al-containing Mg alloys with the addition of Mn-Al alloys[J].
J Alloys Compd, 2010, 507(2): 410–413. DOI: 10.1016/j.jallcom.2010.07.164. |
| [23] |
Merino M C, Pardo A, Arrabal R, et al. Influence of chloride ion concentration and temperature on the corrosion of Mg-Al alloys in salt fog[J].
Corros. Sci, 2010, 52(5): 1696–1704. DOI: 10.1016/j.corsci.2010.01.020. |
| [24] |
Liang J, Srinivasan P B, Blawert C, et al. Influence of chloride ion concentration on the electrochemical corrosion behaviour of plasma electrolytic oxidation coated AM50 magnesium alloy[J].
Electrochim. Acta, 2010, 55(22): 6802–6811. DOI: 10.1016/j.electacta.2010.05.087. |
| [25] |
Zhao M C, Liu M, Song G L, et al. Influence of pH and chloride ion concentration on the corrosion of Mg alloy ZE41[J].
Corros. Sci, 2008, 50: 3168–3178. DOI: 10.1016/j.corsci.2008.08.023. |
| [26] |
Song G L. Effect of tin modification on corrosion of AM70 magnesium alloy[J].
Corros. Sci, 2009, 51(9): 2063–2070. DOI: 10.1016/j.corsci.2009.05.031. |
| [27] |
Yamauchi K, Asakura S. Galvanic dissolution behavior of magnesium-1mass% manganese-0.5 mass% calcium alloy anode for cathodic protection in fresh water[J].
Mater Trans, 2003, 44(5): 1046–1048. DOI: 10.2320/matertrans.44.1046. |
 2016, Vol. 4
2016, Vol. 4


