| 碳化分解法提纯碳酸锂的研究 |
2. 江西江钨稀土科技开发有限公司,江西 赣州 341000;
3. 赣州有色冶金研究所,江西 赣州 341000
2. Jiangxi Jiangwu Rare Earth Technology Development Co., Ltd., Ganzhou 341000, China;
3. Ganzhou Nonferrous Metallurgy Research Institute, Ganzhou 341000, China
碳酸锂作为生产金属锂和二次锂盐的关键产品,在玻璃陶瓷[1]、石油化工[2]、医药[3]、电池[4-5]等重要工业领域都是不可或缺的原材料.近年来,随着低碳经济与新能源产业的升温,尤其是锂电池行业的高速发展,使得Li2CO3的需求量日益增长,应用范围不断扩大[6-7],然而对它的纯度要求也越来越高,因此提纯制备高纯Li2CO3已势在必行[8].
收稿目前,由工业碳酸锂提纯制备高纯碳酸锂的方法很多,如苛化法、Li2CO3重结晶法、碳化分解法等[9],本文采用的是碳化分解法,该法不仅具有操作简单、提纯效果好、成本低、污染小等特点,而且热分解后过滤沉淀所得的母液可循环利用,以便提高锂的回收率及产品产率,因此该法已被广泛应用于固体化合物的提纯[10-13].美国Harrison, Amouzegar等[14],利用该法制备了高纯Li2CO3;国内杨卉芃等[15]对碳化液离子交换提纯进行了研究,研究表明,碳化液中不溶性杂质离子可以经过滤除去,母液可循环利用;凌宝萍等[16]利用此法初步进行了制备高纯Li2CO3实验.本文采用该法对工业碳酸锂进行提纯,实验主要研究了碳化温度、固液比、碳化时间等因素对碳酸锂纯度和回收率的影响,并确定了最佳工艺条件,为利用此方法提纯提供一定技术依据.
1 实验部分 1.1 实验原料与试剂实验原料:CO2气体、碳酸锂(99.0 %).
实验试剂:碳酸钠、1 mol/L的硫酸、去离子水.
1.2 实验仪器与设备主要仪器设备:CO2气体制备装置(广口瓶、分液漏斗、橡皮塞、橡胶管等)、电子天平、JJ-1精密电动搅拌器、指针式电热恒温水浴锅、DB-2不锈钢加热板、SHZ-Ⅲ循环水式真空泵、101A-2电热鼓风恒温干燥箱
1.3 实验研究方法 1.3.1 实验原理碳化分解法是将工业Li2CO3与去离子水按一定比例混合形成料浆,在搅拌的同时充入CO2气体,使得微溶于水的Li2CO3转变成溶解度大得多的LiHCO3,而其它大部分杂质不被碳化,则可通过过滤去除,再将经净化的滤液加热搅拌,以去除CO2气体,从而析出Li2CO3,最后经过滤,烘干即得Li2CO3产品.反应方程式分别为:
碳化反应 Li2CO3+CO2+H2=2LiHCO3
分解反应 2LiHCO3=Li2CO3↓+CO2↑+H2O
1.3.2 操作步骤用电子天平准确称取一定量Li2CO3,并按一定固液比加入去离子水,随后在一定温度下用精密电动搅拌器搅拌形成Li2CO3料浆,再以一定流速充入CO2气体,使其碳化一定时间后,过滤,滤液至于电热板上加热到95 ℃以上,加热过程快速搅拌,目的是加快分解和防止Li2CO3沾壁,析出的Li2CO3晶体采用循环水式真空泵抽滤,同时用去离子水多次洗涤,最后将其放入电热鼓风恒温干燥箱中干燥一定时间,取出研磨,即得Li2CO3产品[17].
1.3.3 样品检测Li2CO3的纯度:采用容量分析法分析, Li2CO3回收率:由经碳化分解提纯后Li2CO3的实际量与提纯前Li2CO3总加入量之比得到.
2 实验结果与讨论由于碳化过程是碳化分解法的关键过程,此过程控制的好坏,将直接影响Li2CO3产品质量与回收率,因此本实验着重对碳化过程进行研究,研究了碳化温度、固液比、碳化时间等对Li2CO3提纯效果的影响.
2.1 碳化温度对碳酸锂纯度和回收率的影响一方面,升高反应温度有利于加快反应速率;但另一方面由表 1可知,Li2CO3和LiHCO3的溶解度均随温度升高而降低,加之CO2气体在水中的溶解度也是随温度升高而减小,所以升高温度将减慢反应速率.宏观碳化速率则是这两方面共同作用的结果.
| 表1 Li2CO3和LiHCO3溶解度随温度的变化关系 |
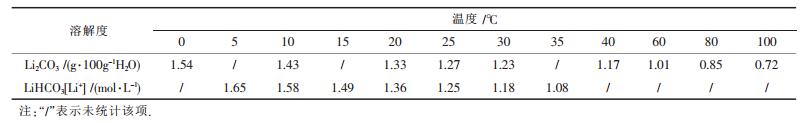 |
| 点击放大 |
本节所采用的实验条件为:碳化时间2.0 h、CO2流速约0.5 L/min、固液比1/35、碳化搅拌速率300 r/min,在此条件下,分别考察碳化温度为28 ℃、33 ℃、38 ℃、43 ℃、48 ℃时,对Li2CO3纯度和回收率的影响如图 1所示.
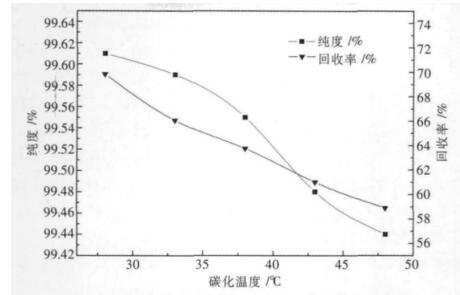 |
| 图 1 碳化温度与Li2CO3纯度和回收率的关系曲线 |
从图 1可以看出,碳化温度对Li2CO3纯度和回收率影响很大,随着碳化反应温度升高,纯度和回收率均降低.在温度为28 ℃的情况下,Li2CO3的纯度和回收率出现最高值,分别为99.61 %和69.84 %,随后逐渐升高碳化温度,Li2CO3纯度和回收率均在下降,其中纯度下降速度由慢到快;而回收率随温度升高,下降的幅度相对较大.当温度达到43 ℃以上时,Li2CO3的纯度低于电池级Li2CO3的纯度要求,而且当温度达到48 ℃时,继续升高温度,会发现Li2CO3纯度和回收率仍有下降的趋势.
随碳化温度升高,Li2CO3的纯度和回收率均下降,原因主要是Li2CO3,CO2和LiHCO3三者在水中的溶解度均随温度升高而呈现降低的趋势,所以当温度升高时,CO2的利用率减小,导致Li2CO3回收率下降,与此同时, 由于LiHCO3溶液(1.3 mol/L)在室温下就有少量分解生成Li2CO3,并且随温度升高分解速率会越来越快[18].这样必将影响产品纯度和回收率.实验中也发现升高碳化反应温度,反而使得碳化效率更低,原因也如上述.所以确定碳化温度以28 ℃为佳.
2.2 固液比对碳酸锂纯度和回收率的影响本实验固液比指的是固体Li2CO3的质量与去离子水的体积比(g/mL).由于一定条件下,溶解一定量的Li2CO3,需要的水量是一定的,配比的水过少或过多均会对Li2CO3产品的纯度和回收率产生一定影响,因此,固液比也是碳化反应过程的一个重要因素.
本节所采用的实验条件为:碳化温度28 ℃、碳化时间2.0 h、CO2流速约0.5 L/min、碳化搅拌速率300 r/min,在此条件下,分别考察固液比为1/25、1/30、1/35、1/40、1/45时,对Li2CO3纯度和回收率的影响如图 2所示.
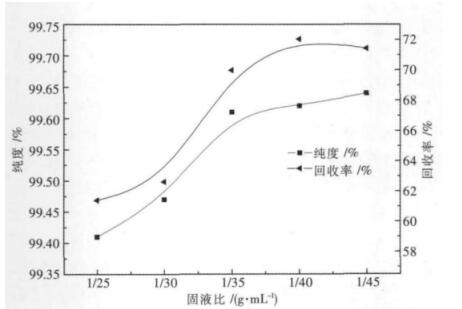 |
| 图 2 固液比与Li2CO3纯度和回收率的关系曲线 |
从图 2可以看出,在一定范围内,固液比对碳酸锂的纯度和回收率均有影响,且随固液比的减小,Li2CO3的纯度和回收率都在上升.当固液比为1/25时,Li2CO3纯度仅为99.41 %,回收率只有61.40 %,随着固液比减小至1/35时,无论是纯度还是回收率,上升幅度均较大,此时纯度达到99.61 %,回收率69.98 %,已达到电池级Li2CO3的纯度要求.随后继续减小固液比,Li2CO3的纯度和回收率上升空间有限,其纯度在固液比1/45时出现最高值,回收率在1/40时出现最高值.
固液比小即是去离子水所占比分多,在Li2CO3质量和碳化容器不变的情况下,加入的水多,可以使充入的CO2气体与Li2CO3料浆接触时间更长,接触面积更大,反应更完全,从而Li+能够更充分的进入水溶液中,因此,最终热分解析出的Li2CO3量和纯度都会相对更高.然而,一定温度下一定质量的Li2CO3,所需要溶解它的水是一定的,当加入的水已足够让它完全溶解时,继续加水,LiHCO3溶液中溶质的量不再增加,因此产品回收率几乎不变化,实验结果与此相吻合.实验中还发现,固液比越小,碳化反应速率也越快,这主要是由于一定质量的Li2CO3溶解在更多的水中,有效扩大了它与CO2气体的接触面积,所以碳化反应速率更快.综合纯度和回收率考虑,确定固液比以1/40为佳.
2.3 碳化时间对碳酸锂纯度和回收率的影响在CO2流速、碳化温度、固液比等条件不变的情况下,碳化时间是影响Li2CO3纯度和回收率的主要因素.当碳化时间过短,可能导致Li2CO3不能完全被碳化溶解,回收率下降;然而,当水溶液中LiHCO3浓度达饱和时,Li2CO3将不再溶解,如果继续延长碳化时间,反而会造成CO2气体浪费,增加成本.所以有必要通过实验确定一个最佳碳化时间.
本节所采用的实验条件为:碳化温度28 ℃、CO2流速约0.5 L/min、固液比1/40、碳化搅拌速率300 r/min,在此条件下,分别考察碳化时间为0.5 h、1.0 h、1.5 h、2.0 h、2.5 h时,对Li2CO3纯度和回收率的影响如图 3所示.
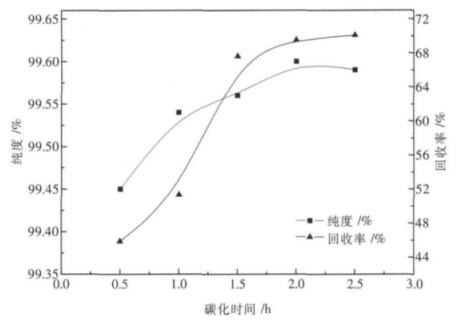 |
| 图 3 碳化时间与Li2CO3纯度和回收率的关系曲线 |
从图 3可以看出,随碳化时间的延长,Li2CO3纯度和回收率均有所增加.在碳化时间为0.5 h时,Li2CO3纯度与回收率均较低,分别为99.45 %、45.87 %,随碳化时间延长至2.0 h时,Li2CO3的纯度和回收率分别可达99.60 %、69.52 %,随后再继续延长碳化时间,Li2CO3纯度和回收率变化范围较小.
延长碳化时间,Li2CO3纯度和回收率增加,原因主要是随着碳化反应时间的延长,CO2气体与Li2CO3反应更充分,这就意味着将有更多的Li2CO3溶于水溶液中,变成LiHCO3,从而使得Li2CO3回收率提高;而当碳化时间延长至2.0 h以上时,Li2CO3纯度和回收率变化范围很小,主要是因为随碳化时间的延长LiHCO3浓度逐渐增大,增大达到饱和时,Li2CO3不再溶解,所以继续延长碳化时间,Li2CO3纯度和回收率上升空间有限.综合产品纯度与回收率及制备成本考虑,确定碳化时间以2.0 h为佳.
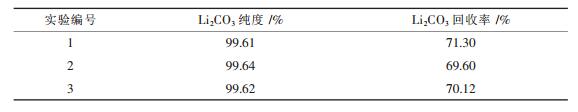
2.4 综合条件实验为了验证综合条件实验效果及实验结果重现性如何,在碳化温度为28 ℃、碳化时间为2.0 h、固液比为1/40、CO2流速为0.5 L/min、碳化搅拌速率为300 r/min的综合条件下,进行3次重复实验,实验结果如表 2所示.
| 表2 综合条件实验结果 |
 |
| 点击放大 |
从表 2可以看出,综合条件下提纯制备得到的Li2CO3纯度和回收率波动范围较小,其中Li2CO3的纯度可达99.60 %以上,回收率基本处在70.0 %左右.
3 结论(1)碳化分解法对碳酸锂提纯效果好,其碳化过程中碳化温度和碳化时间是影响Li2CO3纯度和收率的主要因素.随着碳化温度升高,Li2CO3纯度和回收率均会下降;而在一定范围内,随碳化时间的延长,Li2CO3纯度和回收率会升高;
(2)由单因素条件实验确定的最佳碳化工艺为,碳化温度28 ℃、碳化时间2.0 h、固液比1/40、CO2流速0.5 L/min、碳化搅拌速率300 r/min,在此条件下,提纯制备的Li2CO3纯度可达99.60 %以上,回收率在70.0 %左右;
(3)在热分解过程中,搅拌速率应尽量快些,这样既可以加快LiHCO3的分解,又可以减少Li2CO3沾壁,从而提高产品回收率.
| [1] | 游清治. 锂在玻璃陶瓷工业中的应用[J]. 世界有色金属, 2000(2): 26–31. |
| [2] | 刘磊, 孙洪伟. 锂基润滑脂的制备及热力学估算[J]. 轴承, 2009(11): 30–31. |
| [3] | 游清治. 锂及其化合物在医药中的应用[J]. 世界有色金属, 1997(12): 41–43. |
| [4] | 陈奕, 李永华, 刘德敏. 电池级碳酸锂的生产及其应用[J]. 化工矿物与加工, 2007(5): 26–30. |
| [5] | Boryta D A, Kullberg T F, Thurston A M. Production of Lithium compounds directly from lithium containing brines:United States, 20080233042[P].2008. |
| [6] | 张江峰. 低碳时代+押注新能源-电池级碳酸锂迎来发展机遇[J]. 中国有色金属, 2010(5): 22–24. |
| [7] | 孟良荣, 王金良. 碳酸锂及其制备[J]. 电源技术, 2011, 35(12): 1602–1604. |
| [8] | 游清治. 我国锂工业近年来的新进展[J]. 世界有色金属, 2002(7): 4–8. |
| [9] | 米泽华. 高纯碳酸锂的制取方法探讨[J]. 新疆有色金属, 2000, 23(2): 27–29. |
| [10] |
Yi W T, Yan C Y, Ma P H, et al. Refining of crude Li2CO3 via slurry phase discussion using CO2[J].
Purif Technol, 2007, 56: 241–248. DOI: 10.1016/j.seppur.2007.01.015. |
| [11] | 伊文涛, 闫春燕, 李法强, 等. 碳酸锂碳化反应过程分析与机理探讨[J]. 化工矿物与加工, 2006, 35(2): 31–34. |
| [12] |
YI Wen-tao, YAN Chun-yan, MA Pei-hua. Removal of calcium and magnesium from LiHCO3 solutions for preparation of high-purity Li2CO3 by ion-exchange resin[J].
Desalination, 2009, 249: 729–730. DOI: 10.1016/j.desal.2009.01.034. |
| [13] | 吴鉴, 戴永年, 姚耀春. 氢化条件对碳酸锂提纯的影响[J]. 材料导报B:研究篇, 2011, 25(7): 82–84. |
| [14] | Amouzegar. Process for the purification of lithium carbonate:United States, 6048507[P], 2000. |
| [15] | 杨卉芃, 李琦, 余丽秀, 等. 离子交换法提纯二次锂[J]. 中国资源综合利用, 2002(5): 22–25. |
| [16] | 凌宝萍.高纯碳酸锂制备过程中氢化与除硼研究[D].西宁:中国科学院青海盐湖研究所, 2004:15-16. |
| [17] | 周启立, 王莫飞. 碳化法制备高纯碳酸锂[J]. 无机盐工业, 2012, 44(7): 36–37. |
| [18] | 孙玉柱.碳酸锂结晶过程研究[D].上海:华东理工大学, 2010. |
 2013, Vol. 4
2013, Vol. 4


