| 熔盐电解制备铜粉的实验研究 |
b. 江西理工大学,冶金与化学工程学院, 江西 赣州 341000
b. School of Metallurgy and Chanical Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China
熔盐体系通常被认为是一种离子缔合体,包含离子和一定自由体积的高温液体.与水溶液电解质相比,熔盐体系具有较宽的温度范围和电化学窗口,良好的导电及导热性.熔盐电化学反应较为迅速,电流密度可达到10 A/cm2(水溶液电解体系一般不超过0.03 A/cm2),而且比起水溶液体系,熔盐体系相应过程的能量损失更小一些.因此,熔盐电解法已广泛应用于非金属和金属的制取和精炼等一些相关领域.
采用熔盐电解法制备钨粉的研究,东北大学已经做了一些,在理论和实验方面也进行了较为深入的研究.熔盐电解法制备高纯物质时反应条件容易控制,环境也相对友好.
熔盐电脱氧(FFC)法是近年来发展的新技术[1]. 1997年剑桥大学冶金与材料科学系的Fray等人以TiO2为阴极,石墨棒为阳极,在电解电压为2.5 V、温度为950 ℃的CaCl2熔盐中直接电解获得了金属钛[2-8].
图 1为采用FFC法制备金属钛的工艺流程图[9-14],图 1中给出了制备金属单质以及合金的基本流程. FFC法与其它熔盐电解法的不同之处在于它以金属氧化物为阴极,直接把金属与氧分开而得到了金属,其优点为:①该方法适用于多种金属,尤其是一些化学性质活泼的金属;②可以用单一或混合金属氧化物为原料,经一步电解得到金属或者合金;③反应过程中不会释放Cl2等一些有害气体,对环境友好.
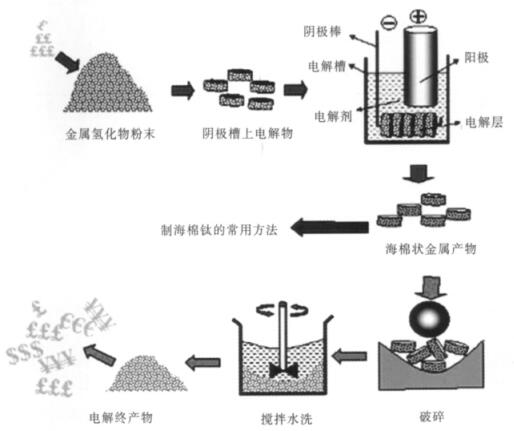 |
| 图 1 FFC法制备钛的工艺流程 |
从图 2(FFC法应用现状) [15-17]中可以发现铜可以成功地用熔盐电解方法制备得到.熔盐电解制备铜的方法,具有一定的创新性,在国内外还没有被广泛的研究过,更没有应用到工业生产中.用这种方法制备Cu粉可以大大降低生产的成本,对环境不会造成污染,发展前景良好.
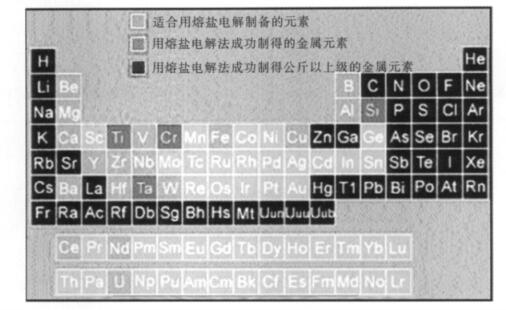 |
| 图 2 FFC法应用现状 |
1 NaCl-KCl-CuO体系制备铜粉实验 1.1 实验原理
研究采用KCl-NaCl混合盐做熔盐电解质主要是由于以下几点原因:
(1)由KCl-NaCl相图[18]可以看出,纯KCl熔点为773 ℃左右,纯NaCl的熔点为802 ℃左右,KCl-NaCl混合物最低共晶点为658 ℃左右.采用KCl-NaCl混合熔盐为电解质,可以降低电解的操作温度.
(2)KCl有很强的溶解O2-能力.电解过程中阴极附近金属氧化物中氧离解出来形成氧离子,离解出来的氧离子要溶解在熔盐中,扩散到达阳极后放电析出.使用KCl做熔盐组分有利于阴极上生成的氧离子快速溶解到熔盐中,并能快速到达阳极放电,提高电解速度.
(3)氧化物在NaCl中溶解度极低,在KCl中添加NaCl可以降低金属氧化物在熔盐中的溶解度,使金属氧化物不易溶解,这样就减少了生成的金属原子向熔盐中扩散的趋势,有利于生成产物的收集.
本研究使用KCl-NaCl混合熔盐的温度范围为740~820 ℃.
以纯物质为标准状态计算820 ℃条件下KCl和NaCl的热力学和电化学数据列于表 1[19].
| 表1 电解质体系内物质的理论值 |
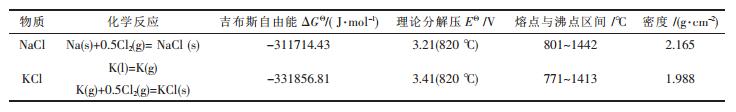 |
| 点击放大 |
己知820 ℃条件下:采用KCl和NaCl混合物做熔盐,熔盐组分的实际活度均小于1,即相同温度下混合熔盐中KCl和NaCl的实际分解电压均会高于相应的以纯物质为标准状态计算得到的理论值. KCl-NaCl体系中NaCl的活度对拉乌尔定律呈负偏差,NaCl的实际分解电压比理论值高.综上可以判断混合熔盐分解电压应≥3.21 V,故实验操作中阴、阳电极两端施加低于3.23 V电压就不会使熔盐电解.
若外加电压超过3.41 V,则KCl与NaCl熔盐不仅作为支持电解质,而且还会被电解,发生如下电极反应:
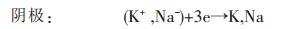
|
(1) |

|
(2) |
实验的反应环境中对水分敏感,如有水分会生成具有氧化性的HClO和腐蚀性的HCl,对设备和环境造成较严重的损害,而且还会增加电解时的电耗[20].
熔盐电解铜过程的电解反应如下:
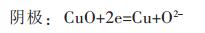
|
(3) |
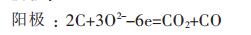
|
(4) |
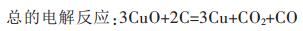
|
(5) |
根据实验设计要求温度在740~820 ℃之间:
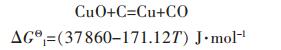
|
(6) |
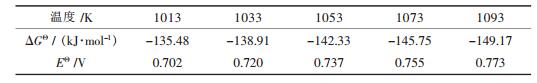
在不同的温度下由式(6)可得标准Gibbs自由能变ΔGΘ和电动势EΘ,见表 2所示.由式(5)可得式(7):
| 表2 阳极产物为CO时反应式(6)不同温度下标准Gibbs白由能变和电动势[19] |
 |
| 点击放大 |
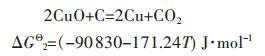
|
(7) |
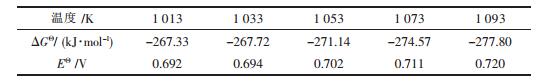
在不同的温度下由式(7)可得标准Gibbs自由能变ΔGΘ和电动势EΘ,见表 3所示[19].
| 表3 阳极产物为CO2时反应式(7)不同温度下标准Gibbs自由能变和电动势 |
 |
| 点击放大 |
氧化铜(CuO)是一种铜的黑色略显两性的氧化物,稍有吸湿性.相对分子质量为79.545,密度为6.3~6.9 g/cm3,熔点1 326 ℃.不溶于水和乙醇,溶于酸、氯化铵及氰化钾溶液,在氨溶液中缓慢溶解.在熔融的NaCl-KCl-CuO体系内,存在K+,Na+,Cl-,Cu2+其中Cu2+的分解电位低于Cl-,理论上可以通过施加一定的直流电压将Cu2+分解,进而析出单质铜.
1.2 实验原料和条件(1)配料.当NaCl和KCl的质量比接近1:1的时候熔点最低,为658 ℃[18].由于要保证熔盐的完全熔化,温度要比理论值偏高,所以本实验采用的温度为740~820 ℃,按这个比例配好足够的料放入烘箱中备用.
NaCl-KCl-CuO体系中NaCl和KCl的质量比为1:1,但CuO的含量不能确定,所以本实验制备了4种不同比例的3种体系进行实验,分别为:
第1种,NaCl:KCl:CuO=38 %:38 %:24 %;
第2种,NaCl:KCl:CuO=40 %:40 %:20 %;
第3种,NaCl:KCl:CuO=42 %:42 %:16 %;
第4种,NaCl:KCl:CuO=44 %:44 %:12 %;
由于要保证熔盐的流动性,以及熔盐电解的充分,所以选择熔盐体系比例时,熔盐电解质的比例较大.
(2)配料处理.本实验采用的是外径90 mm、内径70 mm、高度为900 mm、底厚15 mm的刚玉坩锅为反应容器,所以根据反应容器的容量配好料混合后填满反应容器,放入烘箱中在120 ℃的温度下烘48 h即可.
(3)实验条件.实验研究的条件:在740~820 ℃,电压1.5~2 V下预电解1.5~2 h,在电解槽电压2.2~3.2 V,阴极电流密度110~140 mA/cm2,电极为石墨电极,极间距为5 cm条件下电解1.5~3.5 h.
1.3 实验设备图 3为本实验的装置示意图.
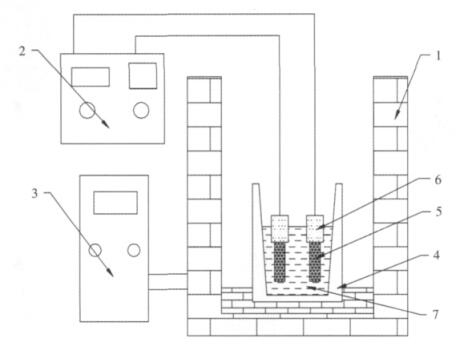 |
| 1.电阻炉;2.稳压稳流电源;3.温控仪;4.坩埚;5.石墨电极;6.电极保护层;7.熔体 图 3 实验装置示意图 |
其中电解槽放置在不锈钢外套内,电极引线为Cu丝,K型NiCr-NiSi热电偶测量温度,在自制电阻炉内升温;KSJ系列温度控制器,产地:上海电机公司实验电炉厂;直流稳压电源,产地:中国赣州虔龙整流器厂.
1.4 实验过程(1)实验前将配比好的原料放入瓷坩埚内,混合均匀,将瓷坩埚放入坩埚电阻炉中,加热至试剂完全融化,呈清透状.再将两根石墨电极放入瓷坩埚中, 然后电极慢慢的放入,所用的电极引线为铜线,把电极引线和硅整流器相联.
(2)调节硅整流器的电压和电流.待系统温度达到800 ℃时,在两极施加0.2 V的电压(忽略电极极化的作用对实际分接电压的影响,同时低于CuO的理论分解,保持CuO的稳定)预电解1.0~1.5 h除去体系中的杂质.
(3)预电解后,电解电压调至2.2~3.2 V,电解1.5~3.5 h后,停止电解,提升电极,再经300 min熔盐体系温度降至室温.夹出瓷坩埚,将瓷坩埚内电解产物取出,放入1000 mL的大烧杯内对产物进行预处理.
1.5 电解终产物的预处理(1)将蒸馏水倒入装有终产物烧杯中至完全浸没终产物的顶部,然后把烧杯放入水浴锅中加热煮沸20 min (加热煮沸的目的主要是把冷却后的熔盐变得更疏松柔软,这样有利于杂质的去除),加热完成后待烧杯冷却,取出烧杯放在实验桌台上沉淀1 h.沉淀好后将烧杯里的上清液倒掉,留下固体物质和浓稠的混浊溶液.由于电解的阴极产物铜的比重比熔盐电解的大,所以会沉在底部,所以固体物质只要取底部含有铜粉的熔盐即可.
(2)在用蒸馏水处理后的产物中加入足够量的稀盐酸(质量百分比5 %)浸泡10 h,加稀盐酸的目的主要是将产物中残余的CuO溶解形成可溶性的CuCl2溶液,反应完毕后将残留物过滤得到滤饼, 烘干后就得到所要的阴极最终产物.
(3)所得的阴极最终产物进行X射线衍射(XRD)及扫描电子显微镜(SEM)及能谱(EDS)测试,对产物的物相组成、形貌、粒度进行表征.
1.6 结果与讨论图 4为NaCl-KCl-CuO体系中阴极产物的XRD谱图,可以看出,预电解阴极产物的主要物相为Cu,在阳极附近并未发现有Cu沉积.同时也可以表明预电解过程中有效除去了体系中存在的杂质,并未在阴极附近发现有大量其它产物.但电解时所用的电极引线为Cu丝, 所得到的阴极产物Cu是电解CuO得到的,还是由于电极引线Cu丝的熔化产生的,对这个疑虑进行了简单的讨论:
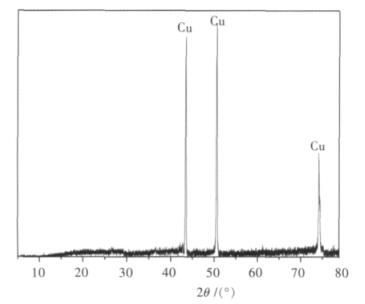 |
| 图 4 NaCl-KCl-CuO电解阴极产物XRD谱图 |
(1)由于Cu的熔点为1 084 ℃,而本实验的电解温度在740~820 ℃之间,所以阴极生成的Cu不可能是电极引线(Cu丝)的熔化产生的.
(2)电解实验之前对电极引线进行了称重,为32.8g,电解完毕后称量电极引线,重量为32.83 g.电极引线的重量没有减少反而增加了,说明阴极生成的Cu不可能是电极引线(Cu丝)的熔化产生的,电极引线增重的原因是因为电极引线放在熔盐中,拔出来后表面附着了少量的熔盐电解质.
(3)图 5与图 6和表 4为实验终产物放大2000倍的SEM图像及谱图中不规则产物颗粒的能谱图和EDS分析结果.
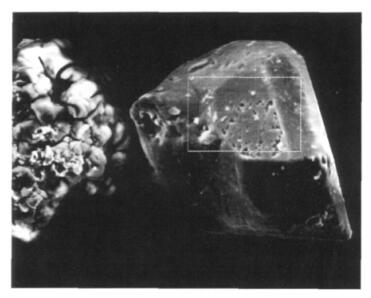 |
| 图 5 实验阴极终产物放大2 000倍的SEM图像 |
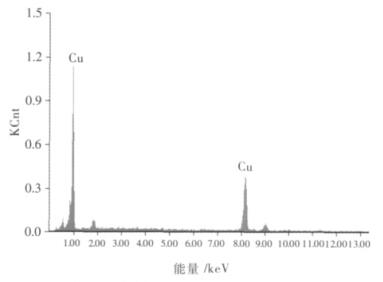 |
| 图 6 实验阴极终产物放大2 000倍的晶粒能谱图 |
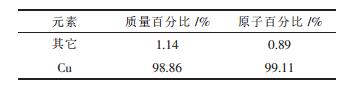
| 表4 实验阴极终产物放大2 000倍的晶粒能谱测试结果 |
 |
| 点击放大 |
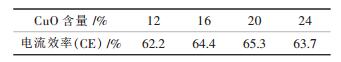
表 5为NaCl-KCl-CuO体系中CuO的百分含量对电流效率的影响,从表 5中可以看出当CuO的百分含量为20 %时,电流效率最大,达到了65.3 %,CuO的百分含量在12 %~20 %之间,电流效率随着的CuO含量的增大而升高,是因为CuO含量的增多,电解出的Cu也越多.但当CuO的含量超过了20 %时,电流效率随着CuO含量的增多反而降低,降低的原因是由于熔体系体系中电解质太少了,当电解质消耗完后还有一些CuO没有电解完留在坩埚中,使得电流效率降低.
| 表5 电解体系中CuO的含量对电流效率的影响 |
 |
| 点击放大 |
2 结论
实验以NaCl-KCl-CuO为体系,其中NaCl和KCl占总质量的40 %,CuO占总质量的20 %,温度为740~820 ℃,阴极电流密度110~140 mA/cm2,电解时间1.5~3.5 h,电压为2.2~3.2 V的条件下,可以制得比较纯的铜粉,产物纯度在99 %以上且平均粒度为0.91 μm.而且研究表明按NaCl:KCl:CuO=40 %: 40 %:20 %比例混合电流效率最大为65.3 %.
| [1] |
Maneshian M H, Simchi A. Solid state and liquid phase sintering of mechanically activated W-20wt. %Cu powder mixture[J].
Journal of Alloys and Compounds, 2008, 463(1/2): 153–159. |
| [2] |
WU Men-qiang, Graeme A Snook, George Z Chen, et al. Redoxdeposition of manganeseo xideon graphite for supercapacitors[J].
Electro-chemistr Communications, 2004(6): 499–504. |
| [3] |
Castellero A, Bossuyt S, Stoica M, et al. Improvement of the glass-forming ability of Zr55Cu30Al10Ni5 and Cu47Ti34Zr11Ni8 alloys by electro-deoxidation of the melts[J].
Scripta Materialia, 2006(5): 87–90. |
| [4] |
Graeme A.Snook, Chuang Peng, Fray D.J, et al. Achieving high electrode specific capacityance with materials of lowmass specific capacitance potentiostatically grown thickmicro-nanoporous PEDOT films[J].
Electrochemistry Communications, 2007(9): 83–88. |
| [5] |
YE Ke, ZHANG Mi-lin, CHEN Ye. Electrochemical codeposition of Al-Li-Mg alloys at solid aluminum electrode from LiCl-KCl-MgCl2 molten salt system[J].
Metallurgical and Materials Transactions B, 2010, 41(3): 691–698. DOI: 10.1007/s11663-010-9354-8. |
| [6] |
WU Yan-ke, XU Zhi-gao, CHEN Song. Electrochemical behavior of zirconium in molten NaCl-KCl-K2ZrF6 system[J].
Rare Metals, 2011, 30(1): 8–13. DOI: 10.1007/s12598-011-0187-7. |
| [7] |
WANG Shu-lan, LI Shi-chao. Electro-deoxidation of V2O3 in moltenCaCl2-NaCl-CaO[J].
International Journal of Minerals, Metallurgy, and Materials, 2012, 19(3): 212–216. DOI: 10.1007/s12613-012-0540-3. |
| [8] | 赖华生, 王林生. 电流密度对稀土熔盐电解影响的探讨[J]. 江西有色金属, 2002, 16(4): 23–25. |
| [9] |
Fray D J. The use of solid electrolytes as sensors for applications in molten metals[J].
Solid State Ionics, 1996(86/88): 1045–1054. |
| [10] | 高筠, 周正, 王岭, 等. 电脱氧法工艺研究用熔盐电解材料[J]. 化学工程师, 2007, 136(1): 42–45. |
| [11] |
Hironori Nakajima, Toshiyuki Nohira, Rika Hagiwara, et al. Electrode position of metallic tungsten films in ZnCl2-NaClKCl-KF-WO3 melt at 250℃[J].
Electrochimica Acta, 2007, 45(1): 478–482. |
| [12] | 乔占奎, 李莹. 对硼铬元素性质的理论解析[J]. 集宁师专学报, 2001, 23(4): 22–24. |
| [13] |
Freyland W, Zell C A, Zein S, et al. Nanoscale elec-trodeposition of metals and semiconductors from ionicliquids[J].
Electrochimica Acta, 2003, 48: 3053–3061. DOI: 10.1016/S0013-4686(03)00378-5. |
| [14] | 舒霞, 吴玉程, 张勇, 等. 化学沉积Co-B纳米晶合金工艺的研究[J]. 电镀与环保, 2004, 24(4): 27–29. |
| [15] |
Aleksandar T Dimitrov, George Z Chen, Ian A Kinloch, et al. A feasibility study of scaling-up the electrolytic production of carbon nanotubes in molten salts[J].
Electrochimica Acta, 2002, 48: 91–102. DOI: 10.1016/S0013-4686(02)00595-9. |
| [16] |
XU Qian, George Z Chen, Derek J Fray. Electrochemical investigation of lithium intercalation into graphitefrom molten lithium chloride[J].
Journal of Electroanalytical Chemistry, 2002, 530: 16–22. DOI: 10.1016/S0022-0728(02)00998-1. |
| [17] |
HU Yong-sheng, WANG Zhao-xiang, HUANG Xue-jie, et al. Physical and electrochemical properties of new binaryroom-temperature molten salt electrolyte based on Li-BETI and acetamide[J].
Solid State Ionics, 2004, 175: 277–280. DOI: 10.1016/j.ssi.2003.11.038. |
| [18] | 胡小峰, 许茜. CaCl2-NaCl熔盐电脱氧法制备金属Ta[J]. 金属学报, 2006, 42(3): 285–289. |
| [19] | 梁英教, 车荫昌. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社 , 2008: 455-470. |
| [20] | HoackD L. 用于散热片和电接触器的钨铜复合材料[J]. 中国钨业, 1997(1): 21–26. |
 2012, Vol. 3
2012, Vol. 3


