| Si4+ 掺杂对富锂Li[Li0.15Mn 0.575Ni0.275]1-xSixO2 |
目前,锂离子正极材料研究较多的是类似有α-NaFeO2熔盐结构的LiMO2(M 为过渡金属元素)层状氧化物[1]. LiCoO2是最早被人们普遍接受的这类正极材料,由于合成工艺简单、电化学性能好,早在1995 年就实现了商品化[2].但是由于它的毒性较大且价格昂贵,迫使人们寻求它的替代品.近年来高容量和循环稳定的富锂正极材料引起广泛关注,富锂正极材料主要是Li2MnO3与层状材料LiMO2 (M =Ni,Co,Fe,Cr)形成的固溶体[3-6],锂离子电池富锂正极材料Li[Li1/3-2x/3NixMn2/3-x/3]O2是Li2MnO3与LiNi1/2Mn1/2O2按不同比例形成的固溶体,也可以看作Ni2+取代Li[Li1/3Mn2/3]O2或Li2MnO3中的Li+和Mn4+[7-9]. 采用氢氧化物共沉淀法制备出镍、锰氢氧化物前躯体,然后按适当的摩尔比与SiO2和Li2CO3固相反应合成Li [Li0.15Mn0.575Ni0.275]1-xSixO2(x=0,1 %,2 %,3 %,4 %)正极材料.考察不同掺杂量对材料的结构和性能的影响,制备出电化学性能良好的Li[Li0.15Mn0.575Ni0.275]0.99Si0.01O2.
1 实验部分 1.1 Li[Li0.15Mn0.575Ni0.275]1-xSixO2(0≤x≤0.04)的制备将MnSO4·H2O(含Mn2+:27.5 %)和NiSO4·6H2O(含Ni2+:22.06 %)按化学计量比混合,配成2 mol/L的混合溶液,与配制好的2.5 mol/L 的NaOH 溶液反应,以NH3·H2O 为络合剂,调节pH=10.2~10.5,在55 ℃下反应12 h 制得前躯体.将前躯体过滤、洗涤、真空110 ℃干燥12 h 后,与适量的超细SiO2粉和Li2CO3混合均匀,最后进行高温焙烧.将混合粉末置于马弗炉中,升温至500 ℃、保温4 h,然后继续升温至950 ℃、焙烧20 h,合成所要正极材料.
1.2 材料的成分分析与形貌表征材料的成分分析一般采用X 衍射分析测试手段,简称XRD 分析.使用荷兰Philips X’Pert Pro MPD粉末衍射仪,仪器相关参数:Cu Kα 辐射,石墨单色器,40 kV,100 mA.扫描电镜(简称SEM)是用来观察材料微观表面形貌特征的常用办法. 使用AMRAY-1000B 型扫描电镜,仪器参数:加速电压20 kV.
1.3 电化学性能测试将实验制备得到的Li[Li0.15Mn0.575Ni0.275]1-xSixO2(0≤x≤0.04)为正极材料,组装成AA 型电池.采用武汉金诺公司提供的蓝电测试仪进行电化学性能测试.电池循环测试仪自动采集记录充放电过程中电流电压及容量数据变化情况.本实验在常温25 ℃下,分容电压为2.5~4.6 V,充放电循环电压范围为2.5~4.2 V,循环电流为1 C 倍率.
电池的正极极片是将所得的本实验正极材料∶乙炔黑(导电剂)∶聚偏氟乙烯(粘结剂)=90∶4∶6,加入N-甲基吡咯烷酮,在行星式球磨机上进行球磨混合,制成粘稠度合适的浆料,在涂布机上将其涂敷到铝箔集流体上干燥后制成的.电池的负极极片是将杉杉公司生产的MCMB(负极材料)∶乙炔黑(导电剂)∶聚偏氟乙烯(粘结剂)=90∶3∶7,同正极材料一样制成浆料后涂敷到铜箔集流体上,干燥后制成.将正、负极片和美国Celgard2300 隔膜经卷绕后,在通有流动干燥空气的注液干燥房中注液.电解液采用深圳新宙邦生产的1 mol/L LiPF6/DMC+EMC+EC(体积比为1∶1∶1),最后经封口组装成AA 型的电池.
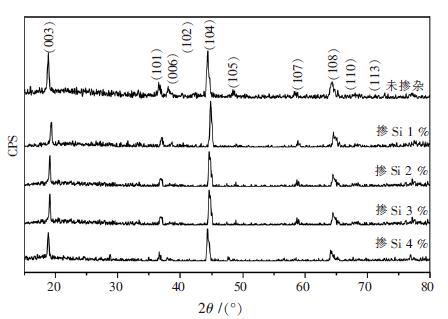
2 结果和讨论 2.1 物相分析图 1 是各不同掺杂量的正极材料的XRD 图谱.从图 1 中可以看到,各图谱上特征衍射峰峰形尖锐,峰强度大,无杂相峰出现,所有粉末样品的衍射峰均与α-NaFeO2衍射峰相对应. 表明合成的材料具有典型的α-NaFeO2结构,属R3m 空间群和六方晶系[10].由XRD 曲线中可以观察到明显的(006)/(102) 和(108)/(110)分裂峰,表明合成的材料为具有层状结构的活性材料[11].
 |
| 图 1 不同掺量样品的XRD 图谱 |
图 1 中两个晶面最强锋(003)和(104)峰在掺杂Si4+后,其峰值位置都有向高角度偏移的趋势.这是因为Si4+的离子半径为rSi4+=0.040 nm,而Ni、Mn 及Li 的离子半径分别为rNi2+=0.069 nm、rMn4+=0.053 nm、rLi+=0.076 nm.随较小离子半径的Si4+的掺入,会使材料在c 轴方向有微小的畸变,导致峰值向高角度偏移.
2.2 微观形貌分析图 2 掺Si 与未掺杂的正极材料的SEM 图. 图 2中显示微量的掺杂仍会保留该正极材料的整体形貌特征,只是略有收缩,材料间的团聚减少,使分散性更好. 从图 2 中可以看到该材料的直径约8~15 μm.掺杂后的样品颗粒组成较均匀,颗粒尺寸分布较窄.
 |
| 图 2 掺杂与未掺杂正极材料的SEM 图 |
2.3 电化学循环性能
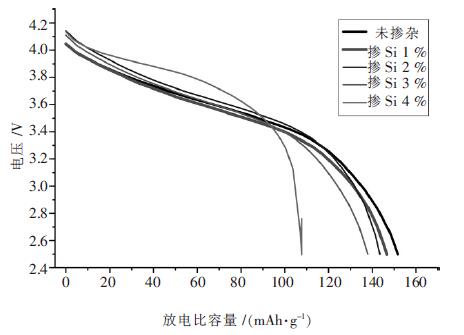
将焙烧后的正极材料Li [Li0.15Mn0.575Ni0.275]1-xSixO2(x=0,1 %,2 %,3 %,4 %)做成AA 电池在恒温25 ℃进行电化学充放电性能分析(2.5~4.2 V,1 C).图 3 为不同掺杂量的样品材料在1 C 倍率的首次充放电曲线图. 从图 3 中可以得到随Si4+的掺入会使材料的初始放电比容量有明显降低,这是因为Si4+在材料中并不具有电化学活性,其充放电前后价态是保持不变的. 因而宏观上表现为降低了材料的初始容量. 图 3中还显示少量的掺杂不会改变材料的放电曲线,放电曲线平缓,放电平台也很明显,当掺杂量达到4 %时,材料的放电比容量有明显减少,整个放电曲线不但不再平滑,而且放电平台也不明显.
 |
| 图 3 不同掺杂样品Li[Li0.15Mn0.575Ni0.275]1-xSixO2 的首次放电曲线 |
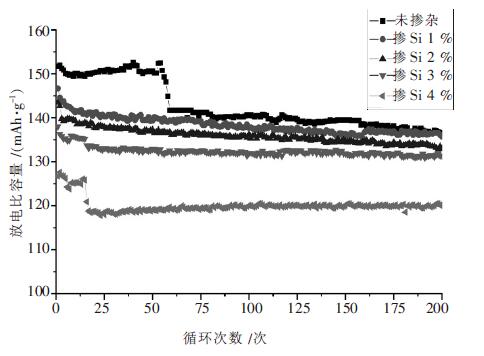
图 4 所示为不同掺杂量的正极材料Li [Li0.15Mn0.575Ni0.275]1-xSixO2(x=0,1 %,2 %,3 %,4 %)的循环曲线.从图 4 中可以看出,未掺杂的材料在最初的放电比容量最优,在50 次左右比容量还有所增长,但随循环次数的增加,为掺杂材料的放电比容量波动性很大,经200 次循环后容量衰减至135.4 mAh/g.在图 4 中可见随循环的进行掺杂1 %的Si4+的材料放电比容量和循环的稳定性最佳. 少量Si4+的存在抑制Ni2+的进入,这可防止Ni2+在锂位充放电时离子半径发生改变导致材料结构的坍塌,Li+通道被阻塞,所以掺杂后样品的循环稳定性增加.
 |
| 图 4 不同掺杂的Li[Li0.15Mn0.575Ni0.275]1-xSixO2 放电循环曲线 |
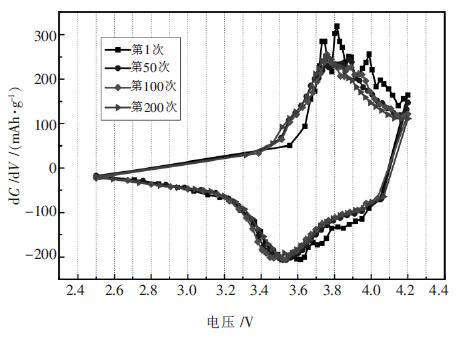
图 5 为掺杂1 % 的Si 的正极材料Li[Li0.15Mn0.575 Ni0.275]0.98Si0.01O2第1 次、50 次、100 次和200 次循环的微分容量曲线. 从图 5 中可以看出,在3.8 V 左右有一个明显的氧化峰,主要是由于材料中的Ni3+氧化成为Ni4+,随着循环的进行这个氧化峰向高压有所偏移.在3.5 V 左右的还原峰则是材料中的Ni4+还原成为Ni3+,在此还原峰附近还存在少量的还原杂峰,那是由于少量的Mn4+还原成Mn3+而溶于电解液.材料在循环200 次时,曲线形状未发生明显变化,仍然保持原来的峰形,并且峰位仅有少量移动,说明电池的极化程度小,曲线所围的面积改变不大,说明容量衰减的很少,材料的晶型稳定性好,材料的结构没有因为循环的进行发生大的改变[12],可见该材料具有良好的循环性能.
 |
| 图 5 掺1 %Si 样品不同循环次数的微分容量曲线 |
3 结论
文中采用共沉淀法制备合成了Li [Li0.15Mn0.575Ni0.275]1 -xSixO2 (x =0,0.01,0.02,0.03,0.04)锂离子正极材料.研究表明:掺Si4+量为1 %的材料具有α-NaFeO2层状结构,阳离子排列有序度最好,从而有利于锂离子的扩散.在1C 倍率下表现高的放电比容量和稳定的循环性能.首次放电比容量为146.7 mAh/g,100 次循环后比放电容量为137.7 mAh/g,200 次循环后容量保持率为92 %.
| [1] |
Koksbang R, Barker J, Shi H, et al. Cathode materials for lithium rocking chair batteries[J].
Solid State Ionics, 1996, 84: 1–21. DOI: 10.1016/S0167-2738(96)83001-3. |
| [2] | 王剑, 其鲁, 珂克, 等. 新合成方法制备的LiCoO2 正极材料的 结构和电化学性能研究[J]. 无机化学学报, 2004, 20(6): 635–640. |
| [3] | 卢俊彪, 唐子龙, 乐斌, 等. 锂离子电池正极材料LiFePO4 的结构与 电化学性能的研究[J]. 高等学校化学学报, 2005, 26(11): 2093–2096. |
| [4] | Shin S S,Sun Y K,Amine K. Synthesis and electrochemical properties of Li[NixLi (1/3-2x/3)Mn (2/3-x/3)]O2 ascathode material for lithium secondary batteries[J]. Journal of Power Sources,2002,112: 632-638. |
| [5] |
Hong S, Park Y J, Ryu K S, et al. Charge/discharge behavior of Li[Ni0[J].
Solid State Ionics, 2005, 176: 1035–1042. DOI: 10.1016/j.ssi.2005.02.006. |
| [6] |
Yoojin Kim, Youngsik Hong, Min Gyu Kim, et al. Li0[J].
Electrochemistry Communications, 2007, 9: 1041–1046. DOI: 10.1016/j.elecom.2006.12.020. |
| [7] |
GeorgeTing-KuoFey, MuralidharanP, Yung-DaCho, et al. Electrochemical performanceandLiNMRstudiesonaninversespinelLiNi1/3Co1/3Mn1/3VO4 for Li-ion batteries[J].
Journal of Power Sources, 2007, 174: 1142–146. DOI: 10.1016/j.jpowsour.2007.06.097. |
| [8] |
Yanhuai Ding, Ping Zhang, Deshu Gao. Synthesis and electrochemical properties of layered Li[J].
Journal of Alloys and Compounds, 2008, 449: 343–348. DOI: 10.1016/j.jallcom.2006.01.132. |
| [9] |
Lu Z. H[J].
Electrochem. Soc. Synthesis, 2002, 149(7): A815–A822. DOI: 10.1149/1.1480014. |
| [10] | 钟盛文, 封志芳, 谢敏. 熔盐法合成LiMn1/3Ni1/3Co1/3O2及AA电池的电化学性能[J]. 有色金属科学与工程, 2011(1): 9–13. |
| [11] | 苏继桃, 苏玉长, 赖智广. 制备镍?钴?锰复合氢化物的热力学分析[J]. 电池工业, 2008, 13(1): 18–22. |
| [12] | 胡伟, 钟盛文, 张骞, 等. 不同锂比Li(1+x)Ni0[J]. 精细与专用化学品, 2008, 14(16): 11–13. |
 2012, Vol. 3
2012, Vol. 3
