| 熔盐法合成LiMn1/3Ni1/3Co1/3O2及AA电池的电化学性能 |
作为最新一代蓄电池, 锂离子电池具有比能量高、贮存寿命长、工作温度范围宽、工作电压高且平稳、环境友好、无记忆效应等一系列特点而逐渐成为人们研究的热点[1].目前, 作为锂离子电池的正级材料, 研究的热点主要集中在层状Li(Mn1/3Ni1/3Co1/3)O2材料[2-3], 该正极材料被认为是替代LiCoO2的左右前景的锂离子电池正极材料, 但它本身在填充性上存在问题[4].因此, 人们尝试采用不同的制备方法, 如高温固相法[5], 溶胶-凝胶法[6], 共沉淀法[7-8]等来提高锂电池正级材料的电化学性能.高温固相法是将各种含镍、钴、锰的盐和锂盐混在一起球磨然后高温烧结而成.工艺简单, 但原料混合不够均匀, 产品在组成、结构、粒径分布等方面存在比较大的差别.溶胶-凝胶法原料混合均匀, 还可以降低烧结温度, 但制备成本较高, 不适宜工业化生产.近年来, 有不少人尝试用熔盐法制备锂离子正极材料, 范未峰[9]等人用熔盐法合成了具有单一尖晶石结构的LiNi0.5Mn1.5O4正极材料; 杜柯[10]用熔盐法合成了结晶良好, 颗粒大小在数百个纳米左右的LiMn2O4, 该材料的初始容量有113mAh/g, 循环性能优良.常照荣, 吴峰等[11]人在空气气氛中, 采用熔融盐法, 用低共熔组成的0.3LiOH·H2O -0.62LiNO3混合锂盐体系, 与镍、钴、锰的盐在低温下得到结构和电化学性能良好的正极材料LiNiO2.但0.3LiOH·H2O-0.62LiNO3混合锂盐体系, 在200℃时不能完全熔化, 与前躯体不能达到均匀混合的程度, 而且成本较高.
本研究采用KCl为熔盐和镍、钴、锰的盐按计量比简单混合, 经过2个阶段温度烧结制备三元体系的锂离子正极材料, 分析对比了烧结温度和保温时间对Li(Mn1/3Ni1/3Co1/3)O2正极材料的结晶形态、大小、结构和电化学性能的影响.
1 实验 1.1 LiMn1/3Ni1/3Co1/3O2的制备将NiSO4·6H2O (含Ni2+:22.06%), MnSO4·H2O (含Mn2+:27.5%), CoCl2·6H2O (Co2+:20.2%), KCl (99.5%), Li2CO3(99.6%)按Li+: Ni2+: Mn2+:Co2+=1.05:1/3:1/3:1/3的化学计量比称取的混合物, 加入4倍于金属离子的量的KCl, 放入行星式球磨机研磨8 h (220 r/min).将研磨好的混合物置于坩埚中, 放入箱式电阻炉中, 在空气气氛下, 加热至一定温度(升温速率:5 ℃/min), 保温8 h.将反应得到的产物用去蒸馏水充分洗涤、抽滤, 除去KCl等盐.将滤饼放入烘箱中, 100 ℃烘干24 h, 研磨后过0.055mm筛, 之后放入真空干燥箱中在120 ℃下进行干燥, 即可得到LiMn1/3Ni1/3Co1/3O2材料.
1.2 实验电池的组装以制备的LiMn1/3Ni1/3Co1/3O2为正极材料, 乙炔黑为导电剂, 聚偏氟乙烯为粘结剂, 三者的质量比90:4:6, 加入N-甲基吡咯烷酮, 在行星式球磨机上进行球磨混合, 制成黏稠度合适的浆料, 在涂布机上将其涂敷到铝箔集流体上, 制成电池的正极.以杉杉公司生产的MCMB为负极材料, 乙炔黑为导电剂, 聚偏氟乙烯为粘结剂, 三者的质量比为90:3:7, 用上述方法制成浆料后涂敷到铜箔集流体上, 制成电池的负极.采用深圳新宙邦生产的1 mol/L LiPF6/DMC+EMC+EC(体积比为1: 1:1)电解液, 美国Celgard2300隔膜, 在通有流动干燥空气的手套箱中, 组装成AA型电池.
1.3 结构与电化学性能测试采用日本理学miniflex-XRD进行样品的物相分析, 用Cu靶Kα射线入射; 用XL30W/IMP扫描电镜(SEM)做样品的形貌分析, 其最高加速电压(30 kV), 最小分辨率(3 nm), 最大放大倍数(100 000)倍, 真空度(2.0 ×10-5 Pa); 由计算机控制的BTS -510与NEWARE BTI-XWJ-6.70M-01939电池循环测试仪自动采集记录充放电过程中电流电压及容量数据变化情况, 充放电电压范围为2.75~4.2 V.
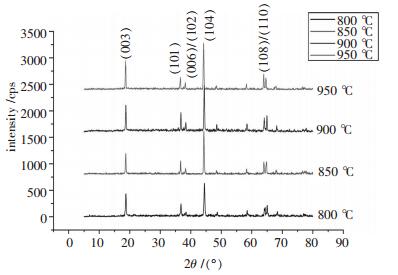
2 结果与讨论 2.1 焙烧温度对LiMn1/3Ni1/3Co1/3O2结构的影响图 1是在800℃恒温8 h、850℃恒温8 h、900℃恒温8 h、950℃恒温8 h合成样品的XRD图谱.
 |
| 图 1 煅烧温度不同样品的XRD图 |
从图 1中可以看出, 4种不同温度合成的样品, 图谱中(006)/(102)和(108)/(110)这组峰的分裂很明显, 表明这4个样品都具有较规整的层状结构, 没有其他杂质出现.800℃时样品的衍射峰强度较低, 表明800℃时的产物的晶格发育不完整, 随着焙烧温度的升高, 特征峰的衍射强度增强, 说明产物的晶化程度在增强.随焙烧温度的提高(恒温时间均为8 h), (003)和(104)峰强度的比值R = I(104)/I(003)比逐渐升高, 当温度达到900℃时, R达到最大值.温度进一步升高, R又下降了, 说明煅烧温度为900℃时, 合成产物的阳离子有序度最高.因此, 900℃是最佳煅烧温度.超过这个温度, 由于部分锂的挥发, 导致缺锂, 较多的锂位被二价镍离子占据, 使得R下降.
图 2是分别在850℃、900℃、950℃(都恒温8 h)合成的LiMn1/3Ni1/3Co1/3O2的SEM照片.
 |
| 图 2 不同温度时的LiMn1/3Ni1/3Co1/3O2的形貌 |
从图 2中可以看出, 800℃合成的样品颗粒较小, 晶粒大部分在纳米级500 nm左右, 形状较规则, 有部分团聚, 粒子与粒子之间接触较紧; 850℃合成的样品部分呈尖晶石外形, 形状不规则, 颗粒较小, 晶粒大部分在纳米级800 nm左右; 900℃合成的样品主要呈典型的尖晶石外形和块状, 颗粒不均匀, 晶粒在1~ 2μm; 950℃合成的样品部分呈尖晶石外形, 也有呈块状的, 晶粒在1~2μm.900℃和950℃合成的材料, 粒子与粒子之间空隙较多, 有利于电解液的渗透, 使得电解液中的Li+容易均匀地分散到LiMn1/3Ni1/3Co1/3O2材料中有助于获得较好的电化学性能.4种样品的SEM对比说明, 产物在900~950℃之间均可以形成完整的尖晶石结构, 随着温度的升高, 晶粒的生长速度急剧增加, 样品在950℃的温度下, 8 h就形成了微米级的产物颗粒.样品在850℃和800℃温度下, 8 h的反应后才形成纳米级颗粒.常照荣等[4]认为KCl在反应过程中起溶剂的作用.KCl的熔点是780℃左右, 当反应体系达到780℃时, KCl开始熔融, 熔融的KCl浸湿反应物的表面并浸透其中, 增大了它们的接触表面积, 大大加快了离子的扩散速率, 使反应物在熔融的KCl中实现原子尺度混合, 反应就由固固反应转化为固液反应.材料的电化学性能不仅与样品的晶化度有关, 也跟晶粒的大小有关, 此SEM的结果表明, 在900~950℃范围内合成LiMn1/3Ni1/3Co1/3O2材料时, 可以通过改变“温度”来制备得到具有最佳电化学性能的材料.
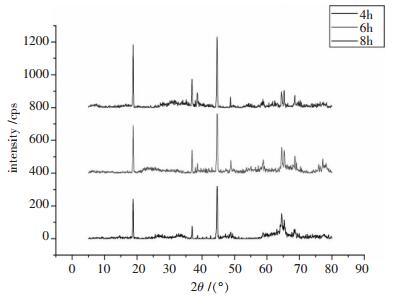
2.2 保温时间的影响图 3显示了在900℃恒温4 h、900℃恒温6 h、900℃恒温8 h时的LiMn1/3Ni1/3Co1/3O2的XRD图谱.
 |
| 图 3 保温时间不同样品的XRD图 |
从图 3中可以看出, 恒温4 h时合成的样品图谱中(006)/(102)峰的分裂不明显, 衍射峰强度较低, 表明保温4 h时的产物的晶格发育不完整, 随着保温时间的延长, 特征峰的衍射强度增强, 说明产物的晶化程度在增强.恒温6 h和8 h时合成的样品, 图谱中(006)/(102)和(108)/(110)这组峰的分裂很明显, 表明这2个样品都具有较规整的层状结构.恒温6 h时合成的样品图谱在2θ=77°附近出现了一个明显的杂峰.这可能是温度较高时锂盐挥发, 形成缺锂材料, 阳离子混排增加, 导致层状材料变化[12].
图 4显示了在900℃恒温4 h、900℃恒温6 h、900℃恒温8 h时的LiMn1/3Ni1/3Co1/3O2的形貌.
 |
| 图 4 不同保温时间LiMn1/3Ni1/3Co1/3O2的形貌 |
从图 4中可以看出, 恒温4 h时合成的样品形状较规则, 颗粒较小, 晶粒大部分在纳米级200 nm左右; 恒温6 h时合成的样品部分呈尖晶石外形, 有轻微的团聚现象, 晶粒在1~2μm; 恒温8 h时合成的样品形状较规则, 颗粒不均匀, 部分呈尖晶石外形, 晶粒在1~2μm.3种样品的SEM对比说明, 产物在保温6~8 h之间均可以形成较完整的尖晶石结构, 随着保温时间的延长, 晶粒的生长速度急剧增加, 样品在保温6 h时就形成了微米级的产物颗粒.样品在保温4 h时形成纳米级颗粒, 保温时间不够长, 晶化度较低, 还没有完全形成完整的晶粒.此SEM的结果表明, 在900℃保温6~8 h范围内合成LiMn1/3Ni1/3Co1/3O2材料时, 可以通过改变“保温时间”来制备得到具有最佳电化学性能的材料.
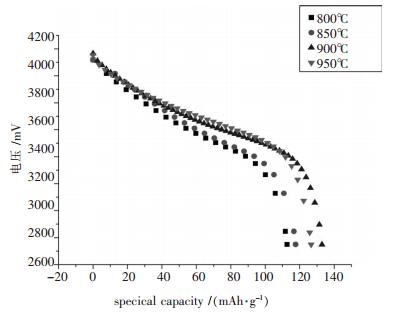
2.3 电化学性能图 5是4个样品在2.75~4.2 V范围内, 1C倍率下的首次放电比容量曲线.
 |
| 图 5 不同烧结温度的LiMn1/3Ni1/3Co1/3O2的首次放电曲线 |
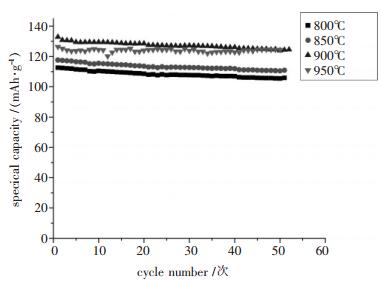
从图 5中可以看出, 950 ℃、900 ℃、850 ℃、800 ℃合成的样品的初始放电比容量分别为126.4 mAh/g、132.9 mAh/g、117.6 mAh/g、112.6 mAh/g.随着温度的增高放电平台逐渐变陡且约有升高, 放电平台为3.6 V左右, 放电电压也逐渐升高, 比容量先增后减.为了考察样品的循环性能, 对样品进行50次循环测试, 结果如图 6所示.
 |
| 图 6 LiMn1/3Ni1/3Co1/3O2的电化学曲线 |
由图 6可知, 在950 ℃、900 ℃、850 ℃、800 ℃时得到的样品在2.75~4.2 V范围内, 1C倍率下的电池初始放电比容量分别为126.4 mAh/g、132.9 mAh/g、117.6 mAh/g、112.6 mAh/g, 循环性能也较好, 50次后容量保持率分别为98.42%、93.75%、93.94%.可见, 温度稍高点, 合成的样品循环性能较好, 比容量衰减得更小.结合4个样品的XRD和SEM的结果, 可以对样品的比较中发现, 900℃样品和950℃样品从SEM上比850℃和800℃样品具有更好的晶体颗粒和外观形貌, 在电化学性能(初始放电比容量和循环稳定性)上也比850℃和800℃样品好, 这说明适量大的晶粒对电化学过程中锂离子的脱嵌和嵌入过程是有利的, 同时, 高温煅烧可以明显促进材料晶粒的生长.2个样品的XRD结果则表明, 材料在900~950℃之间均形成了典型的层状结构, 且没有观测到杂相信号, 这意味着Ni2+在LiMn1/3Ni1/3Co1/3O2固溶体中有着很好的相溶性.
图 7是在900℃不同保温时LiMn1/3Ni1/3Co1/3O2的电化学曲线.
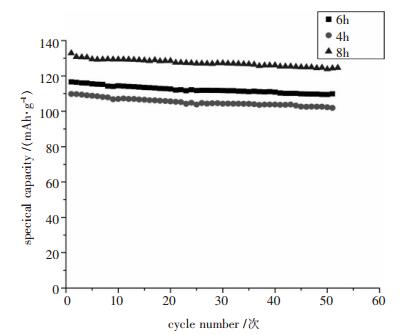 |
| 图 7 900℃不同保温时间LiMn1/3Ni1/3Co1/3O2的电化学曲线 |
由图 7可知,在900℃保温4 h、6 h、8 h时得到的电池在2.75~4.2V范围内,1C倍率下的初始放电比容量分别为109.8mAh/g、111.6mAh/g、132.9mAh/g循环性能也较好,50次后容量保持率分别为99.35%、94.25%、93.94%.可见,保温时间稍长点,有利于晶体的生长,提高晶化度,合成的样品初始容量较好.
3 结论(1) 采用熔盐法, 为反应提供了一个液态环境, 使反应更充分, 而熔盐可以通过简单的过滤洗涤除去.
(2) 熔盐法合成的LiMn1/3Ni1/3Co1/3O2结晶良好, 颗粒主要在1-2μm, 该材料循环性能较好.
(3) 在900℃保温8h时合成的LiMn1/3Ni1/3Co1/3O2具有较好的电化学性能, 制作成AA电池, 在2.75~ 4.2 V之间进行充放电测试, 在1 C倍率下放电, LiMn1/3Ni1/3Co1/3O2的初始放电容量可达132.9 mAh/g.循环50多次后容量仍为124.6mAh/g, 容量保持率为93.75%.
| [1] |
Bloom I, Christophersen J, Gering K. Diferential Voltage Analyses of High-power Lithium-ion Cells[J].
Journal of Power Sources, 2005, 139: 304–313. DOI: 10.1016/j.jpowsour.2004.07.022. |
| [2] |
禹筱源, 胡国荣, 彭忠东, 等. 层状LiMn1/3Co1/3Ni1/3O2正极材料合成及电化学性能[J].
电源技术, 2005, 29: 643–697.
|
| [3] |
钟盛文, 李培植, 张骞, 等. 锂离子蓄电池正极材料LiCo1/3Ni1/3Mn1/3O2的安全性能[J].
电源技术, 2007, 31: 954–970.
DOI: 10.3969/j.issn.1002-087X.2007.12.005. |
| [4] |
汤宏伟, 赵付双, 常照荣, 等. 熔融盐法合成镍系锂离子电池正极材料的研究进展[J].
材料导报, 2008(6): 22–6.
|
| [5] |
wang Zhaoxiang, Sun Yucheng, Chen Liquan, et al. Electrochemical Characterization of Positive Electrode Material Li(Mn1/3Ni1/3Co1/3)O2 and Compatibility with Electrolyte for Lithium-ion Batteries[J].
Electrochem Soc, 2004, 151(6): A914–A921. DOI: 10.1149/1.1740781. |
| [6] |
韦旖旎, 赖琼珏, 高媛, 等. 层状Li(Co1/3Ni1/3Mn1/3)O2正极材料的合成及电化学性能研究[J].
无机化学学报, 2005(7): 999.
|
| [7] |
应皆荣, 姜长印, 万春荣, 等. 锂离子电池高密度球形系列正极材料[C]//中国储能电池与动力电池及其关键材料学术研讨会论文集, 长沙: 2005.
http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGYY200505001002.htm |
| [8] |
禹筱元, 胡国荣, 刘业翔. 层状Li(Mn1/3Ni1/3Co1/3)O2正极材料的性能研究[C]//中国储能电池与动力电池及其关键材料学术研讨会论文集, 长沙: 2005.
|
| [9] |
范未峰, 于作龙. 熔盐法合成Li Ni0. 5Mn1. 5O4及电化学性能[C]//第2届中国储能与动力电池及其关键材料学术研讨与技术交流会, 成都: 2007: 11.
|
| [10] |
杜柯, 其鲁. 熔盐法制备LiMn2O4[J].
无机化学学报, 2006(5): 159–163.
|
| [11] |
常照荣, 吴峰. LiOH -LiNO3低共熔混合锂盐体系合成LiMn1/3 Ni1/3Co1/3O2[J].
物理化学学报, 2008, 24(3): 513–519.
|
| [12] |
Yasuhiro F J, Hiroshi M, Naoto S, et al. Optimization of Carbon Coatings on LiFePO4[J].
Power Sources, 2007. |
 2011, Vol. 2
2011, Vol. 2
