| LiNi0.5Mn0.5O2的合成及其AA电池电化学性能 |
新型层状LiNi0.5Mn0.5O2材料因其价格低廉、无毒以及高比容量(其理论比容量高达280mAh/g[1])等优点,成为人们研究的热点[2-9].它综合了LiNiO2和LiMn2O4的优点,克服了它们的缺点[10-11].因为LiNi0.5Mn0.5O2可以看作是由Li2MnO3和LiNiO2之间的固溶体,其中的Mn为+4价,在充放电过程中没有价态的变化,其中Li2MnO3能起到稳定材料结构的作用.
钟清华[12]等用超声波辅助溶胶-凝胶法合成层状的锂离子电池的正极材料LiNi0.5Mn0.5O2.当材料在2.8 ~4.2V间进行充放电时,其首次放电容量为170mAh/g,50次循环后容量的保持率为89%.由于溶胶-凝胶法成本高,不利于工业化大生产.笔者采用化学共沉淀法的方法来制备前驱体,再通过高温焙烧来得到目标材料,合成工艺较为简单.研究了不同Li/ (Mn+Ni)摩尔比、不同焙烧制度对材料结构、形貌的影响.并将其制备成AA电池,研究不同化成电压对其电化学性能的影响.
1 实验用共沉淀法制备Ni0.25Mn0.25OH前驱体,再分别按Li/(Mn +Ni)摩尔比为1.02、1.05、1.08、1.10将其与Li2CO3混合,于500℃下焙烧10h,再在850℃下焙烧24h即得不同Li/(Mn+Ni)摩尔比材料.另将制备Ni0.25Mn0.25OH前驱体按Li/(Mn+Ni)摩尔比为1.08与Li2CO3混合,按不同焙烧制度(如表 1所示)合成不同焙烧制度样品材料.
| 表 1 样品的焙烧制度 |
 |
| 点击放大 |
采用飞利浦的XL30W/TMP扫描电镜对材料进行形貌分析.采用日本理学公司生产的Miniflex型转靶X射线衍射仪分析材料的物相组成.仪器的主要参数如下:管压40kV;管流10mA;CuKα靶辐射,λ= 0.15418nm;石墨弯晶单色器Rc=0.3mm.扫描步长为0.02°.扫描范围:2θ=10~100°.
将制备的正极材料按正极活性物质:导电剂乙炔黑:粘接剂聚偏氟乙烯=90:4:6(质量比)称量一定量的目标材料、乙炔黑和PVDF,将前两者充分混合后加入到溶解了PVDF的NMP中,充分混合调至糊状后将其均匀地涂布在铝箔上,经烘干、分切、辊压等工序制成长37cm,宽3.8cm的正极片.以中间相碳微球(MCMB)为负极活性物质,乙炔黑为导电剂,聚偏氟乙烯为粘接剂,三者按质量比为90:3:7称量,加入适量的N-甲基吡咯烷酮,混合均匀制成浆料,然后涂敷到铜箔上,经烘干、切片、辊压等工序制成长42cm,宽4cm的负极片.将正极片焊上极耳,与负极极片、隔膜卷绕成电芯,装到AA电池壳里,经滚槽、注液、焊盖帽、封口等工序制成AA电池,电池在静置9h后,再进行化成和电化学性能测试.电池隔膜为日本宇部产3025,电解液为深圳新宙邦生产的1mol/L LiPF6/DMC+EMC+EC(体积比1: 1:1),采用武汉Land2000电池测试系统进行电化学性能测试.
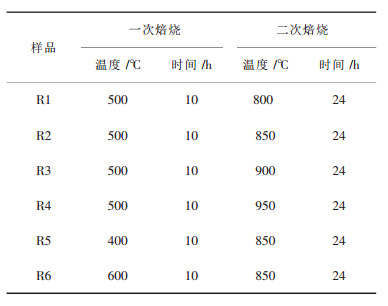
2 结果与计论 2.1 物相结构分析图 1为不同Li/(Mn+Ni)摩尔比材料的XRD图.各材料的特征峰符合标准的α-NaFeO2特征峰.Li/(Mn+ Ni)摩尔比为1.05和1.08材料的衍射峰要强于Li/ (Mn+Ni)摩尔比为1.02和1.10材料.其中2θ=65°位置附近的衍射峰逐渐(018)和(110)两个峰分裂均不够明显,表明材料的层状结构不够完善.可能是因为二次焙烧温度(850℃)较低导致.
 |
| 图 1 不同Li/(Mn+Ni)摩尔比材料XRD图 |
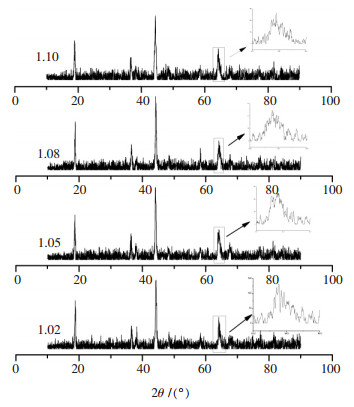
图 2为不同焙烧温度材料的XRD图.R2、R5和R6为不同一次焙烧温度(分别为400℃、500℃、600℃)、相同二次焙烧温度(850℃)材料,其中R6材料在2θ=65°位置附近的(018)和(110)两个衍射峰分裂较R2、R5明显,这表明提高材料的一次焙烧温度,能提高材料的结晶完美度.R1、R2、R3和R4为相同一次焙烧温度(500℃)、不同二次焙烧温度(分别为800℃、850℃、900℃、950℃)材料.不难发现,随着二次焙烧温度的升高,材料的衍射峰逐渐增强.当二次焙烧温度达到900℃后,在2θ=65°位置附近,衍射峰逐渐分裂成(018)和(110)两个峰,表明样品的结晶度逐渐变好.由此可知,提高材料的一次焙烧温度和二次焙烧温度,均能使材料的晶型更完善,理论上也应有更好的充放电性能,而在后面的实验研究中发现,一次焙烧温度过高或二次焙烧温度过高,材料的放比电容量反而均有所降低.
 |
| 图 2 不同焙烧制度材料XRD图 |
2.2 形貌分析
图 3是R1、R2、R3、R4材料的SEM图.由图 3可以看出,所有材料的一次晶粒粒径均小于0.5μm,颗粒大小比较均匀.随着再次焙烧温度T 2升高,一次晶粒粒径逐渐增大,团聚颗粒尺寸也越大.由于这些样品的一次晶粒尺寸都较小,便于材料与电解液充分接触,利于锂离子在充放电过程中通道的畅通.
 |
| 图 3 不同焙烧温度材料的SEM图 |
2.3 电化学性能
图 4是不同Li/(Mn+Ni)摩尔比材料在25℃、电流密度为0.3mA/cm2、电压2.75~4.2V条件下化成,并在25℃、2.75~4.2V下1C倍率循环的放电比容量-循环次数图.Li/(Mn+Ni)摩尔比为1.02、1.05、1.08和1.10时材料的首次充放电比容量分别为106.1、131.8、134.8和134.5mAh/g;循环50次后,比容量分别为94、126.3、131.6、128.3 mAh/g.其中Li/(Mn+Ni)摩尔比为1.08目标材料的比容量和循环性能均优于其他材料,所以试验得出最优Li/(Mn+Ni)摩尔比为1.08.
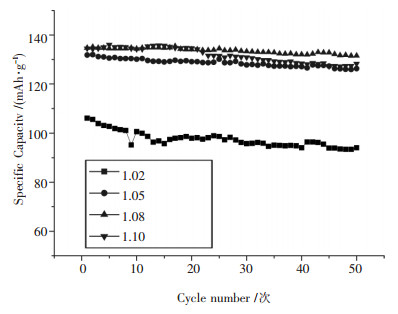 |
| 图 4 不同Li/(Mn+Ni)摩尔比材料的放电比容量-循环次数 |
图 5为不同焙烧制度材料在不同化成制度、相同循环制度的比容量-循环次数图.图 5(a)为各材料在25℃、电流密度为0.3mA/cm2、电压2.75~4.2V条件下化成,并在25℃、2.75~4.2V下1C倍率循环的放电比容量-循环次数图.R1、R2、R3、R4、R5、R6材料的首次充放电比容量分别为117.6、134.8、131.5、121.5、132.2、125.5mAh/g,循环50次后分别为85.3、131.6、127.4、116.6、117.8、106.6mAh/g,容量保持率分别为72.5%、97.6%、96.9%、96%、84.9%.图 5(b)为各材料在25℃、电流密度为0.3mA/cm2、电压2.75~ 4.6V条件下化成,并在25℃、2.75~4.2V下1C倍率循环的放电比容量-循环次数图.R1、R2、R3、R4、R5、R6材料的首次充放电比容量为117.9、147.6、145、126.3、148.9、148.2mAh/g,循环50次后分别为100.8、140.7、133、116.6、131.5、125.9mAh/g,容量保持率分别为85.5%、95.3%、91.7%、92.3%、88.3%、85%.综合分析图 5(a)与图 5(b)发现,合成LiNi0.5Mn0.5O2材料最佳焙烧温度:一次焙烧温度为500℃,二次焙烧温度为850℃.另外也不难发现,提高材料的化成电压,能提高材料的初始比容量,但是材料的循环性能会下降.
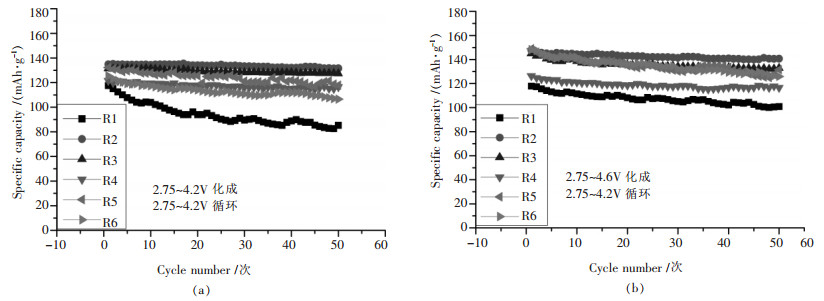 |
| 图 5 各材料在不同化成条件下的放电比容量-循环次数 |
图 6(a)为R2材料在2.75~4.2V下化成,2.75~ 4.2V下1C倍率循环的充放电曲线图及对应微分容量曲线图.图 6(b)为R2材料在2.75~4.2V下化成,2.75~4.2V下1C倍率循环的充放电曲线图及对应微分容量曲线图.在充放电曲线图中可见,在循环50次后,不同化成电压R2材料的充电曲线都略有上升,放电曲线略有下降,这表明随着循环次数的增加,材料极化越来越大,放电平台和容量均出现不同程度的递减.由对应微分容量曲线图可看出,不同化成电压R2材料在3V左右均没有产生任何峰,根据文献[13]报道,若存在Mn2+,在2.9V(vs.Li+/Li)产生Mn3+/Mn4+的氧化峰,这表明所有合成材料中的Mn均为+4价,在充放电过程中,Mn不参与氧化还原反应.在2.72~4.2V下化成的R2材料在3.6V和3.5V出现了一对氧化/还原峰,氧化/还原峰位置之间的电位差约为0.1V;在2.72~4.6V下化成的R2材料在3.6V和3.75V出现了一对氧化双峰,在3.5V左右出现了一个还原峰,氧化与还原峰位置之间的电位差分别约为0.1V、0.15V.这表明提高材料的化成电压,材料的极化也增大.经多次循环,材料的氧化峰和还原峰的峰电流总体都呈减小的趋势,说明通过正极材料的电流值减小,即Li+嵌入/脱出速率降低,说明正负极/溶液的界面电阻增大,从而导致Li+在正极中的嵌入/脱出的阻力增大,使得正极的氧化还原电流减小.
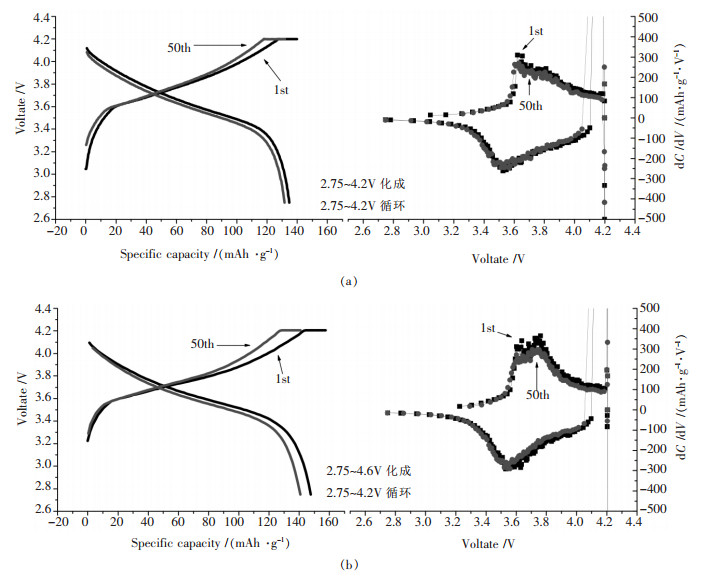 |
| 图 6 R2材料的不同充放电曲线图及对应容量微分曲线 |
3 结论
通过共沉淀法制备的LiNi0.5Mn0.5O2材料具有二维层状结构.结果表明,当初始Li/(Mn+Ni)摩尔比为1.08、一次焙烧温度为500℃、二次焙烧温度为850℃焙烧得到的样品电化学性能最佳.在25℃、电流密度为0.3mA/cm2,2.75 ~4.2V条件下化成,在25℃、2.75~4.2V下1C倍率循环的首次放电比容量可达134.8mAh/g,循环50次后为131.6mAh/g,容量的保持率为97.6%.在25℃、电流密度0.3mA/cm2,2.75~ 4.6V条件下化成,在25℃、2.75~4.2V下1C倍率下循环,首次充放电比容量为147.6mAh/g,循环50次后140.7mAh/g,容量保持率为95.3%.
| [1] |
Meng X L, Dou S M, Wang W L. High Power and High Capacity Cathode Material LiNi0.5Mn0.5O2 for Advanced Lithium-ion Batteries[J].
Journal of Power Sources, 2008, 184: 489–493. DOI: 10.1016/j.jpowsour.2008.04.015. |
| [2] |
Kang S H, Kim J, Stoll M E, et al. Layered Li(Ni0.5-xMn0.5-xM′(2x))O2(M' =Co, Al, Ti; x =0, 0.025)Cathode Materials for Li -ion Rechargeable Batteries[J].
Journal of Power Sources, 2002(1): 41–48. |
| [3] |
彭小琦, 王志兴, 李新海, 等. 正极材料LiNi0.5Mn0.5O2的合成及其性能研究[J].
电源技术, 2006, 30(4): 301–304.
|
| [4] |
肖劲, 曾雷英, 陈召勇, 等. 离子电池正极材料LiNi0.5Mn0.5O2的合成[J].
无机化学学报, 2006, 22(4): 685–690.
|
| [5] |
曹四海, 王志兴, 李新海, 等. 李新海, 等.固相法制备层状LiNi0.5Mn0.5O2的研究[J].
电池工业, 2006, 11(3): 178–181.
|
| [6] |
王志兴, 曹四海, 李新海, 等. 初始Li/(Mn+Ni)摩尔比对LiNi0.5Mn0.5O2材料电化学性能的影响[J].
中国有色金属学报, 2006, 16(8): 1434–1438.
|
| [7] |
Park S H, Kang S H, Johnson C S, et al. Lithium-manganese-nickeloxide Electrodes with Integrated Layered-spinel Structures for Lithium Batteries[J].
Electrochemistry Communications, 2007(9): 262–268. |
| [8] |
Makimura Y, Ohzuku T. Lithium Insertion Material of LiNi0.5Mn0.5O2 for Advanced Lithium -ion batteries[J].
Journal of PowerSources, 2003, 119(Sp.Iss.SI): 156–160. |
| [9] |
Li D.C, Sasaki Y, Kobayakawa K, et al. Mpact of Cobalt Substitution for Manganese on the Structural and Electrochemical Properties of LiNi0.5Mn0.5O2[J].
Electrochimica Acta, 2006, 51(18): 3809–3813. DOI: 10.1016/j.electacta.2005.10.046. |
| [10] |
Numata K, aki C, amanaka S. Synthesis and Characterization of Layer Structured SDolid Solutions in the System of LiCoO2 -Li2MnO3[J].
Solid State Ionics, 1999, 117: 257. DOI: 10.1016/S0167-2738(98)00417-2. |
| [11] |
Lu Z J, Dahn R. A Comparison of the Electrode/Electrolyte Reaction at Elevated Temperatures for Various Lo-ion Battery Cathodes[J].
J Electrochem Soc, 2002, 108: 8–14. |
| [12] |
钟清华, 袁中直. 层状的LiNi0.5Mn0.5O2合成及其电化学性能[J].
电源技术, 2009, 33(7): 543–546.
|
| [13] |
Paulsen J M, Thomas C L, Dahn J R. O2 Structure Li2/3[Ni1/3Mn2/3]O2:a New Layered Cathode Material for Rechargeable Lithium Batteries I[J].
Electrochemical Properties J Electrochem Soc, 2000, 147(3): 861. DOI: 10.1149/1.1393283. |
 2010, Vol. 1
2010, Vol. 1
