| 异极矿的氨法浸出研究 |
随着硫化锌矿资源日趋枯竭,氧化锌矿的大规模开采利用已成为锌冶炼的重要研究方向[1]。异极矿(Zn4Si2O7(OH)2·H2O)是重要的具有工业价值的氧化锌矿物之一[2],通常产于铅锌硫化物矿床氧化带中,与铅锌铁的硫化物共生,其处理方法一直深受冶金工作者的关注。
目前生产上多采用硫酸直接浸出处理高硅氧化锌矿,使硅和锌分别以硫酸锌和硅酸形态进入溶液。比较成熟的工艺有老山工艺(Vieelle-Montagne)、中和凝聚法和瑞底诺(Radina)法[3],这三种工艺采用不同的方法将矿浆中SiO2在凝胶前以不同形式除去。酸浸过程中存在的主要问题是硅的絮凝导致矿浆过滤困难,严重影响液固分离,同时大量钙、镁、铁、锰等杂质离子进入溶液,增加酸耗,也增大了溶液净化难度。
氧化锌矿的碱法浸出分为氢氧化钠浸出和氨水-铵盐体系浸出。在氢氧化钠处理氧化锌矿过程中,锌转化成锌酸钠溶解,硅则以硅酸钠的形式存在于溶液中,不会生成硅酸形成硅胶,但是在后续溶液净化中要沉硅。氨法浸出中,锌与氨生成锌氨络合离子进入溶液,净化后送电积或蒸氨煅烧,制取阴极锌、氧化锌、碳酸锌和锌粉等产品。相比而言,氨法浸出具有原料适用广泛,净化负担轻,工艺流程短等优点。国内外对氨法浸出氧化锌矿研究的历史较长[4],但是对于高硅氧化锌矿的氨法处理没有进行系统研究,并且研究者对浸出过程观点不一致。Harvey等[5-6]认为硅酸锌矿物不能被氨水或氨-铵盐体系浸出,锌的回收率和收益取决于原料的性质,国内杨声海等[7-10]认为含硅锌矿物中的锌在氨体系中不会溶解,而张元福等[11-12]则认为异极矿能够与铵盐反应,生成锌氨络合离子,硅以石英的形式沉淀或生成原硅酸。以上研究均以复杂氧化锌矿为研究对象,没有专门对硅酸锌矿物的氨法浸出进行深入探讨,本文以氨-硫酸铵溶液作浸出剂,对硅酸锌异极矿在氨体系中浸出行为进行了系统研究。
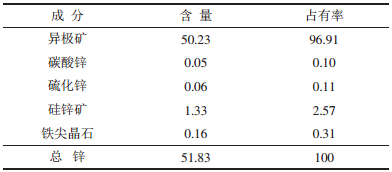
1 试验研究 1.1 试验原料矿样取自云南某地区,其物相分析结果见表 1和图 1。从表 1和图 1可以看出,矿石中主要锌矿物为异极矿,含有微量的硫化锌、铁酸锌和少量硅锌矿。
| 表 1 异极矿氧化锌矿的锌物相分析 w/% |
 |
| 点击放大 |
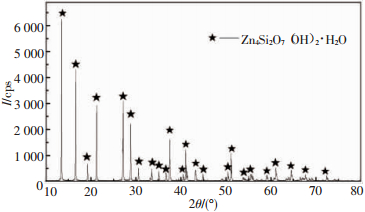 |
| 图 1 异极矿的XRD衍射图 |
1.2 试验方法
浸出剂按不同浓度要求配制并标定好备用。每次试验称取原矿试样10g,按试验设计的液固比加入浸出剂,在500mL三口瓶中用S212恒速搅拌器进行密闭搅拌浸出,76-1A数显恒温水浴加热。浸出完成后,立即将矿浆进行过滤,用氨水洗涤浸出渣三次,洗液与浸出液合并后计量总体积。
1.3 分析与测试采用EDTA标准溶液滴定法测定锌的浓度,移取1mL浸出后液于100mL锥形瓶中,加水稀释至15mL,加入1滴甲基橙(1g/L),以(1+1)盐酸滴至恰变红色,加入5mL饱和硫脲,5mL200g/L氟化钾溶液,20mL乙酸-乙酸钠缓冲溶液后摇匀。滴入2滴5g/L二甲酚橙指示剂,用0.04mol/LEDTA标准溶液滴定至溶液由紫红色变亮黄色,即为终点。计算锌的浸出率,其他含量低的元素采用美国贝尔德TS-6型ICP仪器进行检测。
2 结果与讨论 2.1 总氨浓度对浸出率的影响不同总氨浓度下锌的浸出率变化如图 2所示。由图 2可见,锌的浸出率随总氨浓度增大而升高,最低为41.08%,最高为89.2%。浸出规律与氨水-铵盐体系浸出菱锌矿等氧化锌矿的规律相同[13]。在浸出过程中,其反应有:
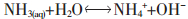
|
(1) |
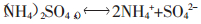
|
(2) |
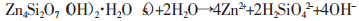
|
(3) |
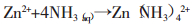
|
(4) |
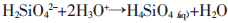
|
(5) |
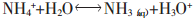
|
(6) |
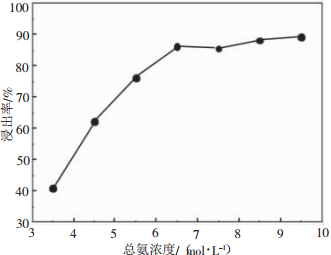 |
| 反应温度为25 ℃,液固比20,搅拌速率300 r/min,NH3:(NH4)2SO4摩尔浓度比为1:1,浸出时间3 h 图 2 总氨浓度对锌浸出率的影响 |
由Zn-NH3-H2O系的电位-pH图[14]可以看出,Zn(NH3)42+的稳定区域在pH=8~11范围之间。由于浸出剂NH3和(NH4)2SO4体系为缓冲溶液,pH值始终稳定在8-9之间,当加入异极矿,异极矿首先按反应式(3)发生水解反应。在锌量一定的情况下,总氨浓度愈高,与Zn2+配位生成氨配离子Zn(NH3)42+的NH3(aq)浓度越高,Zn(NH3)42+的稳定区越大,有利于反应向右进行,异极矿的浸出率愈高。当总氨浓度超过7mol/L的时候,浸出率变化趋于缓和,实验确定总氨浓度以8.5mol/L为宜。
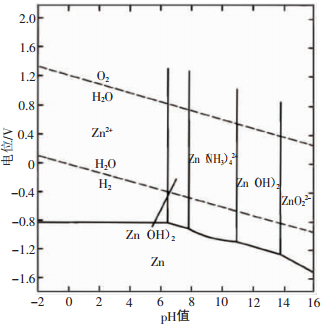 |
| 25 ℃,101.3 kPa;总氨浓度为1 mol/L;离子活度10-2[14] 图 3 Zn-NH3-H2O系的电位-pH值图 |
2.2 NH3占总氨比率对锌浸出率的影响
NH3占总氨的摩尔比率对锌浸出率的影响见图 4。由图 4可以看出,固定总氨浓度8.5mol/L,仅用氨水溶液或硫酸铵溶液做浸出剂,浸出率分别只有3.02%和4.02%,而氨水溶液和硫酸铵溶液按一定配比加入,浸出率迅速提升至80%以上。当锌浸出率达到最大时,NH3占总氨的摩尔比率为1:2,即NH3和(NH4)2SO4摩尔浓度比为2。文献[15]对ZnNH3-(NH4)2SO4-H2O体系进行了热力学平衡计算,确定NH3和(NH4)2SO4摩尔浓度比为2时体系具有最高锌平衡浓度,本研究与其一致。这是由于仅用硫酸铵溶液作浸出剂,有利于反应式(6)和(4)向右进行,Zn2+与NH3(aq)配位生成Zn(NH3)42+的同时,产生大量的H+,导致溶液pH值降低(试验测得pH < 6.5),而Zn(NH3)42+的稳定区域的pH为8~11,在pH值小于8时,不利于Zn2+与NH3(aq)的配合,从而降低了锌的浸出;随着氨水的加入,由于氨水为弱碱性溶液,浸出液pH值升高,同时为Zn2+与NH3(aq)的配合提供了足够数量的配位NH3(aq),生成Zn(NH3)42+的量增加,锌浸出率增大;当氨水浓度太高,NH3·H2O电离为NH4+困难,溶液中NH4+浓度很低,导致反应式(3)产生的OH-,不能及时被NH4+中和,抑制了异极矿溶解反应正向进行,并且溶液pH值大于11,Zn(NH3)42+的稳定性降低,从而降低了锌的浸出。
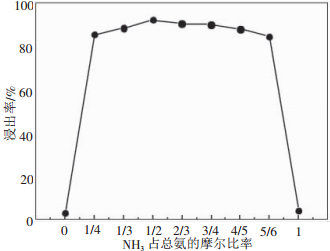 |
| 反应温度为25 ℃,液固比20,总氨浓度8.5 mol/L,搅拌速率300 r/min,浸出时间3 h 图 4 NH3占总氨的比率对锌浸出率的影响 |
2.3 液固比对锌浸出率的影响
图 5为不同液固比下锌的浸出率。由图 5可知,在NH3和(NH4)2SO4摩尔浓度比和总氨浓度固定的条件下,锌的浸出率随浸出液固比的增大而升高。
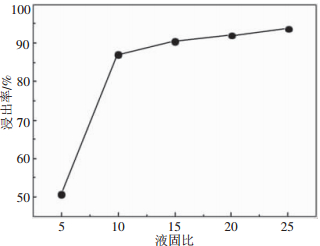 |
| 总氨浓度8.5 mol/L,NH3和(NH4)2SO4摩尔浓度比为2:1,搅拌速率300 r/min,反应时间3 h,室温 图 5 液固比对锌浸出率的影响 |
由扩散理论可知,多相反应速率与反应物在扩散层两面的浓度差(Δc=c-cs)成正比,当相界面处的浓度cs趋向于零时,反应速率就近似的与反应物在本体相内的浓度c成正比。为获得较大的反应速率,可适当地提高作用物的浓度或不断地取走产物,以提高扩散层两面的浓差值Δc。
不同液固比的浸出体系浸出异极矿时,在反应之初,总氨浓度、氨铵比和异极矿量均相同,异极矿颗粒表面扩散层内外界面的浓差值Δc相同,所以初始反应速率相同,即单位时间有等量的锌进入溶液,而液固比大的溶液体积也大,相应地,溶液中锌氨络合离子的浓度就低,导致在扩散层内外界面的浓度差Δc更大,使得反应生成的锌氨络合离子由相界面穿过扩散层向外扩散的推动力更大,同时,总氨物质的量也大,提供了更多的与Zn2+配位的NH3(aq),锌浸出率提高;当液固比大于15时,Δc的变化相对变小,更重要的是异极矿尚有少量难以浸出的锌,此时,锌浸出率提高有限。本试验确定最佳液固比为20:1。
2.4 反应时间对锌浸出率的影响反应时间对锌浸出率的影响如图 6所示。由图 6可知,异极矿中的锌浸出速度较快,反应时间10min时浸出率达到83.2%,超过60min时浸出率变化甚微。这表明在本试验条件下,异极矿具有较好的浸出效率。确定最佳浸出时间为1h。
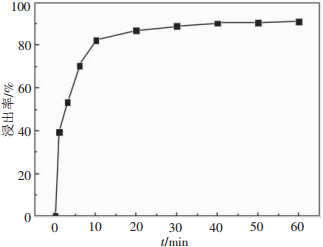 |
| 总氨浓度8.5 mol/L,NH3和(NH4)2SO4摩尔浓度比为2:1,液固比20,搅拌速率300 r/min,室温 图 6 反应时间对锌浸出率的影响 |
2.5 温度对锌浸出率的影响
反应温度对浸出率的影响见图 7。由图 7可见,温度升高,锌浸出率提高。这是因为温度升高,增加了作用物分子的平均能量,即高能的活化分子增多,分子运动速率加快,从而提高了有效碰撞次数,增加了化学反应速率;同时温度升高加速了氨分子由溶液本体扩散穿过边界层进入到异极矿表面上,外扩散速度加快,生成的锌氨络合离子通过产物层向边界层扩散速度也增快,所以选用较高的温度有利于异极矿中的锌浸出。但过高的温度造成氨的挥发,故确定最佳的反应温度为45℃。
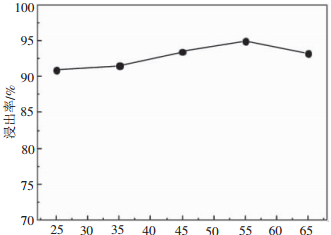 |
| 总氨浓度8.5 mol/L,NH3和(NH4)2SO4摩尔浓度比为2:1,液固比20,搅拌速率300 r/min,反应时间1 h 图 7 反应温度对浸出率的影响 |
2.6 搅拌速率对锌浸出率的影响
搅拌速率对锌浸出率的影响如图 8所示。由图 8可见,随着搅拌速率的提高,锌的浸出率不断提高,但是当搅拌速率超过200r/min,锌的浸出率变化不明显。这是因为氨浸出异极矿的过程中,浸出过程的化学作用在固相与液相交界面上进行,在被溶解的固体表面上就形成一层薄的扩散层。增大搅拌速度,会降低附着在固体表面的水层厚度,从而降低扩散层厚度,并增加反应速率;搅拌同时具有一定的破碎与解离作用,使反应产物很快脱离矿粒表面,矿粒和溶液充分接触,使溶解过程快速进行。但是搅拌加强不能破坏固体与扩散层之间的附着力,因此不能完全消除扩散层,所以当搅拌到一定程度后,对浸出速度的作用不会继续增加。试验确定最佳的搅拌速率为250r/min。
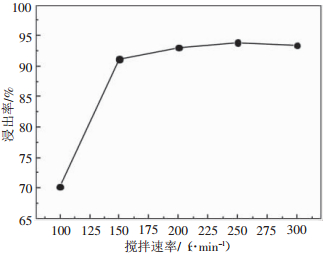 |
| 总氨浓度8.5 mol/L,NH3和(NH4)2SO4摩尔浓度比为2:1,液固比20,反应温度45 ℃,时间1 h 图 8 搅拌速率对锌浸出率的影响 |
3 结论
采用NH3和(NH4)2SO4体系能很好地浸取异极矿中的锌,为氨法从氧化锌矿特别是高硅低品位氧化锌矿中提锌提供了依据。最优实验条件为:氨-硫酸铵体系总氨浓度8.5mol/L,NH3和(NH4)2SO4摩尔浓度比为2:1,液固比20,反应温度45℃,搅拌速率250r/min,时间1h。在最优实验条件下,锌浸出率为93.84%。
| [1] |
王濮, 潘兆橹, 翁玲宝.
系统矿物学:中册[M]. 北京: 地质出版社, 1984: 243-244.
|
| [2] |
谭欣, 李长根. 国内外氧化铅锌矿浮选研究进展(Ⅰ)[J].
国外金属矿选矿, 2003(3): 7–14.
|
| [3] |
陈家镛, 杨守志, 柯家骏.
湿法冶金手册[M]. 北京: 冶金工业出版社, 2005: 745-746.
|
| [4] |
Wilson F L. Zinc Extraction from Colorado Sulfide ores[J].
Mining Engineering, 1914(40): 337–337. |
| [5] |
Harvey T G. The hydrometallurgical extraction of zinc by ammonium carbonate: A review of the Schnabel process[J].
Mineral Processing Extractive Metalurgy Review, 2006(4): 231–279. |
| [6] |
Aletan G. Ammonia leaching of oxidized lead-zinc ores of Iran[J].
Geol. Survey of Iran, 1969(15): 19–66. |
| [7] |
杨声海, 唐漠堂, 邓昌雄, 等. 由氧化锌烟灰氨法制取高纯锌[J].
中国有色金属学报, 2001, 11(6): 1110–1113.
|
| [8] |
张保平, 唐谟堂. NH4Cl-NH3-H2O体系浸出氧化锌矿[J].
中南工业大学学报, 2001, 32(5): 483–386.
|
| [9] |
杨声海, 李英念, 巨少华, 等. 用NH4Cl溶液浸出氧化锌矿石[J].
湿法冶金, 2006, 25(4): 56–59.
|
| [10] |
罗建平, 王维熙. NH3-CO2-H2O体系浸出锌焙烧砂试验研究[J].
矿产综合利用, 2005(3): 10–13.
|
| [11] |
张元福, 梁杰. 铵盐法处理氧化锌矿的研究[J].
贵州工业大学学报, 2002, 31(1): 37–41.
|
| [12] |
朱云, 胡汉, 苏云生, 等. 难选氧化锌矿氨浸动力学[J].
过程工程学报, 2002, 2(1): 81–85.
|
| [13] |
Zapata V M, Lozano B L. Ammoniacal leaching of Waelz oxides[J].
Anales de Quimica International Edition, 1998(94): 156–159. |
| [14] |
Meng Xinghui, Han K N. The principles and applications of ammonia leaching of metal—A Review[J].
Mineral Processing and Extractive Metallurgy Review, 1996(16): 23–61. |
| [15] |
唐谟堂, 鲁君乐, 袁延胜. Zn-NH3-(NH3)2SO4-H2O系的氨络合平衡[J].
中南矿冶学院学报, 1994(6): 701–705.
|
 2009, Vol. 23
2009, Vol. 23
