| 四水合三氯化铟的脱水过程分析 |
2. 昆明理工大学 材料与冶金工程学院 真空冶金国家工程实验室, 云南 昆明 650093
2. The State Key Lab of Vacuum Metallurgy, Faculty of Materials and Metallurgy Engineering, Kunming University of Science and Technology, Kunming 650093, Yunnan, China
无水InCl3是制备ITO薄膜和Ⅲ~Ⅴ族半导体材料的主要原料[1],也是合成有机铟系列化合物的基本原料[2-3],还可用作有机反应的催化剂[4],在有机合成和电子工业方面有广泛的应用[5-6]。三氯化铟具有耐水、高效、选择性好等优点,能够在温和的反应条件下有效地促进多种有机反应的顺利进行,显示出良好的应用前景。目前国内仅能生产InCl3·4H2O,而高纯无水InCl3必须进口,价格昂贵。制备无水InCl3的方法主要有金属铟直接氯化法[7]、氧化物分解氯化法[8]和水合物加热脱水法[9]、有机溶剂法[10]、逐步升温氯化法[11]等。
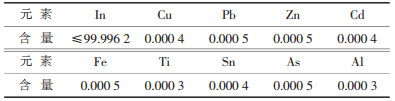
1 实验部分 1.1 实验原料、试剂及设备原料:99.99 %In (昆明理工大学真空研究所提供),分析纯;HCl(汕头市达濠精细化学品公司)。铟(99.99 %)的化学成分见表 1。
| 表 1 铟的化学成分 w/% |
 |
| 点击放大 |
实验设备:烧杯,量筒,冷凝管,温度计(0~ 150 ℃),调温电热套(规格250 mL,功率250 W,最高使用温度380 ℃),通风橱(昆明天悦实验设备有限公司)。
热分析仪器:差热/差重分析仪(DTA/TG,NET-ZSCH STA409PC/PG)。
1.2 实验方法金属铟较活泼,能和盐酸反应生成三氯化铟,常温下结晶可得到InC13·4H2O,反应式如下:
2In+6HCl+8H2O→2InC13·4H2O+3H2
将InC13·4H2O粉体在差热/差重(DTA/TG)同步分析仪上进行升温脱水测定,升温速率为5 K/min,温度量程:303~573 K。α-Al2O3为参比物,试验气氛为在氮气的条件下。
2 结果与讨论 2.1 InC13·4H2O失水过程分析图 1和图 2分别是在200 ℃、300 ℃下对InC13· 4H2O进行的差热/差重(DTA/TG)分析图。
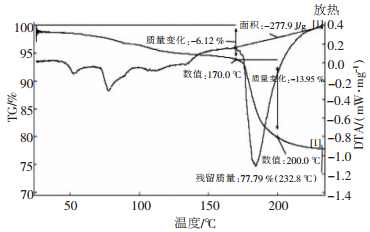 |
| 图 1 InC13·4H2O的差热/差重曲线图(200 ℃) |
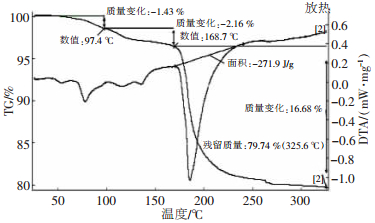 |
| 图 2 InC13·4H2O的差热/差重曲线图(300 ℃) |
从图 1可以看出,失重曲线上出现2个失重台阶。第一个台阶小,失重小,后一个台阶为明显的失重过程。第一个失重过程从303 K左右开始,至443 K,其失重率为6.12 %,失去一个液态水(理论值为6.13 %)。在脱一个液态水分子过程中紧接着又脱掉两个液态水。从图 1可以看出在473 K前,是一个完全的吸热峰,但吸热峰在对应的热重曲线上刚开始没有明显的失重现象出现,说明这个过程中可能包含第一个脱除水的汽化过程外,还包括剩余结晶水的脱除。第二失重峰(200 ℃时)失重率为20.17 %,失去2个液态水(理论值为18.41 %)即在473 K以前2个液态水已经脱除而且第三个结晶水已有部分被脱除。但可以从图中发现失重曲线趋于平缓,则说明最后一个结晶水的脱除需要更高的温度。
图 1和图 2虽有所差异,但大体上失重程度都显示为:在300 ℃以前都可以把四个结晶水中的三个结晶水脱除,但最后一个结晶水的脱除需要300 ℃以上。
从图 2中可以看见失重曲线上出现3个失重台阶。前两个台阶都非常平缓,失重也小,但最终失重为20.26 %(325 ℃时),图 1最终失重为22.21 %,和图 1对比最终失重接近。但是却发现失重量变小,可能是由于实验所用InC13·4H2O粉体的差异而产生的(实验时放在空气中的时间不同,则所含的水分就不同,因为InC13·4H2O粉体易吸潮)。
通过综合热分析仪对InC13·4H2O进行了热重和差热分析,得出其失水过程的初步结论,表明失水过程为:
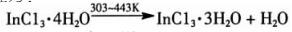
|
(1) |
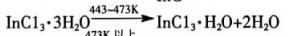
|
(2) |
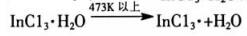
|
(3) |
在保护气体氮气的保护条件下,可以达到脱除水的目的,已有文献报道可以用有机溶剂法脱水以制备高纯无水三氯化铟。就保护气体的方法和有机溶剂法进行比较。
有机溶剂法:以InC13·4H2O为原料,正丁醇BuOH作为有机溶剂,采用有机溶剂替代InC13·4H2O中的结晶水,然后加热分解制备无水三氯化铟,通过升华分离纯化可得到高纯的无水三氯化铟。最佳工艺条件:在实验中控制蒸馏加热温度为180~200 ℃,分解加热温度为350 ℃左右,分解加热时间为1 h,投料比(BuOH/H20)为45,可得到无水三氯化铟,产率达95 %,无水三氯化铟经升华纯化可得到纯度为99.99 %的高纯无水三氯化铟。
保护气体的方法:以InC13·4H2O为原料,氮气作为保护气体,在300 ℃时已基本脱掉结晶水。
保护气体的方法相对于有机溶剂法来说,杂质含量少(减少了正丁醇带来的有机物杂质)。
3 结论通过差热曲线和热重曲线的分析得出以下结论:在有氮气作保护气体的条件下,低温时(170 ℃以下) InC1·4H2O直接脱去一个水分子,当高于170 ℃时,开始脱剩余的三分子水,在200 ℃之前,只能脱掉晶体中的三个结晶水,最后一个结晶水的脱除则需更高的温度(300 ℃以上)。
| [1] |
Yutaka S. Highly-conducting indium-tin-oxide transparent films fabricated by spray CVD using ethanol solution of indium (Ⅲ) chloride and tin (Ⅱ) chloride[J].
Thin Solid Films, 2002, 409: 46–50. DOI: 10.1016/S0040-6090(02)00102-5. |
| [2] |
Biswanath D. Convenient and efficient stereoselective synthesis of (2Z)-2-(chloromethyl)alk-2-enoates using iron(Ⅲ) or indium(Ⅲ) chloride[J].
Tetrahedron Letters, 2004, 45: 2425–2426. DOI: 10.1016/j.tetlet.2004.01.101. |
| [3] |
舒万艮, 杨刚. 三甲基铟、三乙基铟制备的研究进展[J].
稀有金属, 1999, 23(3): 224.
|
| [4] |
Rathna Durga R S, Manian. Rapid synthesis of tetrahydroquinolines by indium trichloride catalyzed mono-and bis-intramolecular[J].
Tetrahedron Letters, 2006, 47: 7571–7574. DOI: 10.1016/j.tetlet.2006.08.088. |
| [5] |
Brindaban C R. Selective reductive cleavage of 2, 3-epoxybromides by the InCl3-NaBH4 reagent system[J].
Tetrahedron Letters, 2004, 45: 8579–8581. DOI: 10.1016/j.tetlet.2004.09.120. |
| [6] |
Brindaban C R. Spectroscopic characterisation of indium(Ⅲ)chloride andmixed ligand complexes[J].
Spectrochimica Acta Part A, 2002, 58: 953–957. DOI: 10.1016/S1386-1425(01)00568-6. |
| [7] |
费多洛夫, 阿克楚林. 铟化学手册[M]. 张启运, 徐克敏, 译, 北京: 北京大学出版社, 2005: 77.
|
| [8] |
Bereslavestera L F, Shereshikova V I. Preparation of indium chloride[J].
Trswverokavkaz Gornornet Inst, 1970, 28(1): 55. |
| [9] |
刘德信.
近代无机化合物合成[M]. 南京: 南京大学出版社, 1990: 177.
|
| [10] |
周智华, 莫红兵, 曾冬铭. 高纯无水三氯化铟的制备[J].
稀有金属, 2003, 27(4): 470–473.
|
| [11] |
 2009, Vol. 23
2009, Vol. 23
