| 谷壳对水中铜离子的吸附热力学及动力学研究 |
2. 中南大学 冶金科学与工程学院, 湖南 长沙 410083
2. School of Metallurgy Science and Technology, Central South University, Changsha 410083, Hunan, China
多年来, 由于水中的重金属对水生生物、人类和环境的毒害而成为当前迫切要解决的重要课题。存在于工业废水或者饮用水中的重金属并不像有机污染物一样具有生物降解性, 由于吸附作用而在有机体中积累, 使之对公共健康构成威胁[1-2]。其中铜的毒性可导致皮肤痒或皮炎、手上皮肤和脚底角质化。因此, 这些重金属的浓度必须降低到不同水体所要求的安全环境规定水平[3]。
目前有多种技术方法可用于去除水溶液中的重金属。这些方法包括化学沉淀法[4], 传统的絮凝法[5], 反渗透法[6], 离子交换法[6]和生物吸附法[7-9]。其中吸附法由于简单、经济有效而被广泛采用[10-11]。然而, 商业上应用活性炭是非常昂贵的。目前已有大量关于具有一定潜力的、较少预处理、来源广泛或者是其他工业的副产物或废弃物作为低廉重金属吸附剂的报道[12]。
本文以谷壳作为吸附剂吸附铜离子, 对溶液pH值、反应时间、金属离子的初始浓度以及反应温度等影响因素进行了研究, 并在此基础上研究了其吸附热力学和动力学, 为工业应用提供一定的理论依据。
1 材料和方法 1.1 材料用蒸馏水溶解一定量的硫酸铜(分析纯), 配制成浓度为500 mg/L的Cu2+储备液。
试验用谷壳来源于某大米加工厂, 在阳光下暴晒3~5 d, 充分干燥后, 过筛得平均粒径0.331 mm, 备用。未经预处理而直接作为吸附剂吸附溶液中铜离子。
1.2 实验方法含Cu2+一定浓度的初始溶液中, 在不同参数条件下分别加入不等量的谷壳于锥形瓶中, 在恒温振荡箱中振荡一定时间后, 过滤分离取上清液, 测定其中残留铜离子的含量。
1.3 分析方法采用pH计测定溶液pH值, Cu2+采用原子吸收分光光度计进行测定。
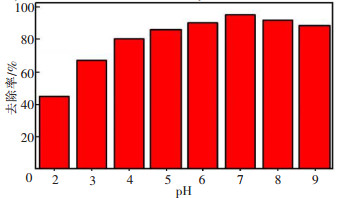
2 结果和讨论 2.1 溶液pH值对吸附效果的影响25 ℃条件下, 将100 mg/L含铜废水150 mL用10 %HCl及NaOH调节不同pH, 0.6 g谷壳加入废水中, 振荡速度180 r/min, 反应30 min, 澄清, 测定含铜废水反应前后铜离子的变化。
从图 1可知, pH对谷壳吸附Cu2+有较大影响。在吸附剂用量适宜, 振动吸附时间足够的情况下, pH值较低时, 去除率较低, 随着pH升高, 去除率增大。当pH达到7时, 达到最大去除率。
 |
| 图 1 溶液pH值对吸附效果的影响 |
金属离子的吸附依赖于溶液pH, 因为pH能够影响与官能团有关的离子电荷性。在pH较低时, 谷壳对铜离子的吸附量下降, 这是因为在酸性增大时, 体系中大量的H3O+会与金属离子竞争吸附位点, 导致谷壳对铜离子的吸附能力下降; 当pH大于7时, 重金属离子水解生成相应的氢氧化物, 沉积在谷壳表面, 使吸附活性点受到影响。
2.2 吸附动力学研究吸附过程的动力学研究, 主要用来描述吸附剂吸附溶质的速率, 吸附速率控制了在固-液界面上吸附质的滞留时间。
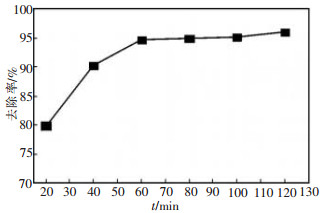
25 ℃条件下, 将100 mg/L含铜废水150 mL用10 %HCl及NaOH调节pH值至7, 0.6 g谷壳加入废水中, 振荡速度180 r/min, 不同反应时间后分别测定含铜废水反应前后铜离子的变化。
从图 2可知, 在初始的30 min谷壳有大量的活性位点可与Cu2+反应, 因而前30 min吸附反应的速度很快, Cu2+的去除率急剧上升, 吸附效果非常突出。此后可用于吸附Cu2+的活性位点相对减少, 对铜的吸附速率变慢, 因而Cu2+的去除率上升减缓。随吸附时间的延长, 谷壳与溶液中的Cu2+充分反应, 去除率逐渐升高, 至120 min时, 反应完全, 则去除率达到最大, 可以达到96.02 %。
 |
| 图 2 反应时间对吸附效果的影响 |
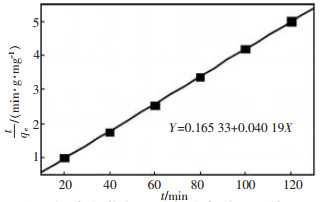
常用准二级速率方程描述吸附过程的反应动力学, 结果如图 3所示。
 |
| 图 3 准二级动力学方程拟合谷壳对Cu2+的吸附过程 |
根据t/q~t图可估算出qe的理论值, 为24.88 mg/g, 与实验qe值23.68 mg/g较接近, 相关系数R2为0.999 68, 表明准二级动力学模型可以很好的描述谷壳对溶液中铜离子的吸附动力学行为。
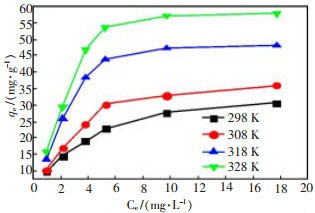
2.3 吸附热力学研究分别在25、35、45、55 ℃ 4种温度下, 将浓度分别为40、60、80、100、150、200 mg/L的含铜废水150 mL用10 %HCl及NaOH调节pH值至7, 0.6 g谷壳加入废水中, 振荡速度180 r/min, 反应30 min后, 澄清, 测定不同温度下谷壳对铜离子的吸附容量。结果如图 4所示。
 |
| 图 4 不同温度下谷壳对Cu2+吸附等温线 |
由图 4可知, 随着铜离子初始浓度的增加, 谷壳对铜离子的吸附容量也随之增加, 而后达到一最大值。随着初始浓度C0的增加, 谷壳投加量不变的情况下, 吸附位点数量有限, 当初始铜离子浓度较低时, 可以提供充足的活性位点用于吸附反应, 因而谷壳吸附容量增大。当初始铜离子浓度较高时, 活性位点则相对不足, 导致吸附位点达到饱和, 因而谷壳对铜离子的吸附容量几乎趋于一不变值。
采用Langmuir及Freundlich等温式对实验数据进行拟合, 结果如图 5, 6。
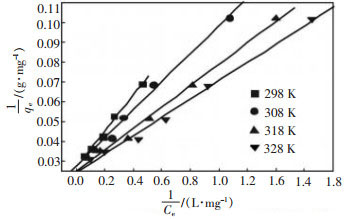 |
| 图 5 谷壳对Cu2+的Langmuir吸附等温线 |
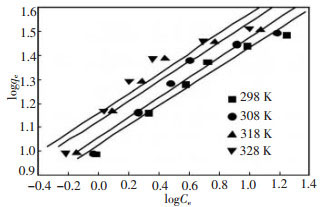 |
| 图 6 谷壳对Cu2+的Freundlich吸附等温线 |
对于图 5中的每条等温线, 其qm和KL的数值通过线性回归实验数据得到。依照图 6, KF和n的数值可用类似方法得到。表 1显示不同温度下, 谷壳对Cu2+的吸附行为与Langmuir和Freundlich两种吸附等温线均有较好的相关性。
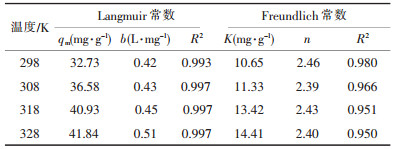
| 表 1 不同温度下Cu2+在谷壳上的等温吸附常数 |
 |
| 点击放大 |
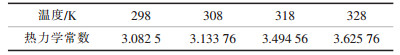
从表 1可知, 随着反应温度的不断升高, 谷壳对Cu2+的最大吸附量qe也逐渐增大, 从298 K时的32.73 mg/g增加到328 K的41.84 mg/g。针对不同温度下的吸附平衡, K0可以通过ln(qe/ce)对qe作图(图 7), 并且外推至qe=0时的值。从而得到不同温度下的热力学常数K0(如表 2所示)。
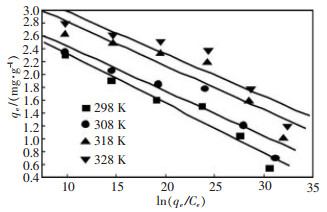 |
| 图 7 不同温度下谷壳对Cu2+的qe-ln(qe/Ce)图 |
| 表 2 不同温度下Cu2+在谷壳上的热力学常数 |
 |
| 点击放大 |
图 7为不同温度下吸附反应的吉布斯自由能△G0的变化, 采用下式计算:
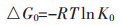
|
(1) |
式中:R表示通用气体常数, R=8.314 J/mol·K; T表示温度, K。
根据Van’Hoff方程:
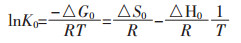
|
(2) |
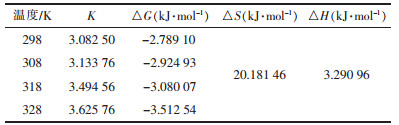
通过lnK对1/T作图, 得到图 8, 根据斜率和截距分别计算出吸附反应的焓变△H和熵变△S, 结果如表 3。
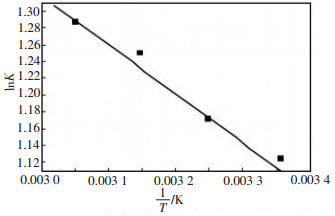 |
| 图 8 Van’Hoff方程拟合谷壳对Cu2+的吸附过程 |
| 表 3 不同温度下谷壳吸附Cu2+的热力学参数 |
 |
| 点击放大 |
得到正的标准焓变△H, 表明谷壳对Cu2+吸附是吸热反应, 这也证实了Cu2+的吸附随着温度的增加而增加。温度的升高有利于吸附的进行, 4种温度下的吉布斯自由能变化△G都小于零, 而且温度越高, △G越小, 揭示了谷壳对Cu2+的吸附过程是一个自发的, 且温度越高自发的程度越大。△S的正值说明吸附质的自由度也增加了。
3 结论谷壳对Cu2+的吸附反应表明, 谷壳对Cu2+的吸附效果比较好, 能够有效去除废水中Cu2+, 并得出以下结论:
(1) 当温度298 K, pH=7时, 谷壳投加量4 g/L, 振荡速度180 r/min, 反应30 min, 谷壳对Cu2+的吸附效果最好。
(2) 采用Langmuir和Freundlich吸附等温模型对不同温度下谷壳吸附剂对Cu2+的吸附进行了拟合。结果表明, 吸附过程符合Langmuir吸附等温模式。
(3) 随着反应温度的增加, 谷壳对铜离子的吸附加快。吸附热力学研究表明, 正的标准焓变化揭示谷壳对Cu2+的吸附是吸热反应, 负的标准自由能变化揭示吸附反应是自发的。
(4) 谷壳对Cu2+的吸附动力学模型能够较好地符合准二级动力学方程。
| [1] |
邹家庆.
工业废水处理技术[M]. 北京: 化学工业出版社, 2003: 7-8.
|
| [2] |
[苏]格鲁什科. 工业污水中有毒金属及无机化合物[M]. 钟祥浩, 译. 北京: 科学出版社, 1979.
|
| [3] |
张剑波, 王维敬, 祝乐. 离子交换树脂对有机废水中铜离子的吸附[J].
水处理技术, 2001, 27(1): 29–32.
|
| [4] |
张景来, 王剑波, 常冠钦, 等.
冶金工业污水处理技术及工程实例[M]. 北京: 化学工业出版社, 2003: 22-260.
|
| [5] |
汪恂. 城市污水一级强化处理新工艺—生物絮凝法[J].
国外建材科技, 2001, 22(3): 9–12.
|
| [6] |
Vethkar A V, Palnikar K M. Recovery of Gold form Solutiongs Using Cladasporium Biomass Beads[J].
Journal of Bioteehnoloy, 1998(63): 121–136. |
| [7] |
张洪玲, 吴海锁, 王连军. 生物吸附重金属的研究进展[J].
污染防治技术, 2003, 16(4): 53–56.
|
| [8] |
Matis K A, Zouboulis A I.Grigoriadou A A, et al. Metal biosorption—floation, application to cadmium removal[J].
Appl Microbiol Biotech-nol, 1996, 45: 569–573. |
| [9] |
叶锦韶, 尹华, 彭辉. 重金属的生物吸附研究进展[J].
城市环境与城市生态, 2001, 4(3): 30–32.
|
| [10] |
甘一如. 重金属的生物吸附[J].
化学工业与工程, 1999, 16(1): 19–25.
|
| [11] |
陈勇升, 孙启俊, 陈钧. 重金属的生物吸附技术研究[J].
环境科学进展, 1997, 5(6): 34–43.
|
| [12] |
Lawrence R Drake, Gray D Rayson. Plant-Derived.Materials for Ma-tel Ion-Seletive Binding and Preconcentration[J].
Anal Chem, 1996, 68: 22–27. DOI: 10.1021/ac9618029. |
 2008, Vol. 22
2008, Vol. 22
