| 硫酸体系中镍锌分离的实验研究 |
从硫酸体系中分离镍和锌常见的方法有:中和法,浓硫酸浓缩结晶法,电积法,溶剂萃取与离子交换法,以及氢还原法[1]。中和法、浓硫酸浓缩结晶法都不足以有效地分离镍锌;电积法只适合于从硫酸锌溶液中除去微量镍;溶剂萃取与离子交换法在工业上常用来净化镍电解阳极液中的锌,但这两种方法也只适合于分离硫酸镍溶液中微量的锌。从含有大量锌的硫酸溶液中分离锌,用溶剂萃取与离子交换在经济上是不合算的。首先是离子交换法容量很小,用于分离镍锌的萃取剂P204的萃取容量很小。因为,用萃取及离子交换分离镍和锌,生产效率低。镍的氢还原法需要较高的pH值来提高镍的析出电压,这将引起金属离子水解而生成Ni(OH)2沉淀,不利于氢还原,此时需要加络合剂如NH3,使之与金属离子形成在高pH值下比较稳定的络合物[2],这在硫酸体系中是不合算的。
碱浸法对分离含量都很高的金属离子Ni2+、Zn2+,具有独特的优越性。这表现在成本低,生产效率高,而且简便实用。本文探讨了用NaOH溶液分离镍锌的可行性及其优缺点。
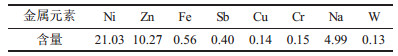
1 实验分析与方法 1.1 实验原料实验所用原料取自中南大学南校区冶金增值中心,该原料为高镍杂铜电解提铜后的废料,其主要金属元素成分分析结果如表 1。
| 表 1 实验原料的化学成分 w/% |
 |
| 点击放大 |
从原料成分分析可以看出, 原料中镍锌含量相对较高, 铁元素的含量也不少,是影响镍锌分离的主要杂质元素。
1.2 中和水解除铁根据镍、锌、铁沉淀pH值的差异,采用中和水解法除铁。铁以Fe2+和Fe3+形式存在于溶液中,为尽量除去铁,需要将Fe2+氧化为Fe3+,常用的氧化剂有MnO2和双氧水,在实验室条件下为不带入金属杂质元素而采用双氧水作为氧化剂。中和沉淀铁时pH值控制在4~5为宜,搅拌后放置2 h,使其充分反应。加热有利于沉淀反应的进行,在80℃下沉铁效果最佳[3]。
溶液中Fe2+和Fe3+是否除尽可由以下两个反应来鉴定:
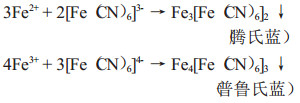
|
用碳酸钠使Ni2+和Zn2+以NiCO3和ZnCO3的形态沉淀,以减少体系体积。需加碳酸钠,实际用量为理论用量的1.2倍。实验条件下若滤液无蓝色,则证明镍已完全沉淀。
沉淀反应为:
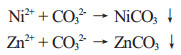
|
碱浸分离镍锌是根据镍和锌所形成的氢氧化物,Ni(OH)2和Zn(OH)2在化学性质上的不同而进行的。Ni(OH)2不溶于水及强碱,且在空气中不易氧化;Zn(OH)2为两性氢氧化物,在有过量碱存在下会生成锌酸盐。
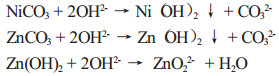
|
实验时用不同浓度的氢氧化钠溶液,在不同条件下浸洗除SO42-后的碳酸镍和碳酸锌的混合物,使镍锌分离,过滤得到产物氢氧化亚镍和锌酸钠溶液。
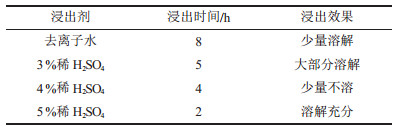
2 结果与讨论 2.1 原料的浸出原料采用去离子水溶和不同浓度的稀酸浸出,其溶解效果对比如表 2所示。
| 表 2 原料在不同条件下的浸出效果s |
 |
| 点击放大 |
从表 2可知采用 5% 的稀硫酸浸出原料效果显著,虽然这会得到高pH值(约为1~2)的溶液,在下一步中和沉铁时会消耗大量的碱,但从经济价值角度来看,使高价值的镍完全溶出是十分必要的。
2.2 除铁技术条件经浓度为5 %的稀H2SO4浸出得到的滤液中镍、锌、铁的浓度分别为5.97×10-1 mol/L、2.62×10-1 mol/L和1.68×10-2 mol/L。
溶液中加入OH-时可能发生的反应有:
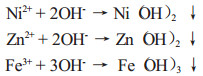
|
氢氧化亚镍、氢氧化锌和氢氧化铁的溶度积常数分别为:
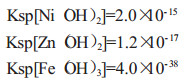
|
根据溶度积计算:欲使Ni2+沉淀的最低OH-浓度为5.7×10-8 mol/L,此时溶液的pH值为6.8;欲使Zn2+沉淀的最低OH-浓度为6.0×10-9 mol/L,此时溶液的pH值为5.8;欲使Fe3+沉淀的最低OH-浓度为1.3×10-12 mol/L,此时溶液的pH值为2.1。由此可见,当溶液中加入OH-时,Fe3+首先沉淀。
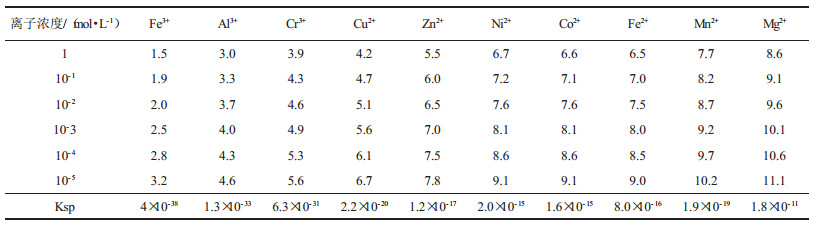
当Fe3+浓度为1×10-5时,可以认为已经沉淀完全,此时溶液中的OH-浓度为1.6×10-11 mol/L,其pH值为3.2,该氢氧根离子浓度尚未能使Ni(OH)2和Zn(OH)2沉淀生成。因此只要控制在3.2<pH<5.8就能使铁除去,但工业生产经验表明,除铁最终pH值控制在4~4.5为宜,反应时间通常取1.5~2 h,溶液含铁可降低至0.001 g/L[3]。表 3列出了一些难溶金属氢氧化物在不同浓度下沉淀的pH值[4]。
| 表 3 一些难溶金属氢氧化物在不同浓度下沉淀的pH值 |
 |
| 点击放大 |
根据表 3数据,以金属离子浓度(即氢氧化物溶解度)为纵坐标、pH值为横坐标,可绘制出上述金属氢氧化物的溶解度S与pH值的关系图,见图 1。
 |
| 图 1 一些难溶金属氢氧化物在不同浓度下沉淀的S-pH值 |
表 3和图 1提供了对金属离子进行沉淀分离的pH关系的选择。从图上可以看出,由于Fe(OH)2和Ni(OH)2完全沉淀的pH值很接近,难以达到分离的目的。而Fe(OH)3与Ni(OH)2的pH值相差很远,故欲使Fe2+与Ni2+分离,首先要把Fe2+氧化成Fe3+,然后再调节pH值。
2.3 镍锌分离(1)碱浸物料预处理。用碳酸钠沉淀镍锌所得的混合物含有大量的SO42-,虽然SO42-对下一步的反应无影响,但产物对S含量有严格的要求,因而碱浸前首先得除硫。将用碳酸钠溶液沉淀所得的碳酸镍与碳酸锌混合物,用去离子水按液固比为10:1洗涤三遍,尽量除去SO42-,然后碱浸。
(2)碱浸。碱浸时发生的有关反应:
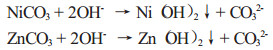
|
生成的Ni(OH)2不溶于水和强碱,Zn(OH)2为两性氢氧化物,在过量的NaOH存在下,Zn(OH)2与其反应生产Na2ZnO2。反应为:
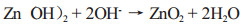
|
以上反应即可实现镍与锌的分离,分别得到氢氧化亚镍和锌酸钠溶液。
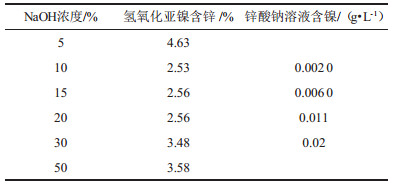
将预处理后的混合物分别用浓度为5 %、10 %、15 %、20 %、30 %和50 %的氢氧化钠溶液在固液比为3:1的条件下浸出15 h,过滤液后分别得到氢氧化亚镍和锌酸钠溶液,取样进行分析,其分析结果如表 4。
| 表 4 镍锌在不同NaOH浓度下浸出结果 |
 |
| 点击放大 |
从表 4可以看出:在实验所用氢氧化钠浓度下,产物氢氧化亚镍含锌量均远远高于要求的含锌量(氢氧化亚镍合格产品含锌量<0.02%)。碱浓度的变化对氢氧化亚镍含锌量影响不同,在NaOH浓度为10 %时,氢氧化镍含锌量较少,大于或小于此浓度其含锌量均增大;锌酸钠溶液中镍含量极低,且含镍量随着碱浓度的增大而增加。该实验表明增大碱浓度对镍锌分离是无益的。
取预处理后的混合物料用浓度为10 %的氢氧化钠溶液在温度分别为40 ℃、60 ℃和80 ℃的条件下碱浸。加热搅拌2.5 h(温度波动控制在±5 ℃),其氢氧化亚镍产物含锌量见表 5。
| 表 5 不同温度碱浸下产物氢氧化亚镍含锌量 |
 |
| 点击放大 |
从表 5数据可知:改变浸出温度对氢氧化亚镍中含锌量影响较小,说明通过改变浸出温度来降低氢氧化亚镍中的锌含量很不理想。一般来说,升高温度对浸出是有利的,而在本实验中却不明显,其原因可能是浸出时间不够长。
通过文献提供的Zn- CO2- H2O系lg([Zn2+]T)-pH图,在pH值=13~14及较高温度时,ZnO22-溶解度很大,而这时Ni(OH)2是稳定的。试验结果表明,用浓度为10 %的NaOH溶液分离镍锌,锌酸钠溶液含镍为2 mg/L左右,可见Ni(OH)2在碱浸时相当稳定,镍锌容易分离。
3 结论用碱浸法从硫酸体系中分离镍锌,关键的步骤是中和除铁以及碱浸分离镍锌。研究结果表明,控制pH值从该体系中沉淀除铁是非常彻底的,铁可以降低至0.001 g/L。用浓度为10 %的NaOH溶液分离镍锌,锌酸钠溶液含镍为2 mg/L。不足之处是氢氧化亚镍中含锌量太高,为氢氧化亚镍的粗产品,还需近一步提纯。
| [1] |
梅光贵, 钟竹前.
湿法冶金新工艺[M]. 长沙: 中南工业大学出版社, 1994: 45-46.
|
| [2] |
赵天从.
重金属冶金学[M]. 北京: 冶金工业出版社, 1981: 231-234.
|
| [3] |
张健.
重有色金属冶炼设计手册:铜镍卷[M]. 北京: 冶金工业出版社, 1996: 335-360.
|
| [4] |
曹素忱.
无机化学[M]. 北京: 高等教育出版社, 1993: 156-185.
|
 2007, Vol. 21
2007, Vol. 21
