| 原子吸收光谱法测定高纯稀土中的微量铜 |
近年来, 应用原子吸收分光光度计(AAS)代替分光光度计, 进行单波长光度分析的报道已日益增多, 见文献〔1~3〕, 它扩展了应用范围, 并具有一定的经济效益。笔者在用钨丝灯作AAS光源进行分子吸收测定的基础上〔4〕, 探讨应用双峰双波长分光光度法研究新显色剂胡椒基荧光酮(PIF)〔5〕与铜的显色反应的可行性, 方法用于高纯稀土氧化物中微量铜的测定, 结果符合要求。
1 试验部分 1.1 主要试剂与仪器试验采用主要试剂与仪器如下。
(1) 铜标准溶液:1.000mg · mL-1贮备液及1.0μg ·mL-1工作液。
(2) PIF(自制)乙醇溶液:1.0 ×10-4mol · L-1。
(3) CTMAB水溶液:2 ×10-2mol · L-1。
(4) 六次甲基四胺-HCl缓冲溶液:pH6.2。
(5) KSCN溶液:200g · L-1。
(6) 负载DDTC聚氨酯泡沫塑料:将聚氨酯泡沫塑料剪成0.5cm ×0.5cm ×10cm条状, 用水洗净后再用HCl(1 +9)煮沸5min, 取出泡塑条用蒸馏水洗净挤干, 放入100g· L-1DDTC(二乙基二硫代氨基甲酸盐)氯仿溶液中浸泡24h, 取出晾干后放入75mm长颈漏斗中作吸附柱用。
(7) 稍加改装的AAS仪〔4〕。
(8) PXJ -2型离子计。
1.2 试验方法于25mL量瓶中加入一定量的铜溶液、PIF溶液1.5mL、CTMAB溶液5.0mL、缓冲液5.0mL, 稀至刻度, 摇匀。用1cm比色皿在AAS仪上, 以585nm为测量波长、525nm为参比波长, 在585nm处以试剂空白为参比, 测得A585+; 在525nm处以配合物溶液为参比, 测得A525-, 求得ΔA=A585++A525-。
2 结果与讨论 2.1 吸收光谱按试验方法在AAS仪上分别以水和试剂作参比, 绘制试剂和配合物的吸收曲线, 见图 1。由图 1可知, 试剂最大吸收峰位于525nm, 配合物除在585nm处有一吸收峰外, 在525nm处还有一负吸收峰。改变Cu2+的含量, 正负峰吸光度与Cu2+含量呈良好的相关关系, 试验选用525nm为参比波长, 585nm为测定波长。
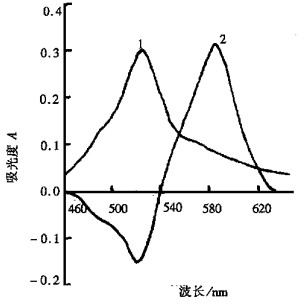 |
| 1.试剂对水1.5mL PIF/25mL; 2.配合物对试剂5μg Cu2+/25mL 图 1 吸收光谱 |
2.2 酸度及介质的影响
试验表明, 该体系酸度为pH5.8~ 6.6时吸光度稳定。试验了HAc-NaAc、KH2PO4 -NaOH、六次甲基四胺-HCl、HAc-NH4Ac等缓冲介质的影响, 其中以六次甲基四胺-HCl介质最好, 色差大且缓冲液用量在2.0 ~ 10.0mL吸光度为平台。试验选用pH6.2的六次甲基四胺-HCl 5.0mL控制酸度。
2.3 PIF及CTMAB的用量试验表明, PIF用量在1.0~ 2.5mL间, CTMAB用量在3.0 ~ 9.0mL间吸光度最大, 试验选用PIF1.5mL, CTMAB5.0mL。
2.4 配合物稳定时间和符合比耳定律范围室温下铜和显色剂、表面活性剂瞬时即可定量反应, 吸光度至少12h内恒定不变。在25mL溶液中, 铜在0 ~ 5.0μg符合比耳定律, 回归方程为ΔA= 9.72×10-2C +7.6×10-3, 相关系数γ=0.9977, 由直线斜率求得ε585, 525 =1.56 ×105 L· mol-1 · cm-1。
2.5 配合物的组成在CTMAB大量存在下, 用等摩尔连续变化法、斜率比法测定配合物组成, 结果表明, Cu2+与PIF形成1:2的配合物。
2.6 共存离子的影响按试验方法, 测定误差在±5%时, 测定4.0μg· (25mL)-1Cu2+, 下列共存离子的允许量(以μg计)为:K+、Na+、F-(3 ×104), Cl-、NO3-、PO43- (2×104), Ca2+、Cd2+、Cr3+、Mg2+、Sr2+、La3+、Y3+、Sm3+、Eu3+、Gd3+(500), Mn2+(200), Pb2+(100), Ag+ (50), Co2+、Ni2+、Hg2+、Pd2+、In3+、Zn2+(25), Al3+、Be2+、Mo(Vl)、V(V)、W(Vl)、Zr(lV)(10)。
2.7 样品分析 2.7.1 试样处理称取高纯稀土氧化物样品0.5000g于25mL烧杯中, 用蒸馏水湿润后, 加入6mol · L-1HCl 10mL溶解, 加热蒸至近干, 用蒸馏水溶解后转移至50mL量瓶中, 加入KSCN溶液10mL, pH5.5的HAc -NaAc缓冲液10mL, 稀至刻度, 摇匀, 转入已装好泡塑条的色层吸附柱中, 以每滴2s的流速流出。溶液流尽后, 用10mL蒸馏水淋洗, 取出泡塑条用定量滤纸包好并放入瓷坩埚中炭化, 烟冒尽后放入600℃马弗炉内灼烧1h, 取出冷却, 用适量0.3mol· L-1 HNO3溶解并定容至50mL备用。
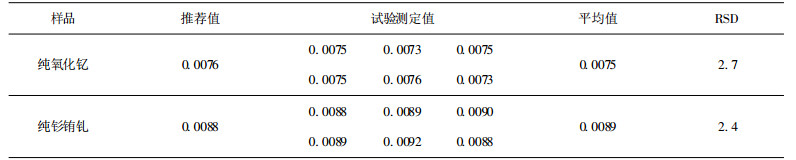
2.7.2 分析结果根据样中铜含量取适量试液于25mL量瓶中, 按试验方法显色并测定吸光度, 分析结果见表 1, 结果表明, 该法测定值与推荐值吻合。
| 表 1 样品分析结果 % |
 |
| 点击放大 |
| [1] |
周原, 龙有前, 刘新玲, 等. 原子吸收分光光度计用于分子吸收分析测定磷[J].
分析测试学报, 1997, 16(3): 66–68.
|
| [2] |
赵珍义, 陈华. 原子吸收分光光度计新应用的探讨[J].
光谱学与光谱分析, 1998, 18(1): 124–127.
|
| [3] |
郑新灵, 闫永胜, 周丰群, 等. 原子吸收分光光度法测定铁矿石中的铁[J].
分析试验室, 1999, 18(3): 96–97.
|
| [4] |
衷明华. 原子吸收分光光度计上采用连续光源用于光度分析的研究[J].
分析试验室, 1999, 18(4): 91–94.
|
| [5] |
王敦清. 新型三羟基荧光酮类试剂的合成与分析应用〔D〕. 南昌: 江西师范大学, 1991.
|
 2000, Vol. 14
2000, Vol. 14
