| 含铋氯化溶液中空气氧化除铁的研究 |
近十几年来, 人们对湿法冶金过程的研究日益活跃, 被认为是从复杂硫化矿或低品位硫化矿中提取金属的主要途径。由于硫化物在氯化溶液中的浸出通常要比在硫酸盐溶液中更容易, 从而得到更高的浸出率, 使得氯化浸出工艺在现代湿法冶金生产中占有重要的地位。难冶铋中矿的氯化浸出试验结果证实了这一点。
然而, 贫矿中伴生杂质铁往往占有很大的比例, 所以尽管采用选择性浸出, 但在有价金属溶解的同时, 还是有部分杂质铁进入溶液, 影响主体金属的提取。随着氯化冶金的日益发展, 对氯化物溶液体系的净化除铁开展研究已显得非常必要。
许多研究表明, 空气氧化针铁矿除铁法比起传统的氧化中和水解法具有明显的优势, 已成为酸性溶液除铁最成功的方法之一。但文献和资料报道的多见于硫酸体系, 而盐酸体系的报道则较少。本文以铋中矿的氯化浸出液为研究对象, 研究氯化溶液体系空气氧化除铁的规律, 并探索易水解的铋离子与铁共沉淀损失的防治方法。
1 试验原理所研究的高氯溶液中, Fe(Ⅱ)主要以FeCl2和FeCl+两种形态存在。它们被空气氧化为针铁矿的化学反应方程式分别为:
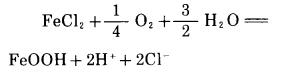
|
(1) |
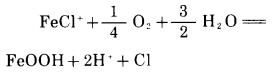
|
(2) |
由反应式可见:反应(1),(2)除了与Fe(Ⅱ)本身的浓度有关之外, 还与溶液中溶解的氧浓度、
Y·Awakura等人的研究表明,盐酸溶液中, 在有CuCl2作催化剂的条件下,Fe(Ⅱ)的氧化反应受化学反应步骤控制, 其活化能约为78.2kJ/mol。无疑, 提高反应温度, 是加速Fe(Ⅱ)氧化的一个重要途径。
在低[CI-]T下, Bi3+极易以BiOCl水解析出, 随着[CI-]T的升高, Bi3+在溶液中的存在形态发生了变化。当[Cl]T=4.0mol/L时, Bi3+主要以BiCl52-、BiCl63-形态存在, 这使铋离子的水解pH0大大升高, 而与铁水解的pH0相接近。铋、铁络离子水解的标准pH值如表 1所示。由于溶液含铋离子浓度极低, 这使铋离子的实际水解pH有可能大于铁离子的水解pH, 从而使之在铁氧化沉淀时, 仍然稳定存在于液相中, 保证了铁的优先水解。控制适当的中和剂添加量, 可以有效控制铋因共沉淀而造成的损失。
| 表 1 25℃时一些铋、铁离子水解平衡pH0值 |
 |
| 点击放大 |
本试验在保证足够的搅拌强度, 提供良好的传质条件下, 综合考察了氧化温度, 中和剂的加入量, 反应时间以及催化剂的作用等因素对沉铁率的影响, 从而获得有色金属氯盐浸出溶液空气氧化除铁的最佳工艺条件。
2 试验结果及分析铋中矿的盐酸浸出液, 经预中和还原、中和沉铋之后, pH为2.42, 成分为(g/L): Bi(Ⅲ)0.70, Fe(Ⅲ)0.95, Σ Fe12.77, Cu(Ⅱ)7.30。该溶液作为氧化除铁的试液, 在鼓风量及搅拌强度一定的条件下, 考察了氧化时间、温度、中和剂用量及Cu (Ⅱ)离子等变量对沉铁率的影响, 试验结果如图 1所示。
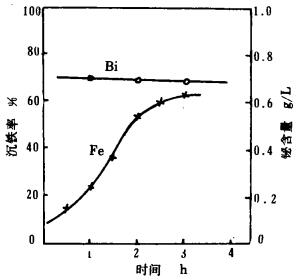 |
| 条件:搅拌强度1 200rpm, 温度65℃, 中和剂加入量5g/L溶液。 图 1 氧化时间与沉铁率及溶液铋含量的关系 |
2.1 氧化时间对沉铁率的影响
铁以针铁矿形式沉淀的一个重要条件是溶液中的Fe(Ⅱ)能否得到充分的氧化。由于空气在溶液中的停留时间非常有限, 为了强化溶液与空气接触的机会, 试验采用机械搅拌和空气搅拌相结合的方式, 用风管将空气送至搅拌桨下面, 搅拌桨采用自行设计的开启圆盘直叶涡轮搅拌器, 借此将空气剪切分散, 提高空气的利用系数。
图 1表示, 反应时间对沉铁率和溶液中铋含量的影响。由图可见, 随着氧化时间的延长, 铁的氧化程度增大, 沉铁率呈直线上升, 但到了一定时间后, 沉铁率变化缓慢。经研究认为, 在有Cu(Ⅱ)存在的情况下, O2对Fe(Ⅱ)的氧化实际上是以下列形式完成的:
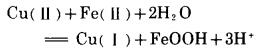
|
(3) |
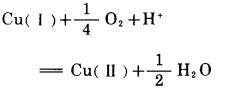
|
(4) |
由于中和剂不足, 反应产生的H+不能及时排除且Fe(Ⅱ)离子浓度相应减少, 因此造成反应(3)右行的趋势大大减弱。而氧化时间的延长对Bi(Ⅲ)共沉淀几乎不产生影响。
2.2 温度对沉铁率的影响图 2表示温度的改变对空气氧化除铁的影响。从图 2可知, 温度对沉铁率的影响是显著的, 升高温度能有效加速化学反应控制的过程。但是, 升高温度将导致O2在溶液中的溶解度降低, 不利于Fe(Ⅱ)的氧化。试验表明, 反应温度控制在70~75℃范围内, 除铁效果最佳, 所生成的铁渣晶粒粗大, 易于澄清过滤。试验还观察到Bi(Ⅲ)的共沉淀与反应温度无关。
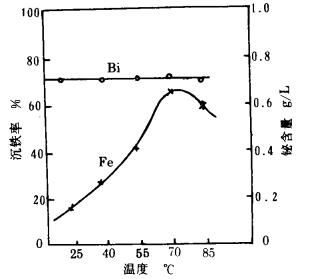 |
| 条件:搅拌强度1 200rpm,中和剂用量5g/L溶液, 氧化时间2h。 图 2 反应温度与沉铁率及溶液铋含量的关系 |
2.3 中和剂用量对沉铁率的影响
如前所述, 空气氧化除铁过程中, 反应体系的酸度将随之升高。选择适当的中和剂, 及时中和掉所生成的H+, 使体系始终保持在有利FeOOH形成的pH条件下, 这是直接影响除铁效果的重要因素。
有关资料报道, pH < 1.9时.溶液中的Fe(Ⅱ)几乎不被空气中的O2所氧化。溶液的酸度愈低, 即pH值愈大时, Fe(Ⅱ)的氧化速率便愈大。
图 3所示的试验结果证实了这一点。试验时, 溶液的pH是通过控制中和剂的加入量来调节的。中和剂的用量愈多, 铁的氧化沉出愈彻底。但中和剂用量的增加受到溶液性质的限制。该研究体系中尚有少量Bi (Ⅲ)离子, 在氧化沉铁时要尽可能防止Bi (Ⅲ)由于共沉淀而造成的损失。由图可见, 中和剂的用量对Bi(Ⅲ)的共沉淀影响较大。况且本研究的溶液经除铁后, 可直接进行再生处理返回浸出铋中矿, 因此并不要求把铁除得十分彻底。一般允许溶液中保留5 ~8g/L的铁, 所以沉铁终点pH以不超过3.0为宜。这就是说, 沉铁过程pH应严格控制在2.5~3.0之间, 相当于每升溶液中加中和剂6~7.5g。为了防止局部过碱而造成铋的共沉淀及胶状氢氧化铁的形成, 中和剂宜缓慢加入。
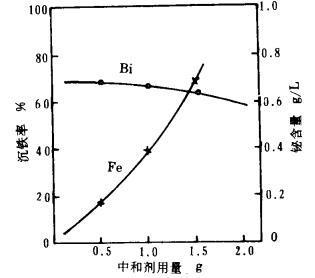 |
| 条件:搅拌强度1 200rpm, 温度70℃, 时间2h。 图 3 中和剂用量与沉铁率及溶液中铋含量的关系 |
2.4 Cu(Ⅱ)对铁的氧化率的影响
为了探索在氯化溶液中, Cu(Ⅱ)的存在与否对空气氧化除铁的影响, 本研究设计了一组对比试验, 对Fe(Ⅱ)在有无Cu(Ⅱ)存在时的氧化情况进行了比较, 试验结果如图 4所示。由图 4可以看出, Cu(Ⅱ)的存在加速了Fe(Ⅱ)的氧化。
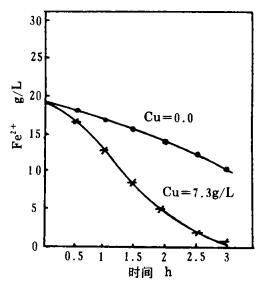 |
| 条件:Fe(Ⅱ)初始浓度18g/L, 温度70℃,pH=4。 图 4 Cu(Ⅱ)的存在对铁氧化速率的影响 |
Cu(Ⅱ)对Fe(Ⅱ)氧化的催化作用, 可以由它们的标准电极电位得到解释。在氯盐溶液中, Cu(Ⅱ)的还原反应为:
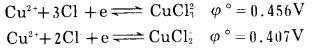
|
在相同条件下, Fe(Ⅲ)的还原反应为:
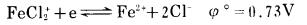
|
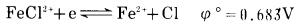
|
可见, Cu(Ⅰ)比Fe(Ⅱ)更容易被氧化,且研究发现其被氧化的动力学阻力远比Fe (Ⅱ)小。然而当pH>2.5时,情况恰恰相反。Cu(Ⅱ)/Cu(Ⅰ)电对的电位变得大于Fe(Ⅲ)/Fe(Ⅱ)电对的电位, 结果使反应:

|
(5) |
从左向右进行。可见, 在这里Cu(Ⅱ)实际上起了输送电子的作用, 把无铜存在时的液-气氧化反应转化为有铜存在时的液-液反应, 从而加速了Fe(Ⅱ)的氧化。本研究体系含有铜, 这为铁的氧化沉淀提供了极为有利的条件。另外, 从图 4还可以看出, 对于不含铋的氯盐溶液, 只要控制适当的条件, 可以将铁除至1g/L以下。
2.5 验证试验综上所述, 在含铋氯化溶液中,为使铁以结晶粗大, 易于过滤的FeOOH沉淀除去, 最佳工艺条件为:温度70~75℃, 中和剂用量6~7.5g/L溶液, 涡轮搅拌2h。
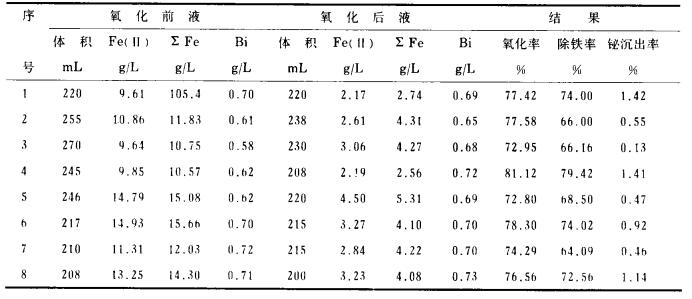
为了进一步验证条件试验所得结果的可靠性, 为扩大性试验及今后生产提供依据, 本研究进行了一组验证性试验, 试验结果列于表 2。由表列数据可知, 在试验条件下, Fe的氧化率可达75%以上, 控制70%左右的沉铁率, Bi的共沉淀损失率不超过溶液含铋量的1%。
| 表 2 验证性试验数据 |
 |
| 点击放大 |
3 结语
含铋氯化溶液采用空气氧化除铁, 工艺条件合理、可靠, 解决了铋湿法冶金中铁的积累问题。除铁后液可返回铋中矿浸出系统, 沉出的铁渣是制备铁红的上乘原料。该方法与硫酸体系相比, 具有氧化速度快, 反应温度低的优点, 不仅适用于铋的湿法冶金, 而且对其它有色金属的氯化冶金同样具有指导意义。
 1994, Vol. 8
1994, Vol. 8
