| E—pH图及其在钨湿法冶金中的应用 |
${affiVo.labelOrder}. 赣州钻冶炼厂
${affiVo.labelOrder}. ${affiVo.addressStrEn}
湿法冶金过程与物质在水溶液中的稳定性有密切关系,而稳定性与溶液中的电位、pH值、组分浓度、温度和压力等有关。现代湿法冶金理论研究中广泛使用一种图解法,即用E—pH图来分析过程的热力学条件。这种图形把抽象的热力学反应平衡关系用图解的方式表示出来,成为研究化学、冶金、地质学等的有力工具。
E—pH图就是把水溶液中的基本反应作为E—pH、a (活度)的函数,在指定溫度、压力下,将E—pH关系表示在平面图上(利用电子计算机处理还可绘制出立体或多维图形), 它可以指明反应自动进行的条件,指明物质在水溶液中稳定存在的区域和范围,为湿法冶金浸出、分离、电解等过程提供热力学依据。
E-pH图取电位为纵坐标,是因为电位(E)可以作为水溶液中还原一氧化反应趋势的景度。因为
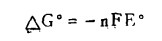
|
(1) |
式中n是电子得失数.
E—pH图取pH为横坐标,是因为水溶液中进行的反应,大多与水的自离解反应有关:
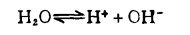
|
(2) |
即与氢离子浓度有关。许多化合物在水溶液中的稳定性随pH值变化而不同。
在水溶液中进行的与E、pH有关的反应,可以用一通式表示:
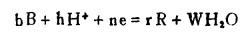
|
(3) |
式中,b、h、r、w表示反应式中各组分的化学计量系数;n是电子得失数。同时设定aB是氧化态活度,aR是还原态活度。
反应(3)的自由拾变化,在温度、压力不变时,根据等温方程式:
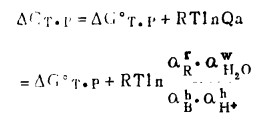
|
(4) |
因为aH2O=1,pH= -lgaH+,式(4)可以写成:
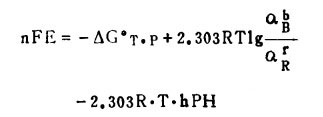
|
(5) |
式(5)是E—pH关系式的计算通式。如果已知平衡常数K, 式(5)可写成:
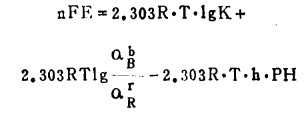
|
(6) |
若已知电极电位E°,式(5)可写成:
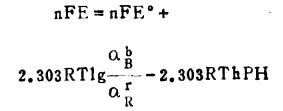
|
(7) |
上述各式中,R = 8.314J/mol·K, F = 96500, 25℃时,将R、F之值代入式(5)中得:
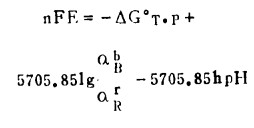
|
(8) |
在水溶液中进行的反应,根据有无电子和氢离子参加可以分为以下几种类型:
1.无电子得失,即n=0, 则式(5)为:
|
(9) |
2.无H+参加,即h = 0,则式(6)为:
|
(10) |
3.既有电子得失,又有H+参加的反应,则式(7)为:
|
(11) |
在绘制E—pH图时,习惯规定:电位使用还原电位,反应方程左边写氧化态,e、H+; 反应式右边写还原态。
二 热力学数据稳定区域的确定取决于有关的可以应用的平衡常数或可应用于估算这些常数的合理的方法。众所周知,有多种可溶性的钨酸盐存在,然而,它们的生成自由能或稳定常数的数据并不充分,溫度效应的数据也不完全。因此,本文所讨论的只限于25℃和稀溶液的情况,这些条件就工业实践来说是不现实的,它们只是表示稳定关系的趋势,这种趋势有助于强调贯穿于钨浸出过程始终的化学原理。表 1至表 4汇集了用于绘制稳定区域图的热力学数据。
| 表 1 25℃时,W-H2O体系的平衡常数 |
 |
| 点击放大 |
| 表 2 25℃时,Mn-W-H2O体系的平衡常数 |
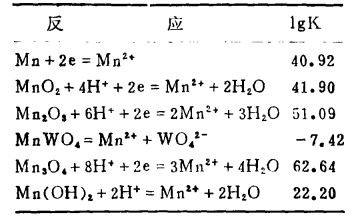 |
| 点击放大 |
| 表 3 25℃时,Fe-W-H2O体系的平衡常数 |
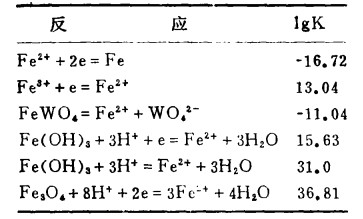 |
| 点击放大 |
| 表 4 25℃时,Ca-W-H2CO3体系的平衡常数 |
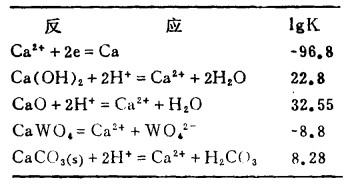 |
| 点击放大 |
三 E—pH图的分析
W-H2O系的E—pH图示于图 1。Ca、Mn和Fe对W-H2O系平衡的影响分别如图 2~ 4所示。
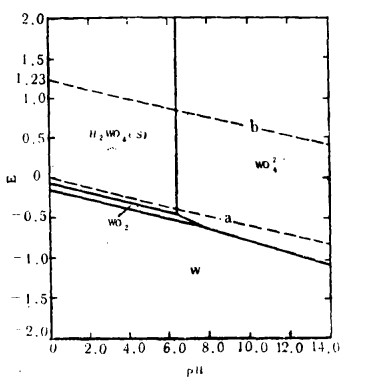 |
| 图 1 在25℃,钨的浮度〔W〕=10-3时,W-H2O系统的E—pH图 |
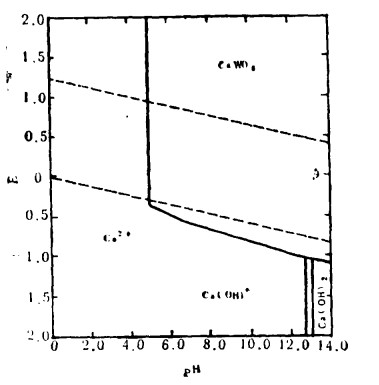 |
| 图 2 在25℃,〔W〕=〔Ca〕= 10-3时,Ca-W-H2O系统的E—pH图 |
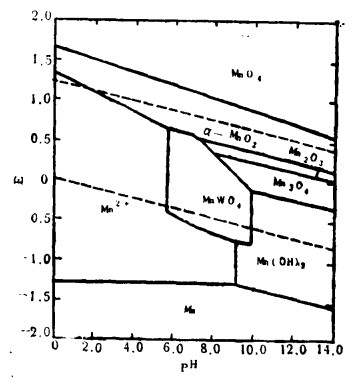 |
| 图 3 在25℃〔W〕=〔Mn〕= 10-3时,Mn-W-H2O系统的E—pH图 |
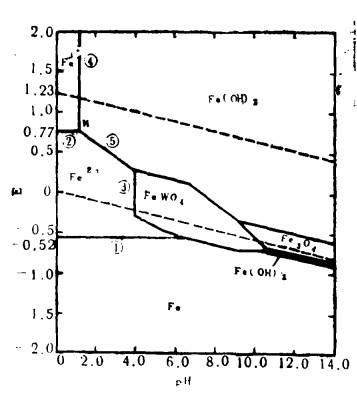 |
| 图 4 在25℃〔W〕=〔Fe〕= 10-3时,Fe-W-H2O系统的E—pH图 |
1.水的热力学
稳定区水稳定性与电位、pH值都有关。以W-H2O系E—pH图为例,a线以下,电位比氢的电位更负,发生H2析出,表明水在a线以下不稳定。a线以上,电位比氢的电位更正,发生氢的氧化,水是稳定的。同样,在b线以上析出O2, 表明水在b线以上不稳定,b线以下,氧还原为OH-, 水是稳定的。
由此可见,a、b线之间的面为水的热力学稳定区、湿法冶金只能在水的稳定区中进行。
2.点、线面的意义
点:一点应有三线相交(从图 1至图 5可见,有一些点,只有两线相交,这是因为所研究体系的数据不完全所致)。从数学观点讲,平面上两直线必交于一点,该点就是直线方程的公共解,由两个方程可导出第三个方程,其交点也是第三个方程的解。从图 4可见,N点是表 4中反应式②、④、⑤的相应直线方程的交点,该交点表示三个平衡反应式的电位、pH值都相同。
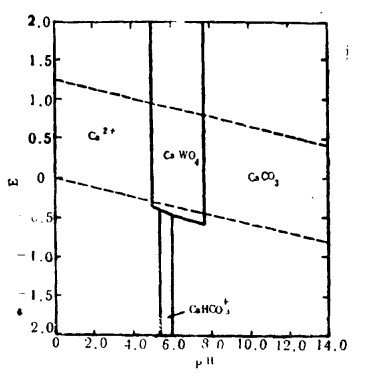 |
| 图 5 在25℃〔W〕=〔Ca〕= 10-3碳酸盐活度〔C〕=1.0时,Ca-W-CO3-2-H2O系统E—pH图 |
线:图中每一根直线代表一个平衡反应式,线的位置与组分浓度(或活度)有关,如图 4中线④:
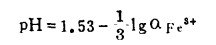
|
(12) |
当aFe3+减小时,线的位置向右平移。
面:表示某组分的稳定区。在稳定区内,可以自动进行氧化—还原反应。如图中a、b线之间可以进行下列反应:
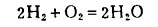
|
(13) |
而在图 4中I区内,有下列反应发生:
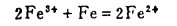
|
(14) |
(1) 从图 1可以看出,H2WO4比WO2更稳定。W、WO2和WO42-稳定区的位置与Pourbaix Carrels等人提出的E—pH图 1的位置一般是一致的。
(2) Ca、Mn和Fe对W-H2O系平衡的影响的E—pH图是用总溶出的W、Ca、Mn的活度分别为10-3时绘制的。在pH= 5~14范围内,Ca-W-H2O系(图 2)中有占统治地位的一大片CaWO4稳定区。另一方面,从图 3和图 4可以看出,Mn—W-H2O与Fe—W-H2O系中,FeWO4(约pH=4~10)、MnWO4(约pH = 5.5~10)的稳定区域较小。对于所有三个体系,钨酸盐在较低的pH区域内都能分解成钨酸,
图 1~4说明了工业上用酸、水和苛性碱浸出白钨矿和黑钨矿提取钨的热力学基础,因而用盐酸分解白钨矿的反应可表示如下:
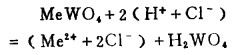
|
(15) |
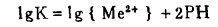
|
(16) |
式中,lgK= 7.0,8.4和4.8, 分别表示25℃时,Ca、Mu、Fe参加反应的平衡常数之对数值。
在苛性碱浸出的情况下,相应的反应为:
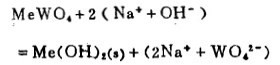
|
(17) |
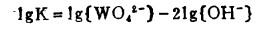
|
(18) |
式中,lgK = 3.6、5.23和4.06分别表示25℃时,Ca、Mn和Fe参加反应的平衡常数之对数值。在酸性体系中,Ca、Mn、Fe的钨酸盐分解成钨酸。然而,众所周知,白钨矿并不用苛性钠溶液处理。从图 2可以看出,在髙片pH区域存在较大的CaWO4稳定区,这就阻止了白钨矿在碱性介质中的浸出。
另一种是用苏达焙烧焙烧钨矿石从中提取钨的方法,在800~900℃时借助于Na2CO3和空气使钨酸盐分解:
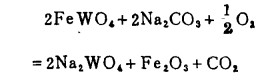
|
(19) |
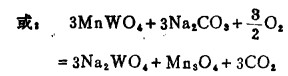
|
(20) |
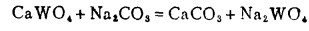
|
(21) |

|
(22) |
在80~90℃时用水浸出焙烧物料,从焙烧物料中提取钨包括水可溶钨酸钠的简单溶解。裉据图 2至图 4,如果在溶出过程中,要防止从氧化产物中生成MnWO4FeWO4, 那么就必须保持相应碱性的溶液(pH>10),在钨存在的情况下,正如图 5所示,CaCO3趋于比CaWO4更稳定。然而,Ca—W—H2O体系中(图 2), CaWO4的极大的稳定性意味着在焙烧过程中形成氧化钙(方程22),随后又能与已溶出的钨酸盐离子反应生成CaWO4从而降低钨的提取率。
三 结语本文引用的有关图,缺乏完整的热力学数据,有一定的局限性。尽管如此,由可用数据所导出的稳定性关系,和一些已报道过的钨浸出体系的研究结果相一致。已经看出用碱性体系浸出白钨矿提取钨是极端困难的,这是由于热力学条件不利的结果(即CaWO5稳定区从pH = 5-14),而不是动力学条件不利的结果。另一方面,在25℃时,稳定性图表明钙、锰、铁的钨醆盐都没有它们各自的碳酸盐稳定区,由此说明苏打压煮法中,升高温度主要是提高反应速率,而不是创造反应的热力学条件。
| [1] |
K. Osseo -Asare, Met. Trans. B, Vol. 13B, Dec 1982, P555~565
|
| [2] |
傅崇说.
有色冶金原理[M]. 冶金工业出版社, 1984.
|
| [3] |
蒋汉瀛.
湿法冶金过程物理化学[M]. 冶金工业出版社, 1984.
|
| [4] |
郑箱甚译: 《提取冶金速率过程》, 冶金工业出版社, 1985.
|
| [5] |
D. D. Macdonald etal, J. Metal, Vol 31, Dec 1979, P127
|
 1987, Vol. 1
1987, Vol. 1
