2. 甘肃省牛羊胚胎工程技术研究中心, 兰州 730070
2. Technology and Research Center of Gansu Province for Embryonic Engineering of Bovine and Sheep & Goat, Lanzhou 730070, China
牦牛是我国高原牧区主要家畜之一,大都繁衍生息在我国青藏高原及周围3 000 m以上的高寒地区,对其生态环境条件具有极强的适应性。皮肤是畜体最大的器官,作为直接接触外界环境的器官,具有分泌、体温调节、保护机体免受外界损伤等作用[1-3]。皮肤由表皮和真皮组成,借皮下组织与深部组织相连。表皮位于皮肤最表层,主要由大部分的角质形成细胞和少量的诸如黑素细胞、朗格汉斯细胞、梅克尔细胞等组成。真皮层内埋置着毛囊、汗腺、皮脂腺、血管、淋巴管、神经等[4]。崔燕等[5]已经对成年牦牛汗腺和皮脂腺的组织学进行了研究。而真皮层及皮下组织有丰富的神经末梢和血管网,血管的扩张和收缩有助于动物的体温调节,神经则调控着体温通路。低氧诱导因子-1α(hypoxia-inducible factor 1-alpha, HIF-1α)是低氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)特有的一种亚基结构,是一种调节亚基,同时也是一种活性亚基[6],其蛋白稳定性和转录活性均受细胞内氧浓度的调节。在低氧条件下,HIF-1α蛋白水平增加、入核、二聚化,结合于低氧反应基因的HIF-1α结合位点上,促进转录,介导低氧反应,并在多种组织细胞中广泛表达。HIF-1α介导缺氧信号与众多缺氧诱导基因(如血管内皮生长因子VEGF、转化生长因子TGF-β1等)转录激活,作为反式作用因子可与细胞核染色体上的顺式作用元件(缺氧反应元件)相互作用,进而调控下游基因的转录和翻译,对低氧或创伤环境中细胞和机体氧稳态的调节具有重要作用[7]。目前,有关HIF-1α在成年牦牛皮肤中的定位和表达研究尚未见报道。因此,本试验采用HE、Masson’s三色和Verhoeff VG染色法对成年牦牛皮肤内的血管和神经进行组织学观察,用免疫组织化学、qRT-PCR法、Western blot法对HIF-1α的mRNA和蛋白进行不同部位皮肤组织上的定位与定量分析,为哺乳动物皮肤的研究提供组织学的相关资料,也进一步探究了牦牛在高寒低氧环境下适应性生理条件。
1 材料与方法 1.1 试验样品与材料1.1.1 试验动物和取材 自青海省西宁市采集成年(3~5岁)健康牦牛皮肤样品,各10头份,雌雄各半,经颈动脉放血处死后立即采集颈部、前臂部、小腿部、跖部皮肤,将皮肤组织体积的1/2迅速放入液氮,用于提取组织中的RNA和蛋白质;剩余1/2置于4%多聚甲醛溶液,用于制备石蜡切片。
1.1.2 主要仪器和试剂 全自动排气组织脱水机(TP1020, Leica德国),全自动包埋仪(EG1160, Leica德国),精密轮转式切片机(RM2235, Leica德国),SP试剂盒(SP-0023, 北京博奥森生物技术有限公司),二氨基联苯胺(diamino-benzidine, DAB)显色试剂(ZLI-9019, 北京中杉金桥生物技术有限公司);PCR仪(eppendorf, 艾本德公司, 德国),荧光定量PCR仪(LightCyclerⓇ96SW1.1, Roche公司, 瑞士), Tranzol试剂、EasyPure Plasmid MiniPrep Kit均购自北京全式金生物技术有限公司,Taq PCR Master Mix、GoScriptTMReverse Transcription System、WizardⓇ SVdGel和PCR Clean-Up System均购自Promega公司(美国);鼠抗HIF-1α和β-actin单克隆抗体分别购自Abcam公司和全式金生物技术有限公司。
1.2 试验方法1.2.1 组织学观察 皮肤样品固定1个月后,分别选取4个不同部位牦牛皮肤各10个组织块(组织块大小为0.5 cm×0.5 cm×0.5 cm),流水冲洗24 h以冲洗多聚甲醛,放入软化液中48 h。按常规组织学方法制作石蜡切片(厚5 μm,横切)(横切是平行于皮肤的方向),分别进行苏木精-伊红(hematoxylin-eosin staining,HE)染色、Masson’s三色和Verhoeff VG染色。用Olympus-73光学显微系统观察,拍摄组织学图片。
1.2.2 免疫组织化学检测 制成5 μm(横切)的石蜡切片脱蜡至水,用0.01 mol·L-1的柠檬酸盐缓冲液进行抗原修复,染色方法参照SP试剂盒(SP-0023,Bioss)。一抗HIF-1α(Abcam)以1∶500稀释,4 ℃孵育过夜。空白对照用0.02 mol·L-1的PBS代替一抗,DAB显色剂按1∶20稀释后进行显色,最后进行苏木精复染细胞核、脱水、透明及封片。用Olympus-73光学显微镜观察、拍摄组织学图片。
1.2.3 qRT-PCR 用Primer Premier 5.0软件设计出HIF-1α引物序列,β-actin作为内参引物,由上海生工合成。引物序列为HIF-1α-R: 5′-TATCCAAATCACCAGCATCCAG-3′, HIF-1α-F: 5′-TAGAGATGCAGCCAGATCTCGT-3′;β-actin-F: 5′-CGTCCGTGACATCAAGGAGAAGC-3′, β-actin-R: 5′-GGAACCGCTCATTGCCGATGG-3′。采用Trizol法提取4个不同部位的皮肤组织的总RNA,按照GoScriptTMReverse Transcription System反转录试剂盒(Promega,美国)说明书合成cDNA。PCR总反应体系20 μL:SYBR Green Mix 10 μL,无菌去离子水6.4 μL,cDNA(500 ng·μL-1) 2 μL,上、下游引物各0.8 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s、60 ℃退火30 s、72 ℃延伸10 s,循环40次,每组重复4次(n=4)。根据实时荧光定量熔解曲线判断引物特异性,根据每个样品的Cq值,用2-ΔΔCt计算HIF-1α mRNA在牦牛不同部位皮肤中相对表达量。
1.2.4 Western blot 将成年牦牛4个部位的组织样研磨各称取100 mg,加入蛋白裂解液(RIPA∶RMSF=100∶1),离心取上清液,与4×蛋白上样缓冲液按3∶1混合,在100 ℃的恒温金属浴中加热10 min进行蛋白变性。配制8%的分离胶和5%的浓缩胶,进行SDS-PAGE凝胶电泳,转至PVDF膜上,5%脱脂奶粉室温封闭6 h,一抗HIF-1α(1∶500)4 ℃孵育过夜,PBST(磷酸盐缓冲液+tween 20)洗1 h,鼠二抗(1∶2 000)室温孵育1 h,PBST洗90 min。以β-actin作为内参,滴加电化学发光液(electro-chemi-luminescence,ECL)显影,用Image J软件对条带进行分析。
1.2.5 计数和统计学分析 从每个组织块横切切片中切取连续切片,隔3取1,取30张切片,在100倍镜视野下(面积为0.25 cm2)计数动脉、静脉、毛细血管、神经,换算为每平方厘米的数量,用均值±标准误差表示(x±sx,n=30),即血管与神经的密度。用SPSS19.0软件对所有数据进行统计学处理。采用单因素方差法分析以P>0.05表示差异不显著, P < 0.05表示差异显著。
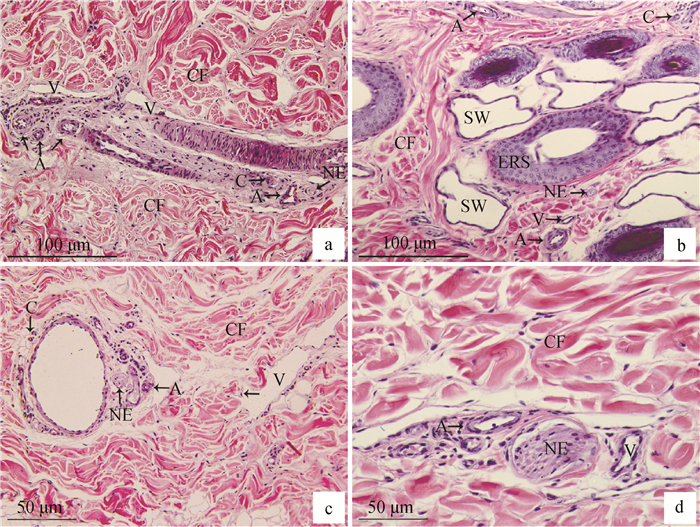
2 结果 2.1 成年牦牛皮肤内不同血管和神经的密度及分析通过HE切片观察发现(图 1),牦牛颈部、前臂部、小腿部、跖部皮肤内血管和神经分布相似。表皮层内无血管,真皮层内观察有丰富的血管和神经,且神经常与血管伴行,动脉和静脉多为中动脉和中静脉。动脉也常与静脉伴行,如图 1a所示的动静脉吻合支,形成血液间的小循环,调节局部皮肤的血流量和体温。汗腺周围也常分布有血管和神经,如图 1b所示,应与汗腺的代谢与调节作用有关,汗腺分泌汗液,进行体内物质的代谢,从而调节血管的收缩,而血液输送代谢物质,实现体内外的物质交换过程;神经则调节着汗腺和血管规律的进行代谢活动。真皮层排列着丰富的胶原纤维束,大而粗。夹杂少量肌纤维,支持着皮肤的活动。统计不同部位动脉密度,结果表明:颈部动脉密度最高,前臂部和小腿部次之,跖部密度最低,部位间差异显著(P < 0.05)(表 1);静脉、毛细血管、神经不同部位的密度计数结果类似于动脉,颈部最高,跖部最低(表 1)。由此可以推测出牦牛躯干部血管和神经密度最高,前肢明显高于后肢,后上肢明显高于后下肢。
|
a.颈部;b. 前臂部;c. 小腿部;d. 跖部;ERS.毛囊的上皮根鞘;SW.汗腺;NE.神经;A.动脉;V.静脉;C.毛细血管;CF.胶原纤维 a. Neck; b. Forearm; c. Crus; d. Metatarsus; ERS. The epithelial root sheath of hair follicles; SW. Sweat glands; NE. Nerve; A. Artery; V. Vein; C. Capillary; CF. Collagen fiber 图 1 成年牦牛不同部位皮肤内血管和神经的HE染色 Fig. 1 HE staining of vessels and nerves in different parts of adult yaks skin |
|
|
表 1 成年牦牛不同部位皮肤中动脉、静脉、毛细血管和神经的密度(x±s) Table 1 Density of arteries, veins, capillaries in different parts of adult yak skin(x±s) |
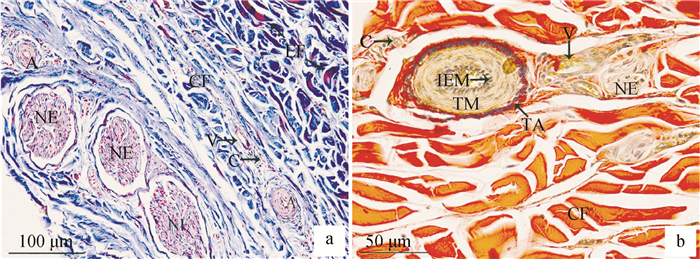
Masson’s三色染色结果显示牦牛颈部、前臂部、小腿部、跖部皮肤结构基本一致:真皮和皮下组织大部分平行排列着胶原纤维(蓝色),长短不一,夹杂少量弹性纤维(蓝粉色),比胶原纤维细短;血管常与神经伴行(红色)(图 2a)。Verhoeff VG染色结果显示颈部、前臂部、小腿部、跖部皮肤结构基本一致:真皮和皮下组织大部分都是胶原纤维(红色);动脉内弹性膜呈锯齿状(黑色),中膜由数十层环形平滑肌组成(黄色),外膜界限明显,呈螺旋状(黑色);静脉管壁薄,内弹性膜不明显,中膜由较少的几层平滑肌构成;神经分布在血管周围(黄色)(图 2b)。
|
a. Masson’s三色染色;b. Verhoeff VG染色;NE.神经;A.动脉;V.静脉;C.毛细血管;CF.胶原纤维;EF. 弹性纤维;IEM. 内弹性膜;TM.中膜;TA. 外膜 a. Masson's trichrome staining; b. Verhoeff VG staining; NE. Nerve; A. Artery; V. Vein; C. Capillary; CF. Collagen fiber; EF. Elastic fiber; IEM. Internal elastic membrane; TM. Tunica media; TA. Tunica adventitia 图 2 成年牦牛皮肤中血管和神经特殊染色 Fig. 2 Special staining of vessels and nerves of adult yaks skin |
免疫组织化学结果显示:HIF-1α阳性表达在细胞质,主要分布在表皮层、初级毛囊和次级毛囊的上皮根鞘(内根鞘和外根鞘)、汗腺分泌部和导管部、皮脂腺、神经、血管、竖毛肌;其中表皮、初级毛囊的外根鞘、汗腺的上皮细胞、皮脂腺细胞、血管的内弹性膜、竖毛肌纤维细胞呈强阳性表达,初级毛囊的毛囊内根鞘、次级毛囊的内外根鞘、血管的中膜、神经的外膜和纤维为阳性表达。颈部表达量最高,跖部表达量最低(图 3)。

|
a.颈部(a1、a2.阳性表达;a3、a4.空白对照);b. 前臂部(b1、b2.阳性表达;b3、b4.空白对照);c. 小腿部(c1、c2.阳性表达;c3、c4.空白对照);d. 跖部(d1、d2.阳性表达;d3、d4.空白对照);E.表皮;ERS.毛囊的上皮根鞘;SW.汗腺;SG.皮脂腺;A.动脉;V.静脉;C.毛细血管;NE.神经 a. Neck (a1, a2. Positive expression; a3, a4. Blank control); b. Forearm (b1, b2. Positive expression; b3, b4. Blank control); c. Crus (c1, c2. Positive expression; c3, c4. Blank control); d. Metatarsus (d1, d2. Positive expression; d3, d4. Blank control); E. Epidermis; ERS. The epithelial root sheath of hair follicles; SW. Sweat glands; SG. Sebaceous gland; A. Artery; V. Vein; C. Capillary; NE. Nerve 图 3 成年牦牛不同部位皮肤中HIF-1α的分布 Fig. 3 Ditribution of HIF-1α in different parts of adult yaks skin |
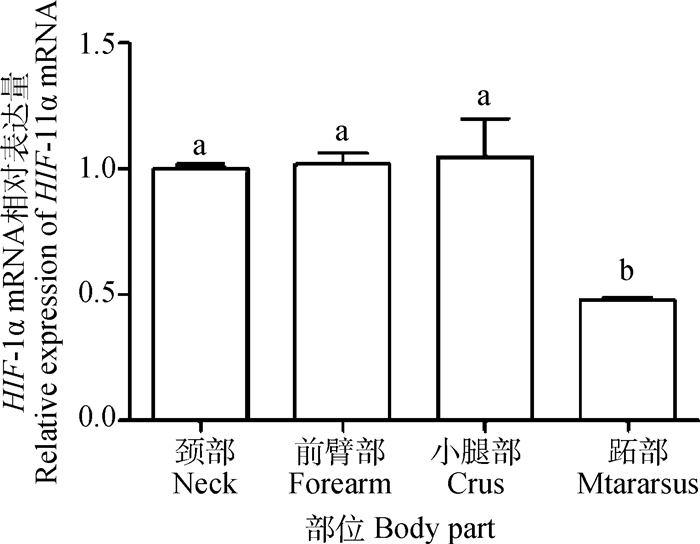
HIF-1α在成年牦牛不同部位的皮肤中均有表达。小腿部表达量最高,跖部最低。跖部表达量差异显著低于其他部位(P < 0.05),颈部、前臂部、小腿部两两比较,差异不显著(P>0.05)(图 4)。
|
不同字母表示差异显著(P < 0.05),相同字母表示差异不显著(P>0.05)。图 5同 Different letters mean significant difference (P < 0.05), same letter means no significant difference (P>0.05). The same as Fig. 5 图 4 成年牦牛不同部位皮肤中HIF-1α mRNA的相对表达量 Fig. 4 Relative expression of HIF-1α mRNA in different parts of adult yaks skin |
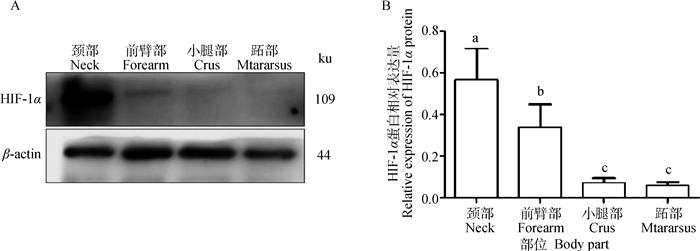
Western blot结果显示,HIF-1α在成年牦牛不同部位皮肤均有表达。颈部表达量最高,跖部表达量最低(图 5A)。颈部差异显著高于其他3个部位(P < 0.05),前臂部差异显著高于其他3个部位(P < 0.05),小腿部和跖部差异不显著(P>0.05)(图 5B)。
|
图 5 成年牦牛不同部位皮肤HIF-1α蛋白的相对表达量 Fig. 5 Relative expression of HIF-1α protein in different parts of adult yaks skin |
牦牛是高原环境下的主要畜种,更是世界上唯一能在高寒、低氧和牧草营养短缺等极端环境中生存的大型哺乳动物。皮肤作为与环境直接接触,抵御微生物入侵、物理攻击和化学攻击的第一道防线,与牦牛高原低氧适应性机制紧密相关。在适应高原高寒、低氧、强紫外线环境的过程中,皮肤结构随着生活环境的变化也发生了适应性变化[8]。首先牦牛的体型较其他牛种较小,四肢较短,体表褶皱较少,这样明显减少了单位面积的散热量。其次牦牛表皮中的黑素细胞在皮肤维持稳态的机制中发挥作用。牦牛在高原地区常年受到紫外线的照射,皮肤中大量的色素细胞交叉形成一定厚度的色素层,吸收部分紫外线的辐射,达到减轻紫外辐射对皮肤及机体内部器官损伤的作用。因为颈部皮肤直接暴露在光线照射下,所以它的代偿性作用远强于没有直接暴露在光线下的跖部、前臂部和小腿部受光线照射程度接近。而牦牛皮肤中的血管发生了一定的适应性变化是低氧适应机制的关键。低氧环境下血管内皮细胞增生,管壁增厚,管腔变窄[9],因此血流量减少,从而减少体温的散失,减慢了皮肤与外界能量的交换。青海牦牛皮肤血管分布稀少[10], 同样使血液的对流散热减少, 从而增强了皮肤的绝热性能。已经有研究表明,人体皮肤血液由身体上部至下部有逐渐降低的趋势[11],与本试验结果一致,证明牦牛皮肤内血液也有从上到下逐渐降低的趋势。根据于川等[12]对牦牛皮肤厚度的统计学研究,颈部真皮厚度明显高于其他3个部位,而血管分布在皮肤的真皮层,所以推测颈部皮肤有更好的低氧适应性机制。神经可以调控血管的收缩与舒张,根据本试验对皮肤内不同部位的神经密度的统计,证明成年牦牛皮肤内神经有“从躯干部到四肢,从前肢到后肢递减”的趋势。
HIF-1α对皮肤稳态至关重要,主要表达在表皮的基底层[13-14]。HIF-1α已经被证明可以调节皮肤细胞的黏附和迁移,如人成纤维细胞[15]和角质细胞[16]。HIF-1α调节的通路显著参与了组织稳态和新生血管的形成,产生新的胶原、弹性蛋白、糖胺聚糖和滋养血管[17]。HIF-1α的调节已被证明是皮肤内稳态的关键,在伤口愈合中起重要作用,这表明HIF-1α参与真皮组织修复[18-19]。HIF-1α途径下游100多个基因的进一步激活对控制血管生成、细胞增殖、迁移和葡萄糖代谢至关重要[20-21]。皮肤作为感受氧含量变化的第一道屏障,通过调节皮肤HIF-1α含量及皮肤血流量而影响EPO的表达水平,就可以将缺氧代偿反应扩展到全身,因此皮肤是介导全身性低氧反应的一个敏感调控器[22]。单波长红外线/红光治疗能提高皮肤组织HIF-1α、VEGF表达水平,HIF-1α及VEGF表达水平下降导致皮肤真皮层新生血管缺乏[23]。结合本试验结果,牦牛长期受强光照射,因此皮肤中HIF-1α和VEGF表达水平升高,从而促进了真皮层新生血管的生成。也有研究证明,在皮肤基底细胞癌(BBC)与皮肤鳞状细胞癌(cSCC)中,HIF-1α和VEGF高表达,且呈正相关[24]。罗鸿[25]得出结论,低氧条件下HIF-1α具有时间依赖性,当缺氧48 h时,HIF-1α的mRNA和蛋白表达水平达到最高;且具有氧浓度递减依赖性,当氧浓度下降到1%时,HIF-1α的mRNA和蛋白表达水平达到最高。
本研究结果表明HIF-1α在成年牦牛皮肤的不同部位均有表达,但mRNA与蛋白表达趋势并不完全一致。究其原因,可以用其降解特征解释:基因可以编码蛋白质,但不是所有基因都会表达,基因从表达到产生蛋白质要经过转录和翻译过程。mRNA的修饰、运输、降解和一些small RNA, 如miRNA的调节,均可改变蛋白质的表达水平。HIF-1α在翻译后,可通过泛素化、乙酰化、磺酰化和磷酸化等方式调节其稳定性和转录活性。拜占春等[26]证明了HIF-1α的mRNA和蛋白在成年牦牛脑组织的不同部位的表达具有差异性,李慧[27]也证明HIF-1α在牦牛不同组织中mRNA和蛋白表达趋势不尽一致。
4 结论成年牦牛皮肤中血管和神经结构与分布不同部位间相似,密度具有部位间差异;HIF-1α在皮肤中均有表达,颈部最高,跖部最低。推测HIF-1α在成年牦牛皮肤低氧适应性机制中发挥了作用。
| [1] |
NIYONSABA F, OGAWA H. Protective roles of the skin against infection: implication of naturally occurring human antimicrobial agents β-defensins, cathelicidin LL-37 and lysozyme[J]. J Dermatol Sci, 2005, 40(3): 157-168. DOI:10.1016/j.jdermsci.2005.07.009 |
| [2] |
STENN K S, PAUS R. Controls of hair follicle cycling[J]. Physiol Rew, 2001, 81(1): 449-494. |
| [3] |
SLOMINSKI A, WORTSMAN J, PAUS R, et al. Skin as an endocrine organ: implications for its function[J]. Drug Discov Today Dis Mech, 2008, 5(2): e137-e144. DOI:10.1016/j.ddmec.2008.04.004 |
| [4] |
耿尧. 牦牛皮肤结构与功能研究[D]. 兰州: 兰州大学, 2006. GENG Y. Study on structure and function of the skin of yaks (Bos gruniens)[D]. Lanzhou: Lanzhou University, 2006. (in Chinese) |
| [5] |
曹迷霞, 崔燕, 何俊峰, 等. 成年牦牛汗腺和皮脂腺的组织学特征[J]. 解剖学报, 2018, 49(4): 486-491. CAO M X, CUI Y, HE J F, et al. Histological characteristics of the sweat glands and sebaceous glands in adult yaks[J]. Acta Anatomica Sinica, 2018, 49(4): 486-491. (in Chinese) |
| [6] |
MANALO D J, ROWAN A, LAVOIE T, et al. Transcriptional regulation of vascular endothelial cell responses to hypoxia by HIF-1[J]. Blood, 2005, 105(2): 659-669. DOI:10.1182/blood-2004-07-2958 |
| [7] |
DAI Y, XU M F, WANG Y G, et al. HIF-1α induced-VEGF overexpression in bone marrow stem cells protects cardiomyocytes against ischemia[J]. J Mol Cell Cardiol, 2007, 42(6): 1036-1044. DOI:10.1016/j.yjmcc.2007.04.001 |
| [8] |
张湑泽, 彭飞, 侯业茂, 等. 高原林蛙不同部位皮肤组织结构比较[J]. 动物学杂志, 2018, 53(4): 582-588. ZHANG X Z, PENG F, HOU Y M, et al. Comparison of different skin tissue structures in different parts of Rana kukunoris[J]. Chinese Journal of Zoology, 2018, 53(4): 582-588. (in Chinese) |
| [9] |
李晓霞, 孙宏夫, 李承义, 等. 高原不同民族人体皮肤组织的形态变化[J]. 高原医学杂志, 1994, 4(4): 15-17. LI X X, SUN H F, LI C Y, et al. Morphologic changes of human skin in different nationalities at high altitude[J]. Journal of High Altitude Medicine, 1994, 4(4): 15-17. (in Chinese) |
| [10] |
俞世福, 陈爱霞, 杨枝. 青海牦牛皮肤组织学结构与生态的研究[J]. 青海畜牧兽医学院学报, 1985(2): 1-6, 53. YU S F, CHEN A X, YANG Z. Study on the histological structure and ecology of skin of Qinghai yaks[J]. Journal of Qinghai Animal Husbandry and Veterinary Medicine College, 1985(2): 1-6, 53. (in Chinese) |
| [11] |
FAGRELL B, INTAGLIETTA M, ÖSTERGREN J. Relative hematocrit in human skin capillaries and its relation to capillary blood flow velocity[J]. Microvas Res, 1980, 20(3): 327-335. DOI:10.1016/0026-2862(80)90033-3 |
| [12] |
于川, 崔燕, 杨雪, 等. 不同年龄牦牛皮肤厚度变化研究[J]. 甘肃农业大学学报, 2017, 52(1): 21-25. YU C, CUI Y, YANG X, et al. Thickness changes of skin in different age yak (Bos grunniens)[J]. Journal of Gansu Agricultural University, 2017, 52(1): 21-25. (in Chinese) |
| [13] |
BEDOGNI B, WELFORD S M, CASSARINO D S, et al. The hypoxic microenvironment of the skin contributes to Akt-mediated melanocyte transformation[J]. Cancer Cell, 2005, 8(6): 443-454. DOI:10.1016/j.ccr.2005.11.005 |
| [14] |
ROSENBERGER C, SOLOVAN C, ROSENBERGER A D, et al. Upregulation of hypoxia-inducible factors in normal and psoriatic skin[J]. J Investigat Dermatol, 2007, 127(10): 2445-2452. DOI:10.1038/sj.jid.5700874 |
| [15] |
LI W, LI Y, GUAN S X, et al. Extracellular heat shock protein-90α: linking hypoxia to skin cell motility and wound healing[J]. EMBO J, 2007, 26(5): 1221-1233. DOI:10.1038/sj.emboj.7601579 |
| [16] |
FITSIALOS G, BOURGET I, AUGIER S, et al. HIF1 transcription factor regulates laminin-332 expression and keratinocyte migration[J]. J Cell Sci, 2008, 121: 2992-3001. DOI:10.1242/jcs.029256 |
| [17] |
SARKAR K, FOX-TALBOT K, STEENBERGEN C, et al. Adenoviral transfer of HIF-1αenhances vascular responses to critical limb ischemia in diabetic mice[J]. Proc Natl Acad Sci U S A, 2009, 106(44): 18769-18774. DOI:10.1073/pnas.0910561106 |
| [18] |
SEMENZA G L. Regulation of oxygen homeostasis by hypoxia-inducible factor 1[J]. Physiology (Bethesda), 2009, 24: 97-106. |
| [19] |
BISWAS S, ROY S, BANERJEE J, et al. Hypoxia inducible microRNA 210 attenuates keratinocyte proliferation and impairs closure in a murine model of ischemic wounds[J]. Proc Natl Acad Sci U S A, 2010, 107(15): 6976-6981. DOI:10.1073/pnas.1001653107 |
| [20] |
LIU L X, MARTI G P, WEI X F, et al. Age-dependent impairment of HIF-1α expression in diabetic mice: Correction with electroporation-facilitated gene therapy increases wound healing, angiogenesis, and circulating angiogenic cells[J]. J Cell Physiol, 2008, 217(2): 319-327. DOI:10.1002/jcp.21503 |
| [21] |
CHO Y S, BAE J M, CHUN Y S, et al. HIF-1α controls keratinocyte proliferation by up-regulating p21(WAF1/Cip1)[J]. Biochim Biophys Acta, 2008, 1783(2): 323-333. DOI:10.1016/j.bbamcr.2007.11.017 |
| [22] |
巩沅鑫. 皮肤作为氧感受器参与全身低氧反应调节[J]. 西南国防医药, 2009, 19(1): 137-139. GONG Y X. Skin participates in systemic hypoxia response regulation as an oxygen receptor[J]. Medical Journal of National Defending Forces in Southwest China, 2009, 19(1): 137-139. DOI:10.3969/j.issn.1004-0188.2009.01.065 (in Chinese) |
| [23] |
林楚佳, 蓝尤冕, 欧妙琼, 等. 单波长红外线/红光治疗对糖尿病足患者皮肤缺氧诱导因子1α和血管内皮生长因子表达的影响[J]. 中国医药, 2020, 15(3): 401-405. LIN C J, LAN Y M, OU M Q, et al. Effect of single wavelength infrared/red light therapy on skin hypoxia inducible factor-1α and vascular endothelial growth factor expression in patients with diabetic foot[J]. China Medicine, 2020, 15(3): 401-405. DOI:10.3760/j.issn.1673-4777.2020.03.020 (in Chinese) |
| [24] |
聂小娟. 表皮肿瘤中缺氧诱导因子-1α与血管生成相关蛋白表达关系的研究[D]. 济南: 山东大学, 2016. NIE X J. Study on expression of hypoxia inducible factor-la and relationship with angiogenesis-related proteinin skin neoplasm[D]. Ji'nan: Shandong University, 2016. (in Chinese) |
| [25] |
罗鸿. 低氧条件下沉默HIF-1α与TNF-α、IL-6的相关性研究及人真皮微血管内皮细胞生物学行为的变化[D]. 重庆: 重庆医科大学, 2018. LUO H. The Relationship among HIF-1α, TNF-α and IL-6 the change of the biological behavior of human dermal microvacular endothelial cells after silencing gene HIF-1α under hypoxia[D]. Chongqing: Chongqing Medical University, 2018. (in Chinese) |
| [26] |
拜占春, 崔燕, 余四九, 等. HIF1α和Beclin1在成年牦牛脑组织中的表达与分布[J]. 农业生物技术学报, 2019, 27(10): 1878-1884. BAI Z C, CUI Y, YU S J, et al. Expression and distribution of HIF1α and Beclin1 in adult yak (Bos grunniens) brain tissues[J]. Journal of Agricultural Biotechnology, 2019, 27(10): 1878-1884. (in Chinese) |
| [27] |
李慧. 低氧条件下成年牦牛肾间质成纤维样细胞中EPO的适应性调控研究[D]. 兰州: 甘肃农业大学, 2020. LI H. Adaptive regulation of EPO in adult yak renal interstitial fibroblasts-like cells under hypoxia[D]. Lanzhou: Gansu Agricultural University, 2020. (in Chinese) |
编辑 白永平



