2. 微生物生物转化中药河南省工程实验室, 郑州 450046;
3. 河南省益生菌生物转化工程技术研究中心, 郑州 450046;
4. 河南农业大学, 郑州 450046
2. Engineering Laboratory of Microbial Bioconversion Traditional Chinese Medicine of Henan Province, Zhengzhou 450046, China;
3. Probiotics Bioconversion Engineering Technology Research Center of Henan Province, Zhengzhou 450046, China;
4. Henan Agricultural University, Zhengzhou 450046, China
黄曲霉毒素(aflatoxin,AFT)是一类有害的真菌毒素,主要包括黄曲霉和寄生曲霉代谢分泌的黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)及其衍生物黄曲霉毒素M1(AFM1)、黄曲霉毒素M2(AFM2)[1-2],其中以AFB1毒性最强、性质最稳定[3-4]。黄曲霉毒素分布广泛,粮食生产因为霉菌毒素污染而损失惨重,同时由于其强毒性和致癌性,严重威胁着人类和动物的健康[5-7]。
自霉菌毒素被发现以来,科研人员尝试使用各种方法去除粮食和饲料中的毒素,传统的霉菌毒素脱毒方法主要依靠物理法和化学法[8-10]。然而,这些方法在实际生产运用中存在诸多缺陷,如脱毒效率低下、易降低营养物质利用率、毒素二次污染、影响饲料适口性等;同时由于部分脱毒工艺昂贵,难以规模化量产,难以应用于实际生产[11-12]。相反,使用微生物降解法进行脱毒,安全高效,特异性强,不影响饲料的感官品质,且脱毒工艺经济可行[13-14]。近年来,利用微生物降解霉菌毒素受到广大科研人员和养殖业的青睐,成为研究热点。本研究以香豆素为唯一碳源,筛选出一批能高效降解AFB1的菌株,并对脱毒能力最优的菌株进行了鉴定,同时对该菌株发酵液中脱毒活性组分的脱毒效果进行研究。
1 材料与方法 1.1 菌种及细胞来源采集土壤、酸奶、动物粪便、发霉粮食、发酵食品等作为待分离样品,以及实验室保藏的芽胞杆菌、乳酸菌等菌株;鸡肝癌细胞(LMH),购自美国菌种保藏中心(ATCC)。
1.2 培养基营养肉汤(北京奥博星),营养琼脂(北京奥博星),MRS培养基(青岛日水),马铃薯葡萄糖肉汤培养基(北京奥博星),DMEM/F-12(1∶1)营养液(美国Hyclone)。初筛培养基为改良Hormisch[15]筛选培养基(g·L-1):KNO3 0.5,KH2PO4 0.25,MgSO4·7H2O 0.25,(NH4)2SO4 0.5,FeCl3·6H2O 0.003,CaCl2·2H2O 0.005,琼脂20,121 ℃高压蒸汽灭菌20 min,冷却后加入过滤除菌的香豆素溶液,终浓度为1 g·L-1;种子培养基及发酵培养基均为LB培养基(g·L-1):胰蛋白胨10,酵母提取物5,NaCl 10,pH 7.0。
1.3 主要试剂及仪器AFB1标准品(上海源叶),细菌生化鉴定管(青岛海博),AFB1ELISA检测试剂盒(深圳芬德),胰蛋白酶(美国Gibco),细菌基因组DNA提取试剂盒(北京天根生化),CCK-8细胞增殖-毒性检测试剂盒(日本Dojindo),高速冷冻离心机(湖南湘仪),多功能酶标仪(美国Thermo Fisher Scientific),细胞培养箱(上海博迅)。
1.4 降解AFB1菌株的分离与筛选使用生理盐水溶解待分离样品,吸取上清液转接于种子培养基,37 ℃振荡培养18~24 h。同时将实验室保存的菌株摇瓶复苏活化。
初筛:取上述摇瓶菌液,适度稀释后吸取0.1 mL涂布于初筛培养基上,37 ℃倒置培养5 d,挑取生长较好的菌落,再于初筛培养基上划线分离3次,从中选取能利用香豆素作为碳源的纯种菌株保存备用[16]。
复筛:挑取初筛得到的纯种菌株接种于50 mL种子培养基中,培养18~24 h。将种子液按照2%比例接入50 mL发酵培养基中,37 ℃培养72 h。
向无菌EP管中加入复筛菌株发酵液和AFB1标准品溶液(500 ng·mL-1),使AFB1终浓度为50 ng·mL-1,同时以无菌LB培养基加AFB1标准品溶液作为空白对照,37 ℃温箱内振荡作用72 h,每组处理做3个平行,重复2次。作用结束后,按照AFB1ELISA检测试剂盒说明书检测每组AFB1含量,选取AFB1降解率最高的菌株作为目标菌株。AFB1降解率按照以下公式计算:AFB1降解率(%)=(1-试验组AFB1含量/空白组AFB1含量)×100
1.5 菌株的鉴定1.5.1 形态学鉴定 将复筛得到的菌株划线接种于LB琼脂平板,37 ℃培养箱内培养24~72 h,观察菌落形态,并挑取单个菌落进行革兰染色,观察菌体形态。
1.5.2 生理生化鉴定 参考《伯杰细菌鉴定手册》[17]与《常见细菌系统鉴定手册》[18],对筛选菌株进行厌氧生长试验、7%氯化钠生长试验、pH 5.7生长试验、硝酸盐还原试验、V-P试验、淀粉水解试验、明胶液化试验、糖发酵试验、碳源利用试验等生理生化试验。
1.5.3 16S rDNA鉴定 利用细菌基因组DNA提取试剂盒提取筛选菌株DNA。使用细菌16S rDNA通用引物进行扩增。27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1 541R:5′-AAGGAGGTGATCCAGCCGCA-3′。PCR反应体系40 μL:20 μL 2×Taq Mix、上下游引物各1 μL、16 μL双蒸水、2 μL DNA模板。PCR反应条件:94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共28个循环;72 ℃终延伸10 min。对PCR扩增产物进行1%琼脂糖凝胶电泳,将目的片段大小为1 540 bp的PCR产物送测序。引物合成及PCR产物测序由上海生工生物公司完成。测序结果在NCBI上使用BLAST进行同源性比对,并构建基于16S rDNA序列的系统发育树。
1.6 脱毒活性组分的确定取10 mL筛选菌株发酵液4 ℃、10 000 r·min-1离心10 min,收集上清液备用;将菌体沉淀使用无菌生理盐水洗涤2次,加入10 mL生理盐水重悬菌体,制备菌体悬液备用;从上述菌体悬液中吸取5 mL,冰浴条件下超声波破碎菌体,4 ℃,10 000 r·min-1离心10 min,收集上清,获得菌体裂解物上清;菌体破碎沉淀使用无菌生理盐水洗涤2次,后用5 mL生理盐水重悬沉淀,获得细菌细胞裂解物。向发酵液、上清液、菌体悬液、菌体裂解物上清和细菌细胞裂解物中分别加入终浓度为50 ng·mL-1的AFB1标准品溶液,同时以LB培养基加AFB1标准品溶液作为空白对照,37 ℃温箱内振荡作用72 h,每组试验做3个平行,重复2次,作用结束后测定各组分AFB1降解率。
1.7 AFB1降解后产物的细胞毒性试验将鸡肝癌细胞(LMH)接种于含有F12培养基(含10% FBS)的培养瓶中,37 ℃、5% CO2培养箱中培养至细胞铺满瓶底,加入胰蛋白酶消化分散细胞。向96孔板中接入100 μL的LMH细胞,置于37 ℃、5%CO2培养条件下培养24 h。每孔分别加入10 μL(AFB1终浓度分别为10、20、30、40、50 μg·mL-1)待测物质,待测物质分为AFB1组(仅含有AFB1)和产物组(AFB1+上清液组两者作用降解72 h),各浓度均设5个重复孔,同时以仅含细胞的培养液作为对照组,置于37 ℃、5%CO2培养条件下培养24 h。吸干96孔板中的培养基,更换成新鲜F12培养基(含2% FBS)。向每孔加入10 μL CCK-8溶液。将96孔板置于37 ℃、5% CO2环境下孵育1~4 h。用酶标仪测定在450 nm处的吸光度。样品的细胞毒性表示公式:
细胞毒性(%)= (1-试验样品OD450 nm/对照组OD450 nm)×100。
1.8 不同理化因素对活性组分脱毒效果的影响取上述AFB1降解率最高的脱毒活性组分5 mL,分别进行热处理(沸水中煮30 min,恢复至室温)、强酸处理(HCl溶液调节其pH至1.0,作用2 h后调至7.0)、强碱处理(NaOH溶液调节其pH至13.0,作用2 h后调至7.0)、紫外灯照射处理(无菌工作台内紫外照射60 min)及蛋白酶K处理(加入终浓度为2 mg·mL-1的蛋白酶K作用2 h),分别加入终浓度为50 ng·mL-1的AFB1标准品溶液,以LB培养基加AFB1标准品溶液作为空白对照,每组试验做3个平行,重复2次,37 ℃温箱内振荡作用72 h后对各组处理的AFB1降解率进行测定。
2 结果 2.1 菌株的筛选经过初筛得到24株能够在以香豆素为唯一碳源的培养基生长良好的菌株,以对AFB1标准品溶液的降解率为指标对初筛菌株进行复筛,从中筛选出1株能够高效降解AFB1的菌株Y1-B1,其降解率达到73.2%(表 1)。
|
|
表 1 降解黄曲霉毒素B1菌株的筛选结果 Table 1 Results of the screened aflatoxin B1 degradation strains |
2.2.1 形态学鉴定 如图 1所示,Y1-B1菌株在LB培养基上生长为灰白色、有光泽、呈现不透明的圆形菌落,边缘不规则,菌落中心有乳白色突起,呈山丘状,且菌落不易挑起。Y1-B1菌株培养18~20 h时革兰染色,镜检为紫色短杆状菌体,判定为革兰阳性。继续培养至后期形成芽胞,芽胞中生(图 2)。
|
图 1 菌株Y1-B1在LB培养基上菌落形态 Fig. 1 Colony morphology of strain Y1-B1 cultured in LB medium |

|
图 2 菌株Y1-B1形态(革兰染色,1000×) Fig. 2 Cell morphology of strain Y1-B1(Gram staining, 1 000×) |
2.2.2 生理生化鉴定 Y1-B1菌株生理生化鉴定结果如下(表 2),将该鉴定结果对比GB/T26428— 2010《饲用微生物制剂中枯草芽胞杆菌的检测》,可初步判定该菌株属于枯草芽胞杆菌菌群。枯草芽胞杆菌菌群是广大益生菌家族中的一员,枯草芽胞杆菌菌群包括枯草芽胞杆菌及其近缘种群,如解淀粉芽胞杆菌(Bacillus amyloliquefaciens)、地衣芽胞杆菌(Bacillus licheniformis)、萎缩芽胞杆菌(Bacillus atrophaeus)等均属于该类群[19]。
|
|
表 2 Y1-B1菌株生理生化试验结果 Table 2 Results of physiological and biochemical experiments of the strain Y1-B1 |
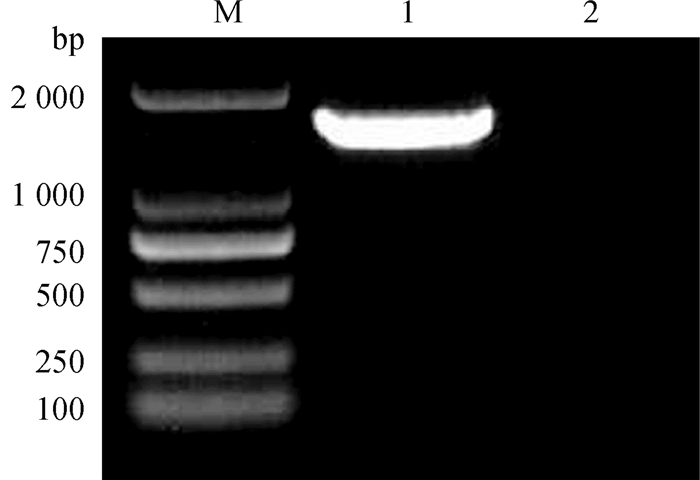
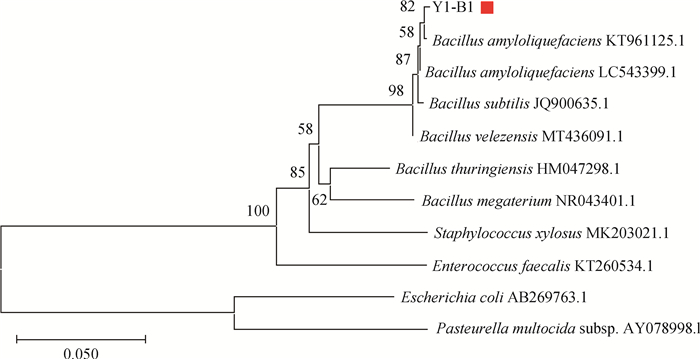
2.2.3 16S rDNA序列分析 对PCR扩增产物进行1%琼脂糖凝胶电泳得到单一条带,且条带大小约为1 540 bp(图 3),将PCR产物送至上海生工生物公司进行测序。将Y1-B1菌株16S rDNA测序结果在NCBI上通过BLAST进行同源性比对,根据GenBank数据库公布的有关菌种数据进行系统发育分析。由图 4可知,Y1-B1菌株与Bacillus amyloliquefaciens(KT961125.1)在同一分支中,16S rDNA序列相似性达到99%。结合上述形态学鉴定和生理生化鉴定结果,最终确定该菌株为解淀粉芽胞杆菌(Bacillus amyloliquefaciens)。
|
M. DL2000 DNA相对分子质量标准;1.Y1-B1菌株PCR产物;2. 阴性对照 M. DL2000 DNA marker; 1.PCR products of Y1-B1 strain; 2. Negative control 图 3 Y1-B1菌株16S rDNA PCR结果 Fig. 3 PCR of 16S rDNA of strain Y1-B1 |
|
图 4 Y1-B1菌株系统发育树 Fig. 4 Phylogenetic tree of strain Y1-B1 |
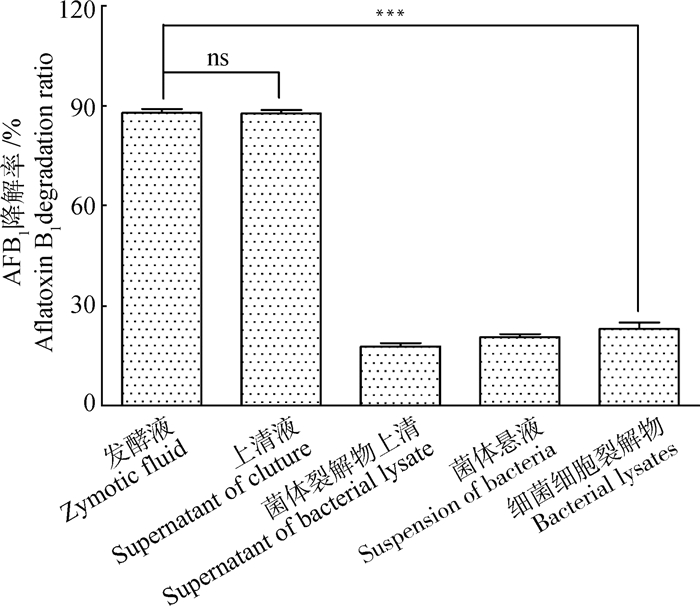
对解淀粉芽胞杆菌Y1-B1培养物的不同组分进行AFB1降解活性测定。结果显示,发酵液的不同组分均具有一定的黄曲霉毒素B1降解活性(图 5)。其中,上清液的脱毒活性显著高于菌体裂解物上清、菌体悬液以及细菌细胞裂解物,上清液对AFB1的降解率为87.8%,菌体裂解物上清、菌体悬液和细菌细胞裂解物对AFB1的降解率分别为17.9%(P < 0.001)、20.8%(P < 0.001)、23.3%(P < 0.001)。其中菌体悬液和细菌细胞裂解物均具有一定的脱毒能力,分析可能是菌体细胞壁结构对AFB1有一定的吸附作用[20],同时Y1-B1菌株的菌体裂解物上清也具有一定的脱毒能力,但其脱毒能力相对上清液较弱。因此,Y1-B1菌株的胞外分泌物发挥主要的脱毒作用。与发酵液的AFB1降解率88.1%相比,细菌培养上清液的脱毒效果基本相同,无显著差异(P >0.05)。
|
ns. P>0.05; *. P < 0.05; **. P < 0.01; ***. P < 0.001 ns. P>0.05; *. P < 0.05; **. P < 0.01; ***. P < 0.001 图 5 解淀粉芽胞杆菌Y1-B1的AFB1脱毒活性成分分析 Fig. 5 Detoxification active component of Bacillus amyloliquefaciens Y1-B1 |
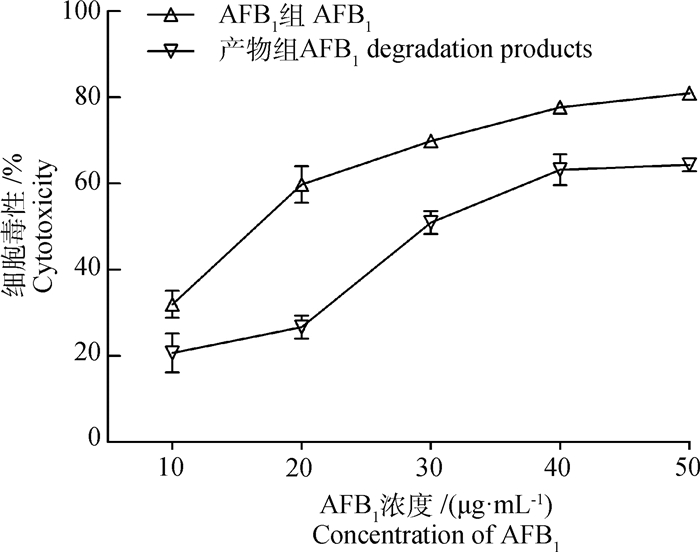
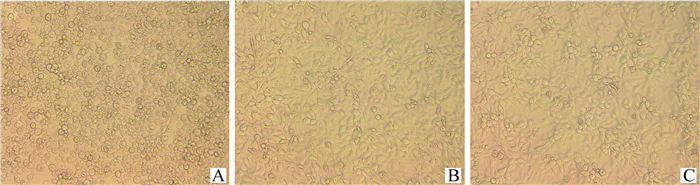
通过细胞毒性试验,对比AFB1及AFB1降解后的产物对LMH细胞的毒性。如图 6所示,在相同的AFB1浓度下,产物组对LMH细胞的毒性作用均明显低于AFB1组,且随着AFB1浓度的升高,两组细胞毒性均呈增加趋势,分析原因可能是加入的AFB1标准品终浓度偏高所致。当AFB1终浓度为20 μg·mL-1时,AFB1组细胞发生显著的形态变化,细胞皱缩破裂,部分细胞呈圆形推测其即将凋亡,而产物组仅有少量细胞死亡(图 7)。
|
图 6 AFB1及AFB1降解产物分别处理LMH细胞的毒性检测 Fig. 6 Cytotoxicity detection of LMH cells treated with AFB1 and AFB1 degradation products |
|
A. AFB1组;B. 产物组;C. 对照组 A. AFB1; B. AFB1 degradation products; C. Control group 图 7 AFB1及AFB1降解产物(AFB1浓度为20 μg·mL-1)分别处理LMH细胞的细胞形态 Fig. 7 Morphology of LMH cells treated with AFB1 and AFB1 degradation products(AFB1 concentration was 20 μg·mL-1) |
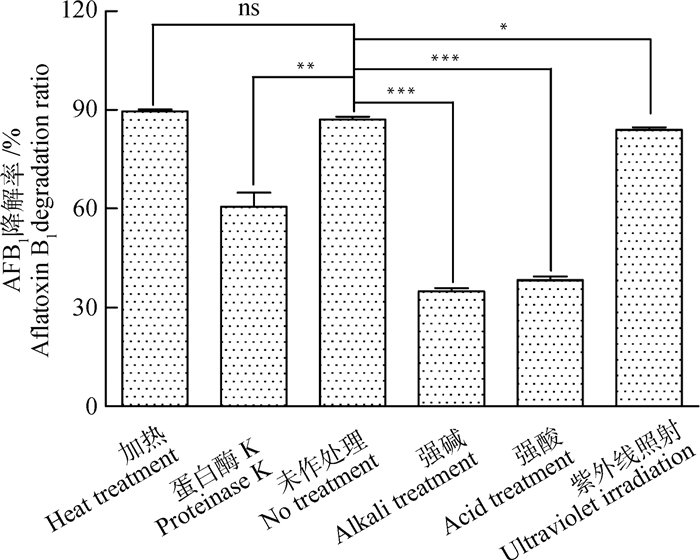
不同理化处理对解淀粉芽胞杆菌Y1-B1脱毒活性物质的脱毒效果研究结果显示,上清液经过热处理后,AFB1降解率为89.6%,对比未作处理上清液87.2%的AFB1降解率,两者差异不显著(P>0.05),说明该脱毒活性物质对热处理具有极好的耐受性。上清液经过紫外照射处理、强碱、强酸和蛋白酶K处理后,脱毒能力均有不同程度的下降,AFB1降解率分别为83.9%(P < 0.05)、35.0%(P < 0.001)、38.2%(P < 0.001)、60.5%(P < 0.01),说明紫外照射处理对其脱毒能力影响较小,强酸、强碱处理对其影响较大,蛋白酶K处理仅有部分影响(图 8)。
|
ns. P>0.05; *. P < 0.05; **. P < 0.01; ***. P < 0.001 图 8 不同理化处理对解淀粉芽胞杆菌Y1-B1活性组分脱毒效果的影响 Fig. 8 Influence of different physical and chemical treatments on the detoxification effects of the active components of Bacillus amyloliquefaciens Y1-B1 |
由于黄曲霉毒素具有强毒性、高稳定性和高致癌性等特点,不仅会影响粮食及饲料产品的经济效益,同时也潜在威胁着人类和动物的健康,探索去除或降低黄曲霉毒素的方法具有重要意义。以往的脱毒方法常采用物理法或化学法,但在使用过程中存在诸多弊端,如蒙脱石、硅藻土等能吸附饲料中的黄曲霉毒素,但也能吸附饲料中的维生素、微量元素和氨基酸等营养成分而降低营养物质的利用率,同时吸附的毒素有可能在动物胃肠道内重新释放,未被代谢或者重新释放的毒素随粪便排出造成环境的二次污染等[21-22],因此控制黄曲霉毒素的污染急需一种高效率、特异性强以及对饲料和环境没有污染的技术。
近年来,利用真菌和细菌生物降解霉菌毒素已成为科研人员研究的热点。Wang等[23]发现白腐真菌(Phanerochaete sordida) YK-624产生的锰过氧化物酶MnP能降解AFB1,降解率高达86.0%,并发现其脱毒机制为MnP先将AFB1氧化为AFB1-8, 9-环氧化物,后水解转化为AFB1-8, 9-二氢二醇。Shcherbakova等[24]从球状茎点霉PG41(Phoma glomerata PG41)发酵液上清和胞内液中分离到两种蛋白质类物质,两种物质分别能降解78.0%和66.0%的AFB1,但降解过程受pH和时间影响较大,且对温度不稳定,使用蛋白酶K处理也能明显降低脱毒效果。Zhang等[25]筛选出一株黑曲霉ND-1(Aspergillus niger ND-1),在最佳发酵条件下AFB1降解率为58.2%,且其降解过程为酶促反应,脱毒物质为胞外产物。Alberts等[26]报道,红平红球菌(Rhodococcus erythropolis)发酵液上清能有效降解AFB1,同时发现该降解过程为酶促反应,AFB1降解酶是分泌到细胞外的。Adebo等[27]发现从鳗败血假单胞菌VGF1(Pseudomonas anguilliseptica VGF1)、荧光假单胞菌(Pseudomonas fluorescens)和葡萄球菌VGF2(Staphylococcus sp. VGF2)提取的胞内液,在加入蛋白酶抑制剂的情况下,作用6 h后3种细菌对AFB1的降解率分别为66.5%、63.0%和100%,当不加入蛋白酶抑制剂时,发酵液和胞内液的AFB1降解率显著下降。目前报道的微生物中,降解AFB1多为酶促反应,受蛋白酶K影响显著。蛋白类酶物质存在着提取操作繁琐,酶产量不足,酶性质不稳定、酶促反应条件苛刻、毒素降解过程缓慢且不完全等问题[28-29],而且大部分脱毒菌株为非安全菌株,不能作为活菌制剂直接添加到饲料中,因此大多数研究成果仍停留在实验室阶段,在实际生产中较难应用。本试验以香豆素为唯一碳源筛选出一株能高效降解AFB1的菌株,AFB1降解率达到73.2%,后期通过对其发酵条件优化,该菌发酵液AFB1降解率由原来的73.2%提升到86.1%,优化效果显著。经鉴定Y1-B1菌株为解淀粉芽胞杆菌,属于芽胞杆菌属,与枯草芽胞杆菌亲缘性高。作为一种生物拮抗菌来说,解淀粉芽胞杆菌已广泛应用于蔬菜保鲜、工业酶生产及环境保护等众多领域,并被证实安全有效。解淀粉芽胞杆菌在其生长过程中能产生一系列的代谢产物,如Arrebola等[30]使用甲醇提取解淀粉芽胞杆菌PPCB004抑菌成分,该抑菌物质对7种柑橘致病真菌具有抗菌作用,经色谱分析法分析发现该抑菌物质主要为伊枯草菌素A。Moyne等[31]采用阴离子交换和凝胶过滤色谱法从枯草芽胞杆菌AU195中分离到杆菌霉素D,该物质对黄曲霉及其他真菌均有很强的抑制作用。Reddy等[32]以200 mL·kg-1的比例将枯草芽胞杆菌发酵液添加到稻米中,68.0%的黄曲霉生长被抑制同时58.0%的黄曲霉毒素被降解。王英国等[33]从堆肥中分离到一株解淀粉芽胞杆菌,该菌对尖孢镰刀菌、毛霉、黑曲霉等均具有强烈的抗真菌活性,对抗菌物质进行分离纯化并通过红外光谱和质谱分析推测其为一种分子质量1 498 Da的肽类物质。以上报道可以看出,解淀粉芽胞杆菌的代谢产物大多具有广谱抑制真菌的特性。然而,关于解淀粉芽胞杆菌降解霉菌毒素的研究相对较少。Farzaneh等[34]从开心果中分离到一株枯草芽胞杆菌(Bacillus subtilis)UTBSP1,可有效降解营养肉汤及开心果中的AFB1,降解率分别为85.7% 和95.0%;无细胞上清液可使AFB1含量下降78.4%,AFB1的降解是酶促反应,可能是一种胞外的组成性酶,降解后AFB1与标准AFB1化学性质不同,失去了荧光性质。Farzaneh等[35]进一步研究发现,该菌株可显著降低开心果中黄曲霉(Aspergillus flavus)R5的生长和AFB1的含量,菌株UTBSP1的无细胞上清液会显著影响黄曲霉孢子的活力;质谱分析显示无细胞上清液的甲醇提取物中有两种化合物与surfactin的环脂肽和fengycin家族具有高度相似性,并以协同方式针对黄曲霉R5表现出强抑菌活性,但对于降解AFB1的机制未进行深入阐述。关心[36]从鸡粪样品中分离筛选出1株蔬菜芽胞杆菌(Bacillus oleronius)GX01,AFB1的降解率达83.0%,上清液加热、加蛋白酶K后的降解活性下降显著,分别为16.2%和23.9%,表明蔬菜芽胞杆菌GX01降解AFB1的物质是胞外酶。王佳伟等[37]从堆肥土壤中分离到一株解淀粉芽胞杆菌SG16,其发酵上清液对AFB1的降解率能达到80.6%,但温度、pH、金属离子、蛋白酶K等酶促反应因素均能影响其解毒酶活力,其活性物质初步鉴定为胞外酶,酶促反应条件较为严苛。蔡国林等[38]分离到的解淀粉芽胞杆菌CGMCC-9021能够高效降解AFB1,结合硫酸铵分级沉淀、DEAE FF阴离子交换层析和Superdux 75凝胶过滤层析方法对脱毒物质进行分离纯化,后经Tricine-SDS-PAGE和质谱鉴定初步确定是一种分子质量约27 ku的裂解酶。近年来,芽胞杆菌属菌株针对黄曲霉及黄曲霉毒素的研究主要集中在两个方面,一是菌株具有抑制黄曲霉及其孢子生长的能力,活性组分多是脂肽类物质等;二是菌株具有降解黄曲霉毒素的能力,活性组分通常是蛋白类酶等,受高温和蛋白酶K影响大。本试验筛选到的解淀粉芽胞杆菌Y1-B1能代谢产生降解AFB1的脱毒活性物质,后期试验发现该脱毒活性物质为一种胞外产物,其降解AFB1后的产物对LMH细胞的毒性作用显著降低,特别是该脱毒活性组分对高温和紫外线照射处理均表现出较强抵抗力,蛋白酶K对其脱毒能力影响有限,推测其可能是一种脂肽类物质或耐热酶类物质,这一结果与目前大多数研究不同,后期需进一步试验验证。
本试验筛选出的解淀粉芽胞杆菌可作为益生菌制剂直接添加到饲料中[39],既可以在粗放条件下高效降解毒素,又可以发挥益生菌的益生功能,解决了非安全菌株应用于毒素降解时工艺繁琐复杂、生产成本居高不下等问题,这是本试验的创新点。本研究为解决黄曲霉毒素污染问题提供了新的微生物种质资源,为后续开发脱霉制剂的产业化工艺奠定了基础。
4 结论以香豆素为唯一碳源进行初筛,通过测定对AFB1的降解能力进行复筛,成功筛选到1株能高效降解AFB1的菌株Y1-B1,降解率达86.1%。通过对Y1-B1菌株进行形态学、生理生化试验和16S rDNA序列分析,确定其为解淀粉芽胞杆菌(Bacillus amyloliquefaciens)。通过测定Y1-B1菌株各活性组分对AFB1的降解能力,确定其脱毒物质为一种胞外产物。细胞毒性试验发现,利用该活性组分降解AFB1后的产物对LMH细胞的毒性作用显著降低。对活性组分进行不同理化处理发现,其对高温、紫外线抵抗力较强,对强酸、强碱相对较差,蛋白酶K仅造成脱毒能力部分减弱。
| [1] | MOSALLAIE F, JOOYANDEH H, HOJJATI M, et al. Biological reduction of aflatoxin B1 in yogurt by probiotic strains of Lactobacillus acidophilus and Lactobacillus rhamnosus[J]. Food Sci Biotechnol, 2020, 29(6): 793–803. DOI: 10.1007/s10068-019-00722-5 |
| [2] | FRISVAD J C, HUBKA V, EZEKIEL C N, et al. Taxonomy of Aspergillus section Flavi and their production of aflatoxins, ochratoxins and other mycotoxins[J]. Stud Mycol, 2019, 93: 1–63. |
| [3] | GARCIA M V, PARUSSOLO G, MORO C B, et al. Fungi in spices and mycotoxigenic potential of some Aspergilli isolated[J]. Food Microbiol, 2018, 73: 93–98. DOI: 10.1016/j.fm.2018.01.013 |
| [4] | BLANCO-LIZARAZO C M, GAMBOA-MARIN A, VEGA S, et al. Assessment of dietary exposure to aflatoxin B1 from corn arepas in Colombia[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2019, 36(7): 1109–1117. DOI: 10.1080/19440049.2019.1615643 |
| [5] |
于正强, 陈瑾, 彭西, 等. 黄曲霉毒素B1对雏鸡免疫器官影响的病理学观察[J]. 畜牧兽医学报, 2015, 46(8): 1447–1454.
YU Z Q, CHEN J, PENG X, et al. Effect of aflatoxin B1 on pathological changes of immune organs in broilers[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(8): 1447–1454. (in Chinese) |
| [6] | WU L, LI J J, LI Y H, et al. Aflatoxin B1, Zearalenone and Deoxynivalenol in feed ingredients and complete feed from different province in China[J]. J Anim Sci Biotechnol, 2016, 7: 63. DOI: 10.1186/s40104-016-0122-8 |
| [7] | PLEADIN J, ZADRAVEC M, BRNIĆ D, et al. Moulds and mycotoxins detected in the regional speciality fermented sausage 'slavonski kulen' during a 1-year production period[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2017, 34(2): 282–290. |
| [8] | WANG G F, LIAN C, XI Y F, et al. Evaluation of nonionic surfactant modified montmorillonite as mycotoxins adsorbent for aflatoxin B1 and zearalenone[J]. J Colloid Interface Sci, 2018, 518: 48–56. DOI: 10.1016/j.jcis.2018.02.020 |
| [9] |
宫安东, 董飞燕, 吴楠楠, 等. 吡咯伯克霍尔德菌WY6-5产二甲基二硫对储藏期花生黄曲霉及毒素的抑制作用[J]. 中国农业科学, 2019, 52(17): 2972–2982.
GONG A D, DONG F Y, WU N N, et al. Inhibitory effect of dimethyl disulfide from Burkholderia pyrrocinia WY6-5 on Aspergillus flavus and aflatoxins in peanuts during storage period[J]. Scientia Agricultura Sinica, 2019, 52(17): 2972–2982. DOI: 10.3864/j.issn.0578-1752.2019.17.006 (in Chinese) |
| [10] | LI Y N, WANG R, CHEN Z X, et al. Preparation of magnetic mesoporous silica from rice husk for aflatoxin B1 removal: optimum process and adsorption mechanism[J]. PLoS One, 2020, 15(9): e0238837. DOI: 10.1371/journal.pone.0238837 |
| [11] |
计成, 贾如, 赵丽红. 基因工程技术在黄曲霉毒素生物降解中的应用[J]. 中国农业科学, 2017, 50(17): 3422–3428.
JI C, JIA R, ZHAO L H. Application of gene engineering technique in aflatoxin biodegradation[J]. Scientia Agricultura Sinica, 2017, 50(17): 3422–3428. DOI: 10.3864/j.issn.0578-1752.2017.17.016 (in Chinese) |
| [12] | MARTÍNEZ M P, PEREYRA M L G, JURI M G F, et al. Probiotic characteristics and aflatoxin B1 binding ability of Debaryomyces hansenii and Kazaschtania exigua from rainbow trout environment[J]. Aquacul Res, 2018, 49(4): 1588–1597. DOI: 10.1111/are.13614 |
| [13] | WANG L L, WU J, LIU Z W, et al. Aflatoxin B1 degradation and detoxification by Escherichia coli CG1061 isolated from chicken cecum[J]. Front Pharmacol, 2019, 9: 1548. DOI: 10.3389/fphar.2018.01548 |
| [14] | BOUKAEW S, PETLAMUL W, PRASERTSAN P. Efficacy of Streptomyces philanthi RL-1-178 culture filtrate against growth and aflatoxin B1 production by two aflatoxigenic fungi on maize seeds[J]. Eur J Plant Pathol, 2020, 156(4): 1041–1051. DOI: 10.1007/s10658-020-01955-5 |
| [15] | HORMISCH D, BROST I, KOHRING G W, et al. Mycobacterium fluoranthenivorans sp. nov., a fluoranthene and aflatoxin B1degrading bacterium from contaminated soil of a former coal gas plant[J]. Syst Appl Microbiol, 2004, 27(6): 653–660. DOI: 10.1078/0723202042369866 |
| [16] |
张舒月, 郑婧萱, 郭晓军, 等. 青贮用拮抗黄曲霉并降解黄曲霉毒素菌株的筛选与鉴定[J]. 中国饲料, 2018(3): 26–29.
ZHANG S Y, ZHENG J X, GUO X J, et al. Screening and identification of a strain antagonizing Aspergillus flavus and degrading aflatoxin for ensiling[J]. China Feed, 2018(3): 26–29. (in Chinese) |
| [17] |
布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 8版. 北京: 科学出版社, 1984: 729-758.
BUCHANAN R E, GIBBONS N E. Bergey's manual of determinative bacteriology[M]. Translation Group of Berger's Bacterial Identification Manual, Institute of Microbiology, Chinese Academy of Sciences, trans. 8th ed. Beijing: Science Press, 1984: 729-758. (in Chinese) |
| [18] |
东秀珠, 蔡妙英.
常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 43-48.
DONG X Z, CAI M Y. Manual for systematic identification of common bacteria[M]. Beijing: Science Press, 2001: 43-48. (in Chinese) |
| [19] |
曹凤明, 杨小红, 马鸣超, 等. 枯草芽孢杆菌近缘种群鉴定方法研究进展[J]. 微生物学通报, 2014, 41(5): 968–974.
CAO F M, YANG X H, MA M C, et al. Advances in the identification of Bacillus subtilis and closely related species[J]. Microbiology China, 2014, 41(5): 968–974. (in Chinese) |
| [20] | KIM S, LEE H, LEE S, et al. Invited review: Microbe-mediated aflatoxin decontamination of dairy products and feeds[J]. J Dairy Sci, 2017, 100(2): 871–880. DOI: 10.3168/jds.2016-11264 |
| [21] |
蔡俊, 田尔诺, 邵帅, 等. 黄曲霉毒素B1生物脱毒的研究进展[J]. 微生物学通报, 2017, 44(3): 726–731.
CAI J, TIAN E N, SHAO S, et al. Progress in biological detoxification of aflatoxin B1[J]. Microbiology China, 2017, 44(3): 726–731. (in Chinese) |
| [22] | WANG G F, MIAO Y S, SUN Z M, et al. Simultaneous adsorption of aflatoxin B1 and zearalenone by mono-and di-alkyl cationic surfactants modified montmorillonites[J]. J Colloid Interface Sci, 2018, 511: 67–76. DOI: 10.1016/j.jcis.2017.09.074 |
| [23] | WANG J Q, OGATA M, HIRAI H, et al. Detoxification of aflatoxin B1by manganese peroxidase from the white-rot fungus Phanerochaete sordida YK-624[J]. FEMS Microbiol Lett, 2011, 314(2): 164–169. DOI: 10.1111/j.1574-6968.2010.02158.x |
| [24] | SHCHERBAKOVA L, STATSYUK N, MIKITYUK O, et al. Aflatoxin B1degradation by metabolites of Phoma glomerata PG41 isolated from natural substrate colonized by aflatoxigenic Aspergillus flavus[J]. Jundishapur J Microbiol, 2015, 8(1): e24324. |
| [25] | ZHANG W, XUE B B, LI M M, et al. Screening a strain of Aspergillus niger and optimization of fermentation conditions for degradation of aflatoxin B1[J]. Toxins(Basel), 2014, 6(11): 3157–3172. |
| [26] | ALBERTS J F, ENGELBRECHT Y, STEYN P S, et al. Biological degradation of aflatoxin B1by Rhodococcus erythropolis cultures[J]. Int J Food Microbiol, 2006, 109(1-2): 121–126. DOI: 10.1016/j.ijfoodmicro.2006.01.019 |
| [27] | ADEBO O A, NJOBEH P B, SIDU S, et al. Aflatoxin B1degradation by liquid cultures and lysates of three bacterial strains[J]. Int J Food Microbiol, 2016, 233: 11–19. DOI: 10.1016/j.ijfoodmicro.2016.06.007 |
| [28] | ADEBO O A, NJOBEH P B, GBASHI S, et al. Review on microbial degradation of aflatoxins[J]. Crit Rev Food Sci Nutr, 2017, 57(15): 3208–3217. DOI: 10.1080/10408398.2015.1106440 |
| [29] | VERHEECKE C, LIBOZ T, MATHIEU F. Microbial degradation of aflatoxin B1: current status and future advances[J]. Int J Food Microbiol, 2016, 237: 1–9. DOI: 10.1016/j.ijfoodmicro.2016.07.028 |
| [30] | ARREBOLA E, JACOBS R, KORSTEN L. Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens[J]. J Appl Microbiol, 2010, 108(2): 386–395. DOI: 10.1111/j.1365-2672.2009.04438.x |
| [31] | MOYNE A L, SHELBY R, CLEVELAND T E, et al. Bacillomycin D: an iturin with antifungal activity against Aspergillus flavus[J]. J Appl Microbiol, 2001, 90(4): 622–629. DOI: 10.1046/j.1365-2672.2001.01290.x |
| [32] | REDDY K R N, REDDY C S, MURALIDHARAN K. Potential of botanicals and biocontrol agents on growth and aflatoxin production by Aspergillus flavus infecting rice grains[J]. Food Control, 2008, 20(2): 173–178. |
| [33] |
王英国, 王军华, 权春善, 等. 解淀粉芽孢杆菌抗菌活性物质的分离纯化及抑菌活性研究[J]. 中国生物工程杂志, 2007, 27(12): 41–45.
WANG Y G, WANG J H, QUAN C S, et al. Purification and antifungal characterization of an antifungal substance from Bacillus amyloliquifaciens[J]. China Biotechnology, 2007, 27(12): 41–45. (in Chinese) |
| [34] | FARZANEH M, SHI Z Q, GHASSEMPOUR A, et al. Aflatoxin B1degradation by Bacillus subtilis UTBSP1 isolated from pistachio nuts of Iran[J]. Food Control, 2012, 23(1): 100–106. |
| [35] | FARZANEH M, SHI Z Q, AHMADZADEH M, et al. Inhibition of the Aspergillus flavus growth and aflatoxin B1 contamination on pistachio nut by fengycin and surfactin-producing Bacillus subtilis UTBSP1[J]. Plant Pathol J, 2016, 32(3): 209–215. |
| [36] |
关心. 黄曲霉毒素B1降解菌株的筛选鉴定、降解优化与特性研究[D]. 沈阳: 沈阳农业大学, 2016: 54-57.
GUAN X. Isolation, identification, optimization and characteristics of an aflatoxin B1-degrading strain[D]. Shenyang: Shenyang Agricultural University, 2016: 54-57. (in Chinese) |
| [37] |
王佳伟, 宋根娣, 杨瑞先, 等. 堆肥土壤中黄曲霉毒素降解菌株的筛选及活性分析[J]. 中国饲料, 2018(23): 18–23.
WANG J W, SONG G D, YANG R X, et al. Isolation and analysis of aflatoxin degrading bacterial strain from compost soil[J]. China Feed, 2018(23): 18–23. (in Chinese) |
| [38] |
蔡国林, 徐铭乾, 李秋, 等. 解淀粉芽孢杆菌黄曲霉毒素B1裂解酶的分离纯化及鉴定[J]. 食品与发酵工业, 2015, 41(12): 26–30, 35.
CAI G L, XU M Q, LI Q, et al. Purification and identification of AFB1 lytic enzyme from Bacillus amyloliquefaciens[J]. Food and Fermentation Industries, 2015, 41(12): 26–30, 35. (in Chinese) |
| [39] |
张娟, 杨彩梅, 曹广添, 等. 解淀粉芽孢杆菌及其作为益生菌的应用[J]. 动物营养学报, 2014, 26(4): 863–867.
ZHANG J, YANG C M, CAO G T, et al. Bacillus amyloliquefaciens and its application as a probiotic[J]. Chinese Journal of Animal Nutrition, 2014, 26(4): 863–867. (in Chinese) |



