口蹄疫(foot-and-mouth disease, FMD)是一种高度接触性传染病,在全世界广泛流行,严重影响了畜牧业发展,造成了巨大的经济损失[1-2]。口蹄疫病毒(FMDV)有O、A、C、SAT1、SAT2、SAT3、Asia1型7种血清型,且各血清型之间无交叉保护性,因此,对不同血清型的快速鉴别诊断可以有效预防和控制口蹄疫[3-5]。同时,在口蹄疫长期流行的地区,确定流行区血清型对于接种疫苗的选择以及追踪传染源至关重要[6]。接种口蹄疫疫苗是预防口蹄疫暴发的最有效措施。近年来,在中国流行的口蹄疫病毒为O、A血清型,针对这一流行情况,在疾病的流行地区主要免疫的为单一血清型的灭活疫苗或O型、A型双价灭活疫苗。为了保证动物得到有效的免疫接种,在生产中应该严格控制疫苗质量[7-9]。目前,世界动物卫生组织(OIE)规定的生产毒种和疫苗的效力检验是通过在动物体内进行攻毒保护试验,计算疫苗的PD50完成,此方法是最为可靠评价疫苗效力的方法,有较高的生物安全要求[10-11]。但对于不同批次,不同阶段生产细胞毒的有效抗原含量评价,使用此方法会消耗大量的人力、物力和时间,检验成本巨大,效率低,无法满足现实生产中间产品、成品的快速检验的需求。为了解决这一问题,许多生产企业已经衍生出许多体外检测疫苗中间品和成品中有效抗原含量的方法。
蔗糖密度梯度(sucrose density gradient, SDG)法是其中比较常见的一种。它根据沉降系数将FMDV分为146S、75S、45S和12S。完整的病毒颗粒146S具有较强的免疫原性,并且是病毒颗粒中的主要免疫原,因此,在疫苗生产中将146S含量的检测作为检测疫苗效力的重要指标[12-14]。但该方法不能同时检测多价疫苗中各血清型病毒的146S含量,操作程序繁琐,需要昂贵的超速离心机,检测时间较长[15]。近期较为新颖的排阻高效液相色谱法,利用抗原分子量大小分析疫苗制剂中146S的含量,但仍需要配备专项设备及专业技术人员,检测成本较高[16]。用多抗、单抗、单域抗体等材料构建的ELISA方法可以检测FMDV不同血清型的146S含量[17-19],虽然有些方法敏感性较高,但特异性较差,与12S有交叉反应[20],或者与疫苗效力检验和SDG两种方法的相关性不够高[17]。此外,敏感性较高的荧光定量RT-PCR可以检测细胞毒或疫苗中的病毒基因数量,但不能保证检测到的是完整的病毒颗粒,而且操作不当会产生一定的误差[21-22]。虽然ELISA、RT-qPCR等方法大大缩短检测的时间,操作相对简化,但中间产品留观时间有限,仍需要更为简便快捷的方法来检测疫苗中的146S含量,提高疫苗生产效率。
免疫层析检测技术(immunochromatographic assay, ICA)是一种经典的即时检测技术,基于抗体和抗原之间的免疫反应,它可以快速、简单地检测目标抗原或抗体。目前,免疫层析技术通过与试纸条读数仪的结合,可以定量检测目标抗原,并且特异性好,敏感性与ELISA可达到同一数量级[23-26]。已经有报道的关于口蹄疫病毒的免疫层析检测方法,但仅限于抗原的鉴别诊断[27]。同时,对疫苗使用者来说,快速、准确测定口蹄疫病毒灭活疫苗中的病毒含量,对筛选有效的口蹄疫防疫疫苗具有实际的应用价值。
本研究中,作者建立了一种基于胶体金免疫层析技术的口蹄疫病毒定量检测方法,利用特异性抗体制备出可以分别检测FMDV O、A、Asia 1型病毒的胶体金检测试纸卡,通过检测已知146S含量的病毒拟合出标准曲线,评价建立方法的灵敏度。本研究建立的方法不仅可以鉴别诊断FMDV O、A、Asia 1型病毒,还可以定量检测病毒中146S含量,为疾病的预防和监测,以及疫苗生产中的质量控制提供快速、准确、廉价的检测方法。
1 材料与方法 1.1 试剂及材料牛血清白蛋白(BSA)、三水合四氯金酸(Merk, USA)、柠檬酸三钠、碳酸钾等化学试剂均为国产分析纯,NC膜、玻璃纤维、PVC背衬板(上海捷宁生物科技有限公司)。
口蹄疫O、A、Asia 1型灭活细胞毒,其毒株分别为O/Mya98/BY/2010,AF/72,Asia 1/JSL,口蹄疫O型、A型二价灭活疫苗(Re-O/Mya98/JSCJ/2013株+Re-A/WH/09株),口蹄疫O型灭活疫苗(O/Mya98/JSCJ/2010株),由中农威特生物科技股份有限公司提供。口蹄疫O、A型灭活乳鼠毒、水疱液等组织毒,毒株分别为O/Mya98、O/CATHAY、O/Ind/2001、O/PanAsia、A/Sea/97,由兰州兽医研究所口蹄疫参考实验室提供。塞内卡病毒A型(SVA)、猪水疱病病毒(SVDV)、猪水疱性口炎病毒(VSV)灭活培养物,为本实验室保存。
1.2 设备Sorvall WX100超速离离心机(Thermo Scientific,USA),Pharmacia FPLC纯化系统(Merk,USA),HiTrap Protein A HP亲和层析柱(GE,Sweden),紫外分光光度计(北京普析通用仪器有限公司),三维平面点膜喷金仪(Biodot,USA),试纸条切条机(上海韩感电子科技有限公司),金标条阅读仪(杭州奥盛仪器有限责任公司)
1.3 抗原筛选1.3.1 抗原制备 选取口蹄疫O型疫苗毒株O/Mya98/BY/2010、O/GX/09-7、Re-O/Mya98/JSCZ/2013、O/PanAsia/TZ/2011,口蹄疫A型疫苗毒株Re-A/WH/09、AF/72,将以上毒株灭活后作为检测用抗原。
1.3.2 抗原反应性鉴定1.3.2.1 间接ELISA方法的建立 将以上几种抗原分别用0.05 mol·L-1碳酸盐缓冲液(pH9.6)稀释到0.5 mg·L-1的浓度,以100 μL·孔-1包被酶标板,PBST洗涤3次。加入0.1% BSA封闭液300 μL·孔-1,37 ℃封闭1 h后PBST洗涤。待检血清[口蹄疫O、A型病毒不同毒株(详见“1.3.1”)抗体阳性血清]、阳性[口蹄疫O型病毒(O/Mya98)高免血清]和阴性对照血清(口蹄疫抗体阴性血清)按照1∶50稀释,100 μL·孔-1,60 min后PBST同上洗涤。最适稀释度的酶标二抗(HRP标记兔抗猪IgG抗体)100 μL·孔-1,45 min后PBST同上洗涤。加入TMB底物显色,100 μL·孔-1,10 min后加入终止液100 μL ·孔-1终止反应,酶标仪读取OD450 nm值。判定标准:血清样本抗体效价(S/P)=(OD450 nm样品-OD450 nm阴性)/(OD450 nm阳性-OD450 nm阴性),当效价≥0.30,判定为阳性;效价 < 0.25,判定为阴性。效价0.25~0.30间判为可疑,两次可疑结果判定为阴性。
1.3.2.2 间接ELISA检测不同抗原反应性 通过建立不同毒株为诊断抗原的间接ELISA,分别检测40份口蹄疫O型不同毒株免疫血清,及60份口蹄疫A型不同毒株免疫血清。根据阳性检出率确定不同毒株抗原的反应性,选择反应性最好的抗原作为免疫层析方法诊断抗原。
1.4 标准品的制备1.4.1 纯净性检测 采用多重实时荧光RT-PCR方法[28],检测每种灭活口蹄疫病毒的血清型,选择只含单一血清型的纯净细胞毒作为标准品。
1.4.2 标准品抗原含量的检测 分别将口蹄疫病毒O、A、Asia 1型灭活细胞毒反复冻融3次后4 ℃ 8 000 r·min-1离心10 min,收集上清,加入2倍体积三氯乙烯充分震荡混匀后4 ℃ 10 000 r·min-1离心20 min,收集上层液体。将收集的液体4 ℃ 30 000 r·min-1离心3 h后弃去上清,将沉淀用NET缓冲液(100 mmol·L-1 NaCl,1 mmol·L-1 EDTA,50 mmol·L-1 Tris-HCl)悬浮后充分研磨。研磨后的浓缩抗原采用蔗糖密度梯度法纯化病毒146S[15]。在离心管中依次加入50%~10%蔗糖溶液,制成蔗糖密度梯度柱。将浓缩病毒抗原液加入蔗糖梯度柱顶部,4 ℃,35 000 r·min-1离心2.5 h。以0.5 mL作为1个收集级分,依次从上到下逐层收集并编号。分别收集所有级分,采用紫外分光光度计测定OD259 nm并确定146S的含量,将OD259 nm大于0.5的层级合并,作为有效抗原4 ℃保存备用。
1.5 定量试纸卡制备1.5.1 口蹄疫病毒多抗制备 按照“1.4.2”中方法分别浓缩O型、A型、Asia 1型口蹄疫病毒中的有效抗原,在浓缩抗原加入弗氏佐剂混匀,制成油乳剂,免疫家兔及豚鼠,采集动物免疫血清。
将HiTrap Protein A亲和层析柱安装至Pharmacia FPLC纯化系统,按操作流程纯化豚鼠及兔血清,作为口蹄疫病毒豚鼠抗及兔抗,纯化后的抗体用紫外分光光度计确定抗体含量。
1.5.2 抗体的标记 按照文献中方法制备胶体金溶液[29]。用0.2 mol·L-1的K2CO3溶液,将5 mL胶体金溶液调整至标记最适pH,之后加入最佳标记量的纯化兔抗,搅拌30 min,在胶体金溶液中加入终浓度为1% BSA,搅拌30 min,10 000 r·min-1离心30 min,去上清,所得沉淀溶解于0.25 mL胶体金缓冲液中,置于4 ℃保存。
1.5.3 NC膜上的口蹄疫豚鼠抗包被浓度筛选 将纯化豚鼠抗稀释为不同浓度,分别将每个浓度的豚鼠抗作为检测带用点膜喷金仪喷涂于NC膜上(1 μL·cm-1),同时,将羊抗兔IgG稀释至0.5 mg·mL-1,喷涂在NC膜上作为质控带,喷涂完成后将NC膜置于37 ℃干燥1 h,4 ℃干燥保存。将包被了不同浓度豚鼠抗的NC膜组装成试纸卡来检测口蹄疫O型、A型、Asia 1型病毒标准品,每份样品检测3次,比较试纸卡检测同种血清型与其他两种血清型样品的T/C差值,选择差值最大时对应的豚鼠抗浓度作为最适包被浓度。
1.5.4 试纸卡组装 标记好抗体的胶体金溶液喷涂于玻璃纤维上作为金标垫(conjugate pad),37 ℃干燥1 h,4 ℃干燥保存。将金标垫、样品垫(sample pad)、NC膜(NC membrane)、和吸收垫(absorb pad)粘贴在PVC背衬板上,然后装入卡壳中,如图 1所示。
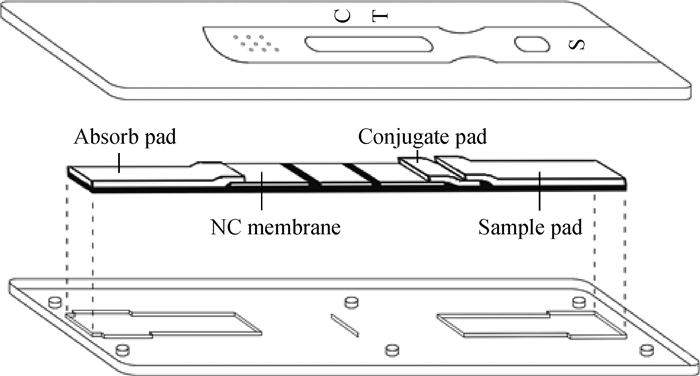
|
图 1 试纸卡示意图 Fig. 1 Schematic diagram of test paper card |
1.5.5 试纸卡的使用 在试纸卡加样区(图 1中“S”处)加入处理好的待测样品,之后立即加入样品稀释液(0.01 mol·L-1, pH7.4磷酸盐缓冲液),水平静置反应15 min后放置于金标条读数仪中,试纸卡上胶体金颗粒吸收仪器内绿色光,光信号通过CMSO图像传感器形成图像,根据图像上显示的检测带与质控带峰值面积计算出检测样品T/C值。
1.6 样品处理方法1.6.1 样品前处理 将正丁醇与4倍体积的油乳剂灭活疫苗充分混匀,4 ℃,3 000 r·min-1离心10 min,离心后的最下层的病毒抗原作为待检样品,置于4 ℃备用。灭活乳鼠毒4 ℃,3 000 r·min-1离心10 min,取上清作为待检样品,4 ℃保存备用。水疱液、灭活细胞毒可直接作为待检样品。
1.6.2 稀释倍数配伍试验 分别将不同体积的标准品(口蹄疫O、A、Asia 1型口蹄疫灭活细胞病毒)、口蹄疫O型、A型二价灭活疫苗与样品稀释液组合配对(表 1),试纸卡的总载样量为90 μL,将处理好的样品滴加在试纸卡上,检测样品在不同稀释倍数下的T/C值。
|
|
表 1 样品及稀释液的配伍组合 Table 1 The combination of samples and dilution buffer |
1.7.1 定量阈值 取空白对照(样品稀释液),BHK-21细胞培养物5份,健康乳鼠组织研磨液上清5份,每份样品检测3次(n=33)。此外,每种血清型试纸卡分别检测其他两种异型灭活细胞毒各3份,每份检测3次(n=18)。将空白对照及阴性样品T/C平均值+10个标准差作为定量阈值。
1.7.2 定量标准曲线 将标准品倍比稀释,分别将每个稀释度的样品将制备好的试纸卡平行检测3次,检测所得的样品T/C值,结合其相应的抗原含量,拟合出标准曲线。将标准品倍比稀释,分别将每个稀释度的样品用制备好的试纸卡检测3次,根据测得的T/C值与已知的病毒有效含量,拟合出定量标准曲线。
1.8 检测方法评价1.8.1 特异性检测 分别取制备好的FMDV O、A、Asia 1型试纸卡检测SVA、SVDV、VSV灭活培养物,此外,用每种试纸卡检测每种血清型灭活病毒、灭活乳鼠毒、水疱液及灭活疫苗。每份样品检测3次,检测后所得T/C平均值减去定量阈值,所得数值>0,判定为阳性,所得数值<0,判定为阴性。
1.8.2 与SDG方法检测结果比较 分别选取口蹄疫O型、A型、Asia 1型灭活细胞毒各10份,用已经建立的试纸卡检测方法检测所有样品中的FMDV 146S含量,每份样品检测3次,取3次检测的平均值与传统的SDG方法检测结果进行比较。
1.8.3 重复性试验 分别将口蹄疫O、A、Asia 1型灭活病毒标准品倍比稀释至24倍,分别用试纸卡将每个稀释度的样品检测3次,确定建立方法的重复性。
1.9 符合性试验1.9.1 符合性试验 用已经建立的试纸卡检测方法分别检测口蹄疫O、A、Asia 1型灭活乳鼠毒,共18份,以及由多重实时荧光RT-PCR方法确定的口蹄疫田间样本38份,含水疱液共15份,水疱皮18份,扁桃体及淋巴结5份。试纸卡检测样品后所得T/C值减去定量阈值,所得数值>0,判定为阳性,所得数值<0,判定为阴性。通过对已知血清型的样品检出数来评价试纸条的符合率。
1.9.2 不同毒株待检样品的敏感性检测 将“1.9.1”中的检测样品以及O型、A型、Asia 1型灭活细胞毒各10份用已经建立的试纸卡检测方法检测所有样品中的FMDV 146S含量,根据每种毒株的阳性检出率来确定对同血清型不同毒株的敏感性。
2 结果 2.1 不同抗原反应性比较用口蹄疫O型疫苗毒株O/Mya98/BY/2010、O/GX/09-7、Re-O/MYA98/JSCZ/2013、O/PanAsia/TZ/2011,口蹄疫A型疫苗毒株Re-A/WH/09、AF/72建立的间接ELISA方法分别检测40份口蹄疫O型免疫血清及60份口蹄疫A型免疫血清,检测结果见表 2。4种口蹄疫O型毒株对O型免疫血清的检出率不同,其中,O/Mya98/BY/2010做诊断抗原对不同毒株的阳性检出率最高,为92.5%,敏感性高。2种口蹄疫A型毒株中,对A型不同毒株免疫血清的检出率较高的为AF/72株,阳性检出率90%。因此,选择敏感性高的O/Mya98/BY/2010及AF/72分别作为诊断抗原毒株。
|
|
表 2 不同诊断抗原的抗体阳性检出率 Table 2 Positive detection rate of antibodies for different diagnostic antigens |
2.2.1 标准品特异性 用多重实时荧光RT-PCR分别检测口蹄疫O型、A型、Asia 1型灭活细胞毒,每种灭活细胞毒均为纯净细胞毒,无其他血清型病毒核酸。
2.2.2 标准抗原含量检测 浓缩后的抗原分布在蔗糖柱的各个级分,各级分在259 nm处的光吸收值如图 2所示。得到的口蹄疫O型、A型、Asia 1型灭活细胞毒标准品中有效抗原146S的含量分别为53.87、64.00、58.72 μg·mL-1。
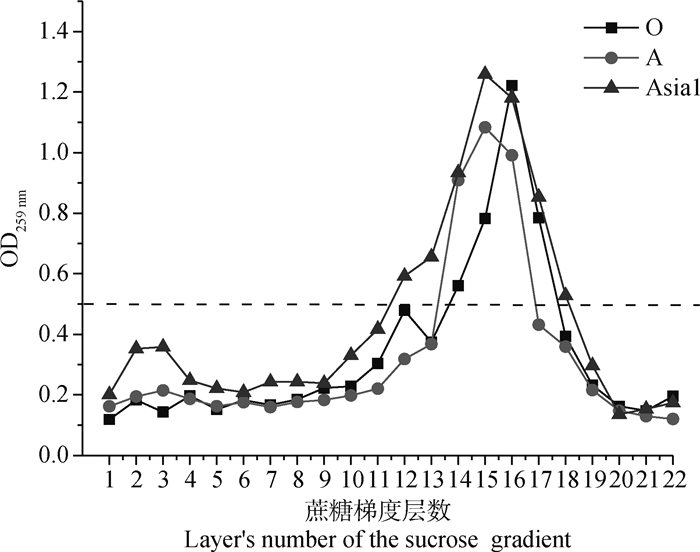
|
图 2 O型、A型、Asia 1型口蹄疫病毒各级分146S OD259nm Fig. 2 The OD259nm values of FMDV 146S with all fractions |
当NC膜上的O型豚鼠抗浓度为0.393 μg·mL-1时,试纸卡检测O型标准品的T/C值与其他两种血清型标准品的差值最大,作为最佳包被浓度。当NC膜上的A型豚鼠抗浓度为0.654 μg·mL-1时,试纸卡检测A型标准品的T/C值与与其他两种血清型标准品的差值最大,为最佳包被浓度。当NC膜上的Asia 1型豚鼠抗浓度为0.743 μg·mL-1时,试纸卡检测Asia 1型标准品的T/C值与与其他两种血清型标准品的差值最大,为最佳包被浓度(图 3)。
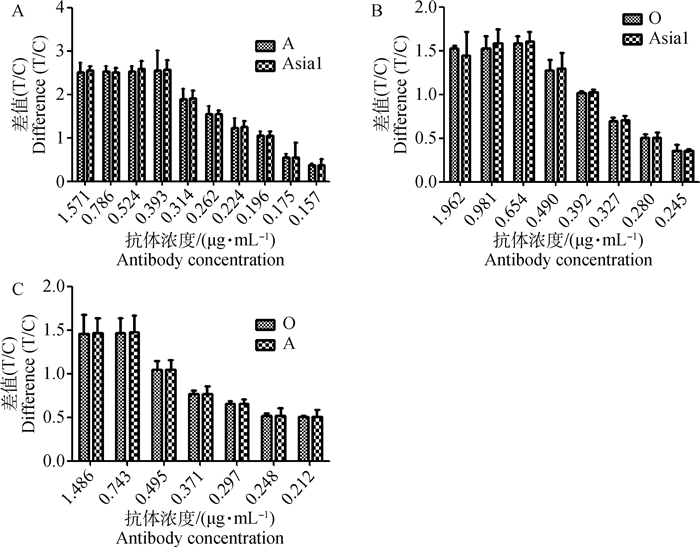
|
A. FMDV-O型试纸卡检测O型及灭活抗原所得T/C值与A型、Asia1型灭活抗原的差值;B. FMDV-A型试纸卡检测A型及灭活抗原所得T/C值与O型、Asia1型灭活抗原的差值;C. FMDV-Asia 1型试纸卡检测Asia 1型及灭活抗原所得T/C值与O型、A型灭活抗原的差值 A. Difference of T/C value with inactivated antigen of serotype O vs. serotype A and Asia 1 by FMDV-O ICA; B. Difference of T/C value with inactivated antigen of serotyps A vs. serotype O and Asia 1 by FMDV-A ICA; C. Difference of T/C value with inactivated antigen of serotypes Asia 1 vs. serotype O and A by FMDV-Asia 1 ICA 图 3 NC膜上包被不同浓度抗体试纸卡检测结果 Fig. 3 Results of ICA with different antibody concentrations on the NC membrane |
根据表 1中的不同稀释比例检测阳性灭活细胞毒及灭活疫苗,在待检样品为20 μL,样品稀释液为70 μL时,试纸卡检测阳性灭活细胞毒及疫苗所得的T/C值最大(图 4),为最佳的检测方式。
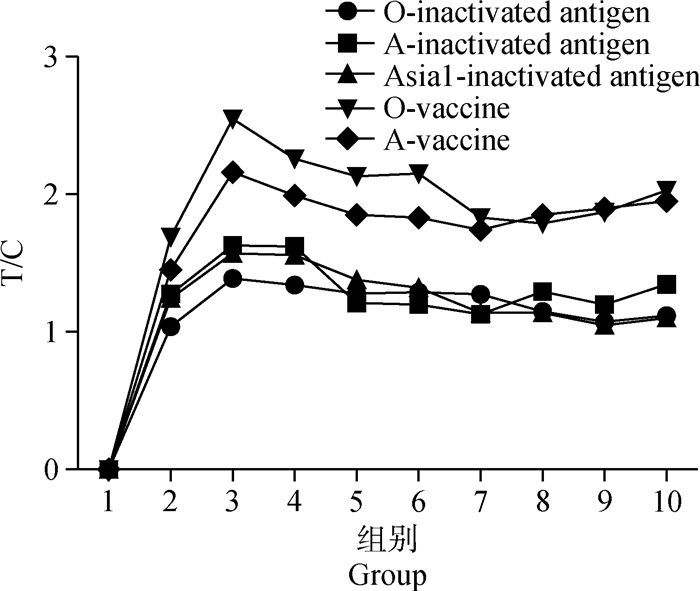
|
图 4 不同稀释倍数样品检测结果 Fig. 4 The results of samples with different volume multiples |
用FMDV-O型试纸卡检测空白对照、O型及A型标准品,T/C平均值为0.033,标准差(s)为0.028,阈值为0.303。用FMDV-A型试纸卡检测空白对照,O型及Asia 1型标准品,T/C平均值为0.025,s为0.021,阈值为0.23。用FMDV- Asia 1型试纸卡检测空白对照,O型及A型标准品,T/C平均值为0.015,s为0.009,阈值为0.095。根据标准品拟合出的标准曲线(图 5),O、A、Asia 1型试纸卡的标准曲线的线性相关系数(R2)分别为0.972、0.973、0.977。在标准曲线的线性范围内,由定量曲线公式可得,口蹄疫O、A、Asia 1型试纸卡的定量最低限值分别为0.567、0.693、0.219 μg·mL-1。
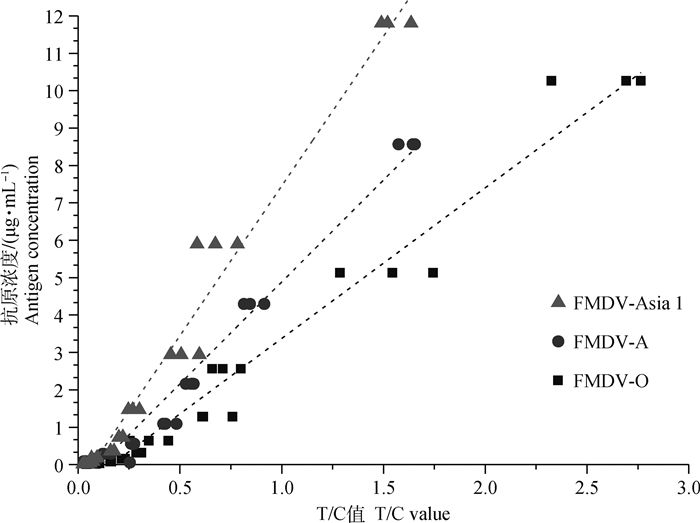
|
图 5 口蹄疫病毒O型、A型、Asia 1型免疫层析试纸卡定量标准曲线 Fig. 5 Linear standard curve of ICA of serotypes O, A and Asia 1 |
分别用O、A、Asia 1型试纸卡检测SVA、SVDV、VDV均为阴性结果,每种血清型试纸卡检测其他血清型的灭活细胞毒、灭活乳鼠毒、水泡液及灭活疫苗,结果均为阴性,3种试纸卡之间无交叉反应(图 6)。
|
x轴代表不同的样品,y轴代表对应样品所测得的T/C值与定量阈值之差 The x-axis refers to the different samples; the y-axis refers to the difference between T/C value with corresponding virus samples and quantitative threshold 图 6 每种血清型试纸条特异性检测结果 Fig. 6 Specificity of each chromatographic strips |
每种血清型的试纸卡分别检测相应血清型的10份样品,与SDG法检测结果进行相关性分析。3种血清型的试纸卡与SDG检测结果的相关性均高于0.9(图 7),说明两种方法的相关性良好。
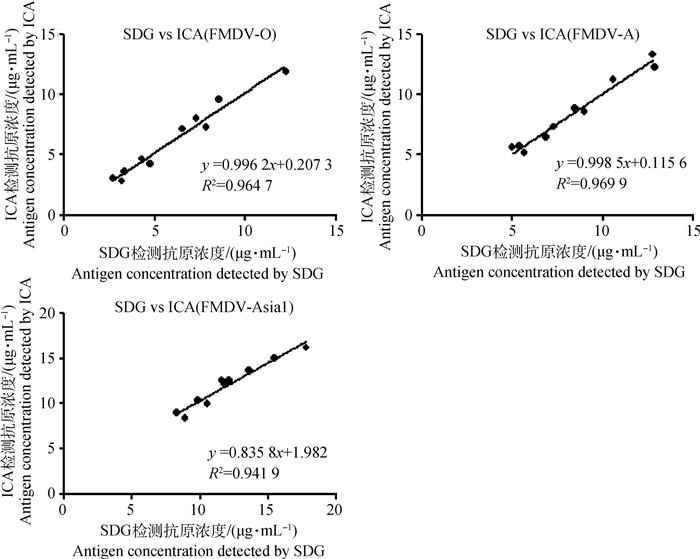
|
图 7 ICA与SDG检测结果相关性分析 Fig. 7 Correlation between the ICA and SDG |
口蹄疫病毒O型试纸卡检测5份不同稀释度的O型灭活病毒标准品,每份样品检测3次,检测结果的变异系数(CV)为9.6%;口蹄疫病毒A型试纸卡检测5份不同稀释度的A型灭活病毒标准品,每份样品检测3次,检测结果的CV为4.7%;口蹄疫病毒Asia 1型试纸卡检测5份不同稀释度的Asia 1型灭活病毒标准品,每份样品检测3次,检测结果的CV为9.8%。建立的O、A、Asia 1型口蹄疫病毒胶体金定量检测免疫层析方法重复性良好。
2.9 符合性试验2.9.1 待检样品符合率 检测18份口蹄疫灭活乳鼠毒样本及38份田间样本,共56份, 由表 3可知,口蹄疫O型、A型、Asia 1型样品的符合率分别为84.21%、66.67%、100%,样品总符合率为80.36%。
|
|
表 3 符合性试验 Table 3 Consistence rate of ICA |
2.9.2 不同毒株的待检样品检测结果 分别用制备好的口蹄疫O型、A型、Asia1型定量检测试纸卡检测同血清型不同毒株的样品,如图 8所示,O型试纸卡检测毒株O/Mya98、O/CATHAY、O/Ind/2001、O/PanAsia、A/Sea/97的阳性检出率分别为95%、70%、90%、87.5%,A型试纸卡检测毒株A/Sea/97、AF/72的阳性检出率分别为60%、85%,Asia 1型试纸卡检测毒株Asia1/JSL的阳性检出率为100%。
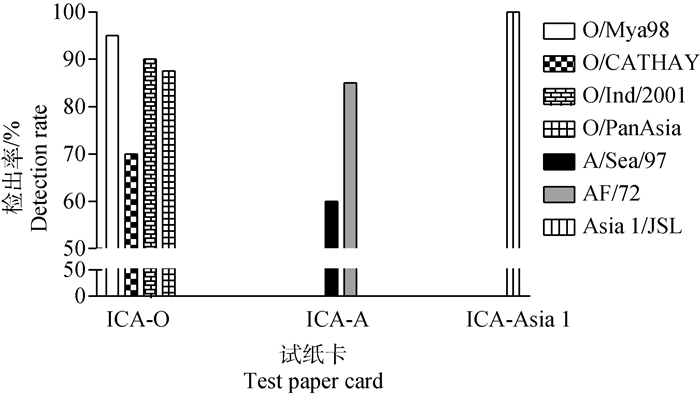
|
图 8 O型、A型、Asia 1型试纸卡不同毒株阳性检出率 Fig. 8 The positive detection rate of lateral flow assay of FMDV-O, FMDV-A and FMDV-Asia 1 |
2010—2016年,中国地区流行的口蹄疫病毒血清型主要为O型及A型[1-2],Asia 1型口蹄疫病毒曾在2005—2008年暴发过[30-33],但近年来,由于政府采取了一系列控制措施,包括强制性常规疫苗接种,该血清型已经无任何感染的病例,因此,在生产养殖中已不将Asia 1型疫苗的免疫作为重点,但会密切地监测Asia 1型病毒的流行情况。本研究中设计了O、A、Asia 1 3种血清型的即时检测方法,这3种血清型在国内都有过长期和大面积的暴发,作为检测技术应有全面评价并进行技术储备,研究过程并没有剔除Asia 1型。虽然缺乏Asia 1型疫苗样品,但通过使用灭活细胞病毒及乳鼠传代毒的检测,并与其他两种血清型疫苗定量结果的平行分析,依然获得较为真实可信的结果。
传统的SDG方法只是单纯地检测出病毒的146S含量,而当检测口蹄疫O、A双价苗时,并不能同时检测出其中每种血清型的病毒146S含量。试验显示:本研究中建立的胶体金免疫层析检测方法,不仅可以检测多价苗中每种血清型病毒146S的含量,而且检测单一血清型的灭活细胞毒或者疫苗与SGD的检测结果具有高度一致性,因此,可以作为替代SDG的方法来定量检测病毒146S的含量。SDG方法所需样本的体积量大,对于某些样品,如灭活乳鼠毒等,因样本量少而无法用SDG方法进行定量,因此在分析本研究建立的方法灵敏度时,不做相关性分析,而是与样品背景进行复核,定性比较。
对于定量胶体金层析快速检测方法,NC膜上检测带抗体的浓度的选择尤其重要,适宜的抗体浓度要保证检测的敏感性,也要避免假阳性结果。在试验中,选择最适抗体浓度包被NC膜检测带,通过对标准品检测,当二者T/C值的差值最大时,证实试纸卡特异性最佳,同时在保证特异性的前提下,选择检测阳性样品T/C值最高时的抗体包被最低浓度为最适包被浓度。
在样品处理上,对于灭活细胞毒可直接将样品滴加在加样孔中,但对于疫苗样品,由于疫苗破乳、离心后的抗原成分在最下层,在吸取抗原时容易带入油脂或正丁醇等杂质,影响检测结果,筛选了适宜的样品稀释液,确定最佳稀释倍数,使得抗原抗体充分反应,最大程度减少杂质的影响,提高了检测结果的灵敏度。
本研究中,为了确定检测样品的最高限值,选择浓缩后的病毒抗原作为检测样品,将浓缩抗原稀释为不同的浓度后检测,通过Bland-Altman法分析与SDG检测结果的一致性,选择与SDG结果一致的最高浓度作为检测方法的最高检测限。此外,经过不同样本的验证,检测结果均在本研究建立方法的定量范围内。
本方法在设计之初主要针对灭活抗原和疫苗有效抗原含量进行评价,对于其他病毒样品(包括水疱皮、水疱液、感染组织等)也进行了检测,对病毒含量较高水疱液和新鲜疱皮均可以直接判定血清型别,但对OP液、扁桃体等样品敏感性稍低。由于组织样品的定量分析,在实际应用中无需求,田间样品的快速定性使该方法具有更广阔的应用市场。
4 结论建立了口蹄疫O、A、Asia1型病毒胶体金免疫层析定量检测试纸卡方法,可以用于口蹄疫病毒抗原快速鉴别、血清分型与146S定量检测。
| [1] | CHEN J H, WANG J Y, WANG M J, et al. Retrospect and risk analysis of foot-and-mouth disease in China based on integrated surveillance and spatial analysis tools[J]. Front Vet Sci, 2019, 6: 511. |
| [2] | AZEEM A, RASHID I, HASSAN M M, et al. A review on foot and mouth disease in dairy animals, etiology, pathogenesis and clinical findings[J]. Pure Appl Biol, 2020, 9(1): 821–832. |
| [3] | https://www.oie.int/fileadmin/Home/eng/Health_standards/tahm/3.01.08_FMD.pdf. |
| [4] | BRITO B P, RODRIGUEZ L L, HAMMOND J M, et al. Review of the global distribution of foot-and-mouth disease virus from 2007 to 2014[J]. Transbound Emerg Dis, 2017, 64(2): 316–332. DOI: 10.1111/tbed.12373 |
| [5] | MA J, XIAO J H, GAO X, et al. Spatial pattern of foot-and-mouth disease in animals in China, 2010-2016[J]. PeerJ, 2017, 5(1): e4193. |
| [6] | DING Y Z, CHEN H T, ZHANG J, et al. An overview of control strategy and diagnostic technology for foot-and-mouth disease in China[J]. Virol J, 2013, 10(1): 78. DOI: 10.1186/1743-422X-10-78 |
| [7] | MAHAPATRA M, PARIDA S. Foot and mouth disease vaccine strain selection: current approaches and future perspectives[J]. Exp Rev Vac, 2018, 17(7): 577–591. DOI: 10.1080/14760584.2018.1492378 |
| [8] | ZHANG K S, LU B Z, LIU H, et al. Adverse effects of inactivated foot-and-mouth disease vaccine—Possible causes analysis and countermeasures[J]. World J Vac, 2018, 8(4): 81–88. DOI: 10.4236/wjv.2018.84007 |
| [9] | JAMAL S M, BELSHAM G J. Foot-and-mouth disease: past, present and future[J]. Vet Res, 2013, 44(1): 116. DOI: 10.1186/1297-9716-44-116 |
| [10] | YOU S H, JO H E, CHOI J H, et al. Evaluation of novel inactivated vaccine for type C foot-and-mouth disease in cattle and pigs[J]. Vet Microbiol, 2019, 234: 44–50. DOI: 10.1016/j.vetmic.2019.05.016 |
| [11] | CHEN J, YU X M, ZHENG Q S, et al. The immunopotentiator CVC1302 enhances immune efficacy and protective ability of foot-and-mouth disease virus vaccine in pigs[J]. Vaccine, 2018, 36(52): 7929–7935. DOI: 10.1016/j.vaccine.2018.11.012 |
| [12] | DOEL T R, CHONG W K T. Comparative immunogenicity of 146S, 75S and 12S particles of foot-and-mouth disease virus[J]. Arch Virol, 1982, 73(2): 185–191. DOI: 10.1007/BF01314726 |
| [13] | DOEL T R, PULLEN L. International bank for foot-and-mouth disease vaccine: stability studies with virus concentrates and vaccines prepared from them[J]. Vaccine, 1990, 8(5): 473–478. DOI: 10.1016/0264-410X(90)90249-L |
| [14] | PAY T W F, HINGLEY P J. Correlation of 140S antigen dose with the serum neutralizing antibody response and the level of protection induced in cattle by foot-and-mouth disease vaccines[J]. Vaccine, 1987, 5(1): 60–64. DOI: 10.1016/0264-410X(87)90011-9 |
| [15] | BARTELING S J, MELOEN R H. A simple method for the quantification of 140 S particles of foot-and-mouth disease virus (FMDV)[J]. Arch Gesamte Virusforsch, 1974, 45(4): 362–364. DOI: 10.1007/BF01242879 |
| [16] | YANG Y L, LI H, LI Z J, et al. Size-exclusion HPLC provides a simple, rapid, and versatile alternative method for quality control of vaccines by characterizing the assembly of antigens[J]. Vaccine, 2015, 33(9): 1143–1150. DOI: 10.1016/j.vaccine.2015.01.031 |
| [17] | VAN MAANEN C, TERPSTRA C. Quantification of intact 146S foot-and-mouth disease antigen for vaccine production by a double antibody sandwich ELISA using monoclonal antibodies[J]. Biologicals, 1990, 18(4): 315–319. DOI: 10.1016/1045-1056(90)90036-Y |
| [18] | HARMSEN M M, SEAGO J, PEREZ E, et al. Isolation of single-domain antibody fragments that preferentially detect intact (146S) particles of foot-and-mouth disease virus for use in vaccine quality control[J]. Front Immunol, 2017, 8: 960. DOI: 10.3389/fimmu.2017.00960 |
| [19] | MA L N, ZHANG J, CHEN H T, et al. An overview on ELISA techniques for FMD[J]. Virol J, 2011, 8(1): 419. DOI: 10.1186/1743-422X-8-419 |
| [20] | YANG M, HOLLAND H, CLAVIJO A. Production of monoclonal antibodies against whole virus particles of foot-and-mouth disease virus serotype O and A and their potential use in quantification of intact virus for vaccine manufacture[J]. Vaccine, 2008, 26(27-28): 3377–3382. DOI: 10.1016/j.vaccine.2008.04.062 |
| [21] | REID S M, MIOULET V, KNOWLES N J, et al. Development of tailored real-time RT-PCR assays for the detection and differentiation of serotype O, A and Asia-1 foot-and-mouth disease virus lineages circulating in the Middle East[J]. J Virol Methods, 2014, 207: 146–153. DOI: 10.1016/j.jviromet.2014.07.002 |
| [22] | HUANG X, LI Y, ZHENG C Y. A novel single-cell quantitative real-time RT-PCR method for quantifying foot-and-mouth disease viral RNA[J]. J Virol Methods, 2009, 155(2): 150–156. DOI: 10.1016/j.jviromet.2008.10.007 |
| [23] | SAJID M, KAWDE A N, DAUD M. Designs, formats and applications of lateral flow assay: A literature review[J]. J Saudi Chem Soc, 2015, 19(6): 689–705. DOI: 10.1016/j.jscs.2014.09.001 |
| [24] | BOULWARE D R, ROLFES M A, RAJASINGHAM R, et al. Multisite validation of cryptococcal antigen lateral flow assay and quantification by laser thermal contrast[J]. Emerg Infect Dis, 2014, 20(1): 45–53. DOI: 10.3201/eid2001.130906 |
| [25] | WANG X L, LI K, SHI D S, et al. Development of an immunochromatographic lateral-flow test strip for rapid detection of sulfonamides in eggs and chicken muscles[J]. J Agric Food Chem, 2007, 55(6): 2072–2078. DOI: 10.1021/jf062523h |
| [26] | THIRUVENGADAM M, VENKIDASAMY B, SUBRAMANIAN U. Up-converting phosphor technology-based lateral flow assay for quantitative detection of β-hydroxybutyrate in biological samples[J]. Anal Biochem, 2020, 591: 113546. DOI: 10.1016/j.ab.2019.113546 |
| [27] | JIANG T, LIANG Z, REN W W, et al. Development and validation of a lateral flow immunoassay using colloidal gold for the identification of serotype-specific foot-and-mouth disease virus O, A and Asia 1[J]. J Virol Methods, 2011, 171(1): 74–80. DOI: 10.1016/j.jviromet.2010.10.002 |
| [28] |
邱杨, 肖性龙, 赵丽, 等. 多重荧光RT-PCR同时检测口蹄疫O A AsiaⅠ三种血清型[J]. 中国兽医杂志, 2010, 46(6): 9–11.
QIU Y, XIAO X L, ZHAO L, et al. Construction of multiple real-time RT-PCR for the detection of FMDV subtype O, A and Asia Ⅰ[J]. Chinese Journal of Veterinary Medicine, 2010, 46(6): 9–11. DOI: 10.3969/j.issn.0529-6005.2010.06.003 (in Chinese) |
| [29] | HUO T M, PENG C F, XU C L, et al. Development of colloidal gold-based immunochromatographic assay for the rapid detection of medroxyprogesterone acetate residues[J]. Food Agric Immunol, 2006, 17(3-4): 183–190. DOI: 10.1080/09540100601089895 |
| [30] | GUO H, LIU X, LIU Z, et al. Recent outbreaks of foot-and-mouth disease type Asia 1 in China[J]. J Vet Med Ser B, 2006, 53(S1): 29–33. DOI: 10.1111/j.1439-0450.2006.01018.x |
| [31] | CAI C, LI H C, EDWARDS J, et al. Meta-analysis on the efficacy of routine vaccination against foot and mouth disease (FMD) in China[J]. Prev Vet Med, 2014, 115(3-4): 94–100. DOI: 10.1016/j.prevetmed.2014.03.020 |
| [32] | ZHANG Q, LI D, LIU X T, et al. Experimental studies with foot-and-mouth disease virus type Asia-1, responsible for the 2005 epidemic in China[J]. Res Vet Sci, 2008, 85(2): 368–371. DOI: 10.1016/j.rvsc.2007.11.005 |
| [33] | VALARCHER J F, KNOWLES N J, ZAKHAROV V, et al. Multiple origins of foot-and-mouth disease virus serotype Asia 1 outbreaks, 2003-2007[J]. Emerg Infect Dis, 2009, 15(7): 1046–1051. DOI: 10.3201/eid1507.081621 |



