羊地方性鼻内肿瘤(enzootic nasal adenocarcinoma, ENA)是由绵羊地方性鼻内肿瘤病毒(enzootic nasal tumor virus 1, ENTV-1)和山羊地方性鼻内肿瘤病毒(enzootic nasal tumor virus 2, ENTV-2)导致鼻甲筛骨上皮细胞恶性转化而引起的慢性、进行性、传染性的肿瘤[1]。该病呈世界性分布,迄今为止,除了澳大利亚和新西兰所在的大洋洲之外,其他大洲均有ENTV-2的报道[2]。1995年,林曦等[3]报道了14例发生在内蒙古山羊地方性鼻内肿瘤病例,这也是我国首次报道,之后在湖南[4]、四川[5]、陕西[6]等地相继报道此病,但并未引起相关人员的注意和重视,由于引种和运输检疫把关不严,从2011年开始,福建有多个市相继暴发该疾病[7],且有流行的趋势,目前没有有效的药物和疫苗可以使用,对我国的养羊业造成巨大的经济损失。
本病呈地方性流行,主要临床症状为病羊食欲减退,日渐消瘦,精神萎靡,鼻腔产生大量鼻涕渗出物,张口呼吸,剖检可见鼻内单侧或双侧出现肿瘤增生物[8]。肿瘤除了损害鼻甲骨之外,还会入侵鼻窦和额窦等部位,使局部骨骼变软或萎缩,造成面部不对称,后期增生物扩大占据鼻腔空间引起鼻腔堵塞,导致病羊呼吸困难或者窒息死亡[9-10]。从出现临床症状到病羊死亡的时间从3周到1年不等[11],本病发病率不高,但是死亡率可达到100%,其主要原因是后期肿瘤增生物堵塞鼻腔,病羊呼吸衰竭和继发性感染[2, 12]。截至目前,并未见有成功体外分离病毒的报道[13],导致对该病毒致病性研究偏少。本研究从福建福州市郊某山羊场采集疑似山羊地方性鼻内肿瘤组织样品,通过RT-PCR确诊该羊场部分山羊患有该病,根据NCBI上传的ENTV-2序列设计多对引物进行RT-PCR,经测序后利用生物信息学软件拼接得到病毒全基因组,其GenBank登录号为MT598195。进一步对全基因组绘制进化树进行分析,同时构建了gag蛋白的原核表达和真核表达载体,制备多克隆抗体和获得了过表达稳定细胞系,对gag蛋白的作用及其机制进行了研究,以期为该病的防控及深入研究其致病机制、研发疫苗和药物提供理论基础。
1 材料与方法 1.1 主要试验材料293T细胞、K562细胞和OFTu细胞由本实验室保存;山羊鼻内肿瘤组织采样于福州市郊某羊场;BALB/c Nude裸鼠:4~5周龄,购买于北京维通利华实验动物技术有限公司;原核表达载体pET-21a(+)和过表达载体pMIG-CMV-80 ℃冻存于本实验室;胶回收试剂盒、质粒提取试剂盒、克隆载体pLB、大肠杆菌DH5α、表达感受态BL21(DE3)均购自天根生化科技(北京)有限公司。
1.2 主要试剂限制性内切酶EcoRⅠ、NheⅠ、XhoⅠ、BgIⅡ、T4连接酶、PrimeSTAR Max DNA Polymerase、Oligod T(18)/Random Primer、25 mmol·L-1 MgCl2、RTase、RiboLock Rnase Inhibitor、10 mmol·L-1 dNTP Mixture均购自TaKaRa公司,5×Reaction buffer购自Promega公司,核酸Marker、2×Taq PCR Master Mix购自Biomed公司,蛋白Marker购自赛默飞公司,DEPC水购自AMRESCO公司,NC膜购自Millipore公司,ECL化学发光液购自普利莱生物有限公司,氯仿、异丙醇、无水乙醇购自北京化工,DMEM、RPMI1640购自Invitrogen公司,胎牛血清FBS、ploybrene购自Gibco公司,真核转染试剂VigoFect购自威格拉斯生物技术有限公司,Anti-phospho-STAT5、Anti-phospho-JAK2、Anti-phospho-Akt、Anti-STAT5、Anti-JAK2、Anti-Akt购自Cell Signaling Technology;Anti-actin购自博奥瑞金有限公司,Anti-Flag,购自Sigma公司。
1.3 山羊地方性鼻内肿瘤病的鉴定挑选出现流鼻涕、打喷嚏等典型临床症状的山羊进行剖检,采集鼻腔肿瘤组织,称量30 mg肿瘤组织, 利用Trizon法提取病毒总RNA,-80 ℃保存或立即反转录成cDNA。反转录体系为20 μL:总RNA 5 μg,OligodT(18)/Random Primer 1 μL,加DEPC水至10 μL,70 ℃水浴5 min;冰浴5 min,再向上述反应体系中加入以下试剂:5×Reaction buffer 4 μL,25 mmol·L-1 MgCl22 μL,10 mmol·L-1 dNTP Mixture 1 μL,RTase 1 μL,RiboLock Rnase Inhibitor 0.4 μL,DEPC水1.6 μL。反应条件:25 ℃ 5 min;42 ℃ 1 h;70 ℃ 10 min;-20 ℃保存。根据NCBI收录的ENTV-2序列设计1对特异性引物进行RT-PCR确诊,上游引物ENTV-2-F:5′-CAGTCCATTCAAGCTGCTCATACTG-3′,下游引物ENTV-2-R:5′- CAATCACCGGATCCTTACTTAATCG-3′,扩增目的片段大小为828 bp。采用15 μL RT-PCR体系:2×Taq PCR Master Mix 7.5 μL,水5.5 μL,上游引物0.5 μL,下游引物0.5 μL,cDNA模板1 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min;4 ℃保存。RT-PCR产物经1%琼脂糖凝胶电泳检测并拍照。RT-PCR产物经测序分析来鉴定ENTV-2。
1.4 ENTV-2-FJ全基因组扩增及拼接接下来分别设计6对引物进行全基因组扩增(表 1),引物由北京擎科生物科技有限公司合成。
|
|
表 1 PCR引物信息 Table 1 The information of primers for PCR |
以“1.3”反转录好的cDNA为模板进行RT-PCR反应,反应体系一致,P1~P6退火温度分别为56、60、55、56、57、56 ℃,延伸时间分别为30、90、45、90、30、90 s,其余反应条件一样。1%琼脂糖凝胶电泳,得到目的条带后根据胶回收试剂盒说明书进行胶回收,将其克隆至pLB克隆载体后送北京擎科生物科技有限公司测序,应用生物信息学软件DNAStar对序列进行拼接、基因注释,并将得到的ENTV-2-FJ全基因组序列上传至NCBI。
1.5 ENTV-2-FJ全基因组进化分析下载GenBank先前报道的19株ENTV-2毒株全基因组,应用生物信息学软件MEGA-X将它们和本研究毒株采用Kimura 2参数,Neighbour-joining邻接法,1 000次的步长检验进行运算并绘制遗传进化树。
1.6 原核表达载体构建由北京擎科生物有限公司合成gag基因引物,上游引物gag-F:5′-CTAGCTAGCATGGGACAAATGCATAGTCGCCAGT-3′,下划线为NheⅠ酶切位点,下游引gag-R:5′-CCGGAATTCGTACTGTATAGGAGGCGGCAC-3′,下划线为EcoRⅠ酶切位点。利用限制性内切酶对PCR产物片段和表达载体进行酶切,纯化、回收后再用T4 DNA连接酶4 ℃过夜连接,之后进行转化试验,挑取单克隆菌株摇菌,提质粒,用限制性内切酶对重组质粒进行电泳鉴定,并将重组质粒送北京擎科生物科技有限公司测序。
1.7 多克隆抗体的制备及检测将构建好的重组质粒转化至BL21(DE3)表达感受态细胞,对诱导剂IPTG浓度(0.25、0.5、0.75、1 mmol·L-1)和诱导时间(3~8 h)进行优化,收集全菌,NanoDrop 2000测其OD600 nm值,再根据OD600 nm值按比例添加1×loading buffer制备全菌蛋白样品,进行SDS-PAGE检测,选择最适合条件(37 ℃、0.75 mmol·L-1IPTG、诱导8 h)进行融合蛋白可溶性检测,然后将重组质粒诱导表达的融合蛋白利用SDS-PAGE电泳后切相应大小条带的胶,送往北京百尔康纳特实验动物繁育生物技术开发有限公司制备兔抗gag蛋白多克隆抗体。称量300 mg山羊肿瘤组织裂解制备成蛋白样品,SDS-PAGE电泳后冰浴转膜,在5%脱脂奶粉封闭2 h,制备好的血清作为一抗(1∶40 000)稀释孵育2 h,TBST洗涤3次,HRP-IgG(羊抗兔)作为二抗(1∶2 000),孵育2 h,TBST洗涤3次,化学发光液(AB液)反应3 min后进行曝光,记录并分析条带。
1.8 真核表达载体构建由北京擎科生物有限公司合成gag基因引物,上游引物gag-F:5′-GGAAGATCTATGGGACAAATGCATAGTCGCCAGT-3′,下划线为BgIⅡ酶切位点,下游引物gag-R:5′-CCGCTCGAGTCACTTGTCGTCGTCGTCCTTGTAGTCGTACTGTAT-AGGAGGCGGCAC-3′,下划线为XhoⅠ酶切位点,斜体为Flag序列。如“1.5”原核表达载体方法构建pMIG-gag-Flag重组质粒载体。
1.9 稳定细胞系构建通过制备逆转录病毒或慢病毒感染靶细胞的方法,将特定的序列整合到细胞的基因组中,得到可稳定遗传的过表达细胞系。培养293T细胞至密度为80%~90%,弃掉完全培养基换成无血清无双抗DMEM培养基,取1.5 mL EP管,分两组,各加500 μL无血清无双抗DMEM培养基,一组加待转染包装质粒(pMIG-VSVG、pMIG-pcleco)、空载质粒(Linker)、靶基因质粒(pMIG-gag),一组加10 μL的VigoFect转染试剂,轻轻混匀,室温放置5 min,将质粒与转染试剂混匀室温放置20 min,逐滴加到293T细胞中,4~6 h后换成完全培养基,置于37 ℃、5% CO2培养箱中培养。48 h后收集上清液,经0.22 μm过滤器过滤后,加到离心后收集的K562细胞,避光1∶1 000添加ploybrene,混匀后分装至6孔板中经保鲜膜包裹封闭在32 ℃,2 200 r·min-1离心120 min。悬浮感染结束后补加1 mL完全培养基,24 h后可传代。
1.10 裸鼠致瘤试验购买4~5周龄的雌性BALB/c裸鼠于SPF动物房饲养,收集K562细胞(细胞状态良好,提前换液),用1×PBS洗涤两次,血球计数板计数,每管分装1×107~2×107个细胞,用100 μL的1×PBS重悬,总体积约为200 μL。将细胞置于冰上,减少代谢,接种时再次将细胞混匀,用1 mL注射器抽取细胞,赶尽气泡后注射小鼠。将小鼠放回笼内继续饲养,定期观察小鼠致瘤效果,1周后可观察到肿瘤的出现,2~3周后,肿瘤长至一定大小后取出肿瘤块拍照记录。
1.11 免疫印迹试验收集细胞或称量肿瘤组织并制备成蛋白样品,制备5%浓缩胶和10%分离胶,先使用恒压(80 V)将蛋白样品压缩至凝胶分界线,再使用恒压(120 V) 在分离胶中进行电泳,120 min,恒流(250 mA),冰浴转膜,转膜结束后在5%脱脂奶粉封闭2 h,一抗分别按以下比例稀释:p-JAK2(1∶4 000)、p-STAT5(1∶5 000)、p-Akt(1∶5 000)、JAK2(1∶2 000)、STAT5(1∶2 000)、Akt(1∶4 000)、Flag(1∶2 000)、actin(1∶40 000)、gag(1∶40 000)孵育2 h,TBST洗涤3次,HRP-IgG(羊抗兔)、HRP-IgG(羊抗鼠)作为二抗(1∶4 000),孵育2 h,TBST洗涤3次,化学发光液(AB液)反应3 min后进行曝光,记录并分析条带。
2 结果 2.1 山羊地方性鼻内肿瘤病的鉴定2018年7月,福州市郊某山羊场发生疑似地方性鼻内肿瘤疫病,部分病羊出现食欲减退,逐渐消瘦、流鼻涕、打喷嚏等症状。剖检病羊发现鼻内单侧出现增生物,颜色呈淡粉红色,质地松软,类似菜花样(图 1A)。针对ENTV-2设计一对特异性引物,预期扩增片段大小为828 bp,经过RT-PCR扩增后得到预期目的条带(图 1B)。将目的条带切胶回收并连接到pLB克隆载体后送北京擎科生物科技有限公司测序,得到的序列在NCBI进行blast,与NCBI收录的ENTV-2序列相似性最高达99%,在核酸水平上证实该羊场患鼻内肿瘤疾病是由ENTV-2引起的。同时还对病羊的心、肝、肾、肺、淋巴、肿瘤等组织进行RT-PCR检测,结果显示,只有在肿瘤组织中能检测出病毒(图 1C)。设计6对特异性引物(图 1D)进行RT-PCR,分别扩增出相应片段(图 1E),大小均与预期一致,切胶回收克隆至pLB载体上,测序后利用生物学软件DNAStar将各个片段去除载体信息后进行拼接,获得ENTV-2全基因组序列,长度为7 443 bp,命名为ENTV-2-FJ,上传至NCBI获得GenBank登录号为MT598195。以上结果显示,该羊场的鼻内肿瘤疾病是由ENTV-2引起的,作者成功克隆扩增出病毒全基因组。

|
A. 地方性山羊鼻内肿瘤病主要临床症状;B. 核酸水平证实该病由ENTV-2引起(1.肿瘤组织;2.阴性对照; M.核酸marker);C. RT-PCR检测(1.山羊胚胎鼻甲细胞和病羊;2.心;3.肝;4.肾;5.肺;6.淋巴;7.肿瘤组织; M.核酸marker);D. 设计6对特异性引物示意图;E. 全基因组克隆扩增(P1~P6.扩增片段; M.核酸marker) A. Main clinical symptoms of ENA; B. Nucleic acid levels confirm that the disease is caused by ENTV-2 (1. Tumor tissue; 2. MOCK; M.Nucleic acid marker); C. RT-PCR detection of tissues (1. OFTu and diseased goats; 2. Heart; 3. Liver; 4. Kidney; 5. Lung; 6. Lymph; 7. Tumor; M.Nucleic acid marker); D. Schematic diagram of designing 6 pairs of specific primers; E. Whole genome clonal amplification (P1-P6.Amplified fragment; M.Nucleic acid marker) 图 1 山羊地方性鼻内肿瘤病的鉴定(彩图见OSID资料) Fig. 1 Identification of ENA(please find the OSID data for the color groph) |
本研究毒株核酸序列与GenBank先前收录的19株ENTV-2毒株全基因组相似,具有5′-U5-gag-pro-pol-env-U3-3′典型结构,包含4个开放阅读框和侧翼非编码区以及末端重复序列,且核酸相似性在88.93%~98.71%。gag基因主要编码核心蛋白,位于基因组的215~2 053 bp,全长为1 839 bp;pro基因位于gag和pol基因之间,编码蛋白酶,全长870 bp,在基因组1 945~2 814区间;pol基因位于3 060~5 405 bp,全长2 346 bp,编码逆转录酶和整合酶两种蛋白;囊膜蛋白由env基因编码,前体蛋白经水解后产生两条肽链,较大的那条氨基端通过二硫键和氢键与较小的穿膜蛋白(TM)相连,暴露于囊膜之外,称为表面蛋白(SU),较小的那条羧基端链TM贯穿病毒的囊膜。env基因全长1 869 bp,位于5 281~7 149 bp。
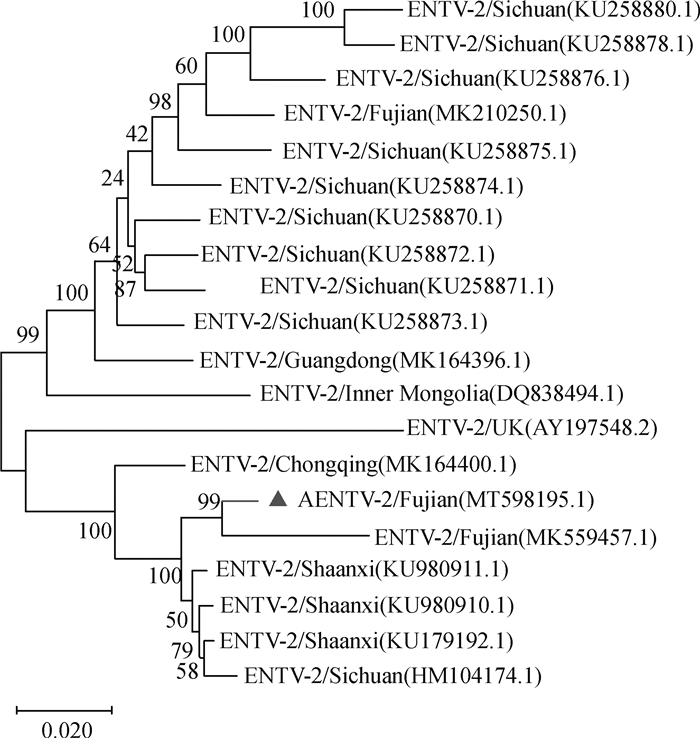
为了进一步了解本研究的ENTV-2-FJ株与GenBank中公布的19个ENTV-2基因组序列之间的遗传关系,用MEGA-X以Kimura 2-parameter模型,建立NJ树,并对拓扑图进行了自展检验(bootstrap),重复抽样次数为1 000次进行运算并绘制遗传进化树(图 2)。通过比较可知,本试验获得的毒株与福建省农业科学院江锦秀等[14]报道的毒株(MK559457.1)亲源性较近。根据以上结果,推测该病毒可能是通过商品贸易或者人员携带传入。通过解析ENTV-2全基因序列信息,对本病毒在福建省内发生的遗传变异和之后的疫苗药物等研发具有一定的指导意义。
|
该进化树使用MEGA-X中的邻接法构建,建树的检验方法为1 000次的步长检验。ENTV-2-FJ毒株带有三角形 The tree was constructed using the neighbor-joining method in MEGA-X with 1 000 bootstrap replications. The ENTV-2-FJ strain was signed with triangle 图 2 ENTV-2全基因组分析 Fig. 2 Analysis of ENTV-2 whole genome |
用限制性内切酶EcoRⅠ和NheⅠ对重组质粒pET-21a-gag在37 ℃条件下进行双酶切,酶切结果正确,大小为1 839 bp左右(图 3A)。gag基因编码613个氨基酸,软件预测大小在70 ku左右,将酶切正确的重组质粒转化至BL21(DE3)表达载体中,在37 ℃,0.5 mmol·L-1的IPTG条件下诱导6 h,收集全菌进行SDS-PAGE电泳,并用考马斯亮蓝染色,洗脱后结果在预期大小有目的条带(图 3B),说明融合蛋白His-gag诱导表达成功。保持诱导时间(6 h)和温度(37 ℃)不变,以0.25、0.50、0.75、1.00 mmol·L-1不同浓度进行诱导以及保持诱导浓度(0.75 mmol·L-1)和温度(37 ℃)不变,诱导3~8 h。结果表明,融合蛋白His-gag随着IPTG浓度增加而逐渐增多,在浓度为0.75 mmol·L-1时表达量最高(图 3C),而随着诱导时间推移蛋白表达量并没有明显增高(图 3D)。在37 ℃浓度为0.75 mmol·L-1IPTG诱导8 h后,收集His-gag融合蛋白菌液,离心沉淀菌体,低温超声破碎,分别收集上清和沉淀并制备成蛋白样品进行SDS-PAGE电泳检测其可溶性,结果如图 3E所示,His-gag融合蛋白主要存在沉淀中,在上清未见明显条带。His-gag融合蛋白进行SDS-PAGE电泳后,切胶作为抗原制备多抗血清,将制备好的血清作为一抗与地方性山羊鼻内肿瘤组织阳性样品进行反应,出现70 ku左右的条带,与预期的大小相符(图 3F)。以上结果表明,作者成功制备了兔抗gag蛋白多克隆抗体。

|
A. pET-21a-gag重组质粒酶切鉴定(M. 核酸marker; 1.重组质粒;2.酶切结果);B. 融合蛋白诱导表达结果(M. 蛋白质marker; 1.空载未诱导;2.空载诱导;3.融合蛋白未诱导;4.融合蛋白诱导);C. 不同溶度诱导剂诱导表达结果(M. 蛋白质marker; 1.融合蛋白未诱导;2~5.分别为终浓度0.25、0.50、0.75、1.00 mmol·L-1的IPTG诱导);D. 不同时间点诱导表达结果(M. 蛋白质marker; 1.融合蛋白未诱导;2~8.分别为诱导3~8 h);E. 融合蛋白可溶性检测(M. 蛋白质marker; 1.空载未诱导;2.空载诱导;3.融合蛋白未诱导;4.融合蛋白诱导;5.融合蛋白诱导超声上清;6.融合蛋白诱导超声沉淀);F. 抗体检测(1.山羊正常组织;2.肿瘤组织) A. Recombinant pET-21a-gag plasmid digestion identification (M. Nucleic acid marker; 1. Recombinant plasmid; 2. Enzyme digestion result); B. Fusion protein induced expression results (M. Protein marker; 1. pET-21a-(+) without induction; 2. pET-21a-(+) with induction; 3. pET-21a-gag without induction; 4. pET-21a-gag with induction); C. Induced expression results of different solubility inducers (M. Protein marker; 1. pET-21a-gag without induction; 2-5. IPTG induces final concentrations of 0.25, 0.50, 0.75, and 1.00 mmol·L-1); D. Induced expression results at different time points (M. Protein marker; 1. pET-21a-gag without induction; 2-8. Induce for IPTG 3-8 h); E. Fusion protein solubility test (M. Protein marker; 1. pET-21a-(+) without induction; 2. pET-21a-(+) with induction; 3. pET-21a-gag without induction; 4. pET-21a-gag with induction; 5. Supernatant of pET-21a-gag with induction; 6. Precipitation of pET-21a-gag with induction); F. Antibody detection (1. Goat normal tissue; 2. Tumor tissue) 图 3 gag蛋白的原核表达和多克隆抗体制备 Fig. 3 Prokaryotic expression of gag protein and preparation of polyclonal antibody |
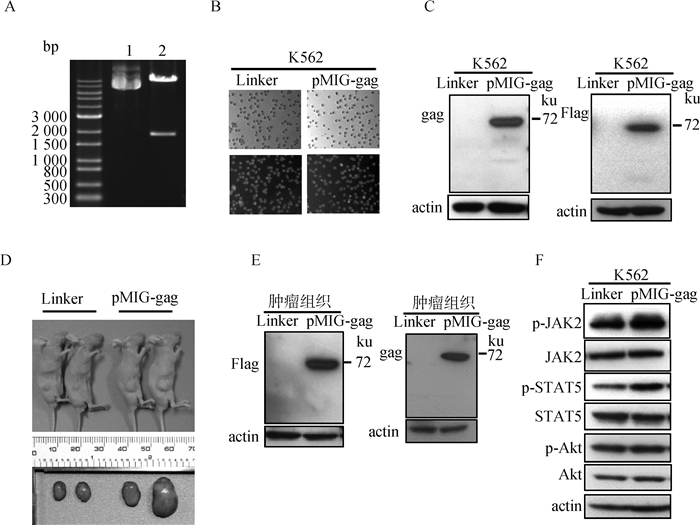
为探究gag基因在肿瘤发生发展中所起的作用,首先将带有Flag标签的gag基因构建到pMIG-CMV载体上,利用双酶切对重组质粒pMIG-gag-Flag进行鉴定,酶切结果正确(图 4A)。接着使用慢病毒感染方法使gag基因在K562细胞中高表达,证实转染效率的绿色荧光蛋白(GFP)表达超过80%(图 4B),表明转染效率高,接着利用Flag和gag抗体作为一抗检测gag蛋白的表达情况,如图 4C所示,与空载体转染的细胞相比,gag蛋白能在K562细胞中大量表达。然后利用上述构建好的细胞系进行裸鼠皮下致瘤,检测过表达gag基因是否影响K562细胞在裸鼠体内成瘤情况。将皮下的肿瘤剖解出来,发现与对照组相比过表达gag基因的K562细胞系所诱发的裸鼠皮下肿瘤体积明显更大(图 4D)。随后,将这些肿瘤裂解后以Flag和制备的兔抗gag抗体作为一抗进行Western blot检测,再次检测gag蛋白的表达量,结果表明,肿瘤裂解样品gag蛋白仍显著表达(图 4E)。信号转导和转录激活因子5(signal transducers and activators of transcription 5,STAT5)在众多癌症中发挥着关键作用[15-16],并由细胞因子受体下游的JAK激酶激活,STAT5蛋白的异常激活,极大地促进了肿瘤细胞的存活和疾病的恶性发展[17-18]。因此,本研究在过表达gag基因的细胞系中检测JAK2和STAT5的磷酸化情况。研究发现,在过表达gag基因的细胞系中JAK2和STAT5磷酸化水平明显升高(图 4F)。以上结果显示,gag基因能够通过调节JAK2-STAT5通路促进肿瘤生长。
|
A. 重组质粒pMIG-gag-Flag酶切鉴定(M. 核酸marker;1.重组质粒;2.酶切结果);B. K562细胞荧光图;C. 过表达细胞系鉴定结果;D. 裸鼠致瘤情况;E. 肿瘤组织gag蛋白检测结果; F. Western blot检测结果 A. Recombinant pMIG-gag-Flag plasmid digestion identification (M. Nucleic acid marker; 1. Recombinant plasmid, 2. Enzyme digestion result); B. Fluorescence image of K562 cell; C. Overexpression cell line identification results; D. Tumor in nude mice; E. Test results of gag protein in tumor tissue; F. Result of Western blot 图 4 gag基因通过调节JAK2-STAT5通路促进肿瘤生长(彩图见OSID资料) Fig. 4 gag gene promotes tumor growth by regulating the JAK2-STAT5 pathway(please find the OSID data for the color graph) |
ENA病程长,前期不易发现,后期病死率可达100%,对养羊业造成巨大的经济损失。世界上除大洋洲外,其他大洲均有ENA发生的报道,在我国也有蔓延的趋势,目前没有特效药和有效的疫苗进行防控,只能通过严格的检疫和隔离扑杀来降低发病率。国内对ENTV-2的研究较少,主要碍于未能找到合适的体外培养细胞系和研究体系。本研究获得了ENTV-2-FJ全基因组序列并对其进化进行了分析,丰富了ENTV-2全基因组信息,对病毒在福建省内发生的遗传变异和之后的疫苗药物等研发具有重要的指导意义。有报道称,gag蛋白是做ELISA检测的首选蛋白[19],作者成功制备了兔抗gag蛋白的多克隆抗体,可以为后续开发检测试剂奠定基础。JAK-STAT信号通路在肿瘤发生发展中扮演着重要角色,包括参与肿瘤细胞的识别和免疫逃逸等过程[20-21],在某些癌症中,JAK-STAT信号传导功能的异常,有可能启动并促进肿瘤的发生[22]。STAT5的异常表达主要与肿瘤的发生和扩散有关[23],特别是在一些实体瘤的发生过程,由于在肿瘤微环境中炎症因子的大量增加而造成JAK2-STAT5的过度激活[24-25]。目前,世界上仍未能成功分离ENTV-2,使得对病毒致病性研究甚少,其中又主要聚焦研究env基因,缺乏对gag基因的深入探究。本试验研究发现gag基因能够通过调节JAK2-STAT5信号通路促进肿瘤的生长,为今后系统研究ENTV-2感染如何激活肿瘤信号通路,从而诱导细胞癌变过程,揭示信号调控网络的多种关键节点分子的功能与作用机制提供了科学依据,并为细胞癌变的干预提供潜在有价值的靶标。所以,本研究对ENTV-2的防控具有参考价值。
4 结论获得了ENTV-2-FJ全基因组序列并对其进行分析,制备并验证了gag蛋白的多克隆抗体,探讨了gag蛋白的作用机制,gag基因能够通过调节JAK2-STAT5信号通路促进肿瘤的生长。
| [1] |
RINGS D M, ROJKO J. Naturally occurring nasal obstructions in 11 sheep[J]. Cornell Vet, 1985, 75(2): 269-276. |
| [2] |
APOSTOLIDI E D, PSALLA D, CHASSALEVRIS T, et al. Development of real-time PCR-based methods for the detection of enzootic nasal tumor virus 2 in goats[J]. Arch Virol, 2019, 164(3): 707-716. DOI:10.1007/s00705-018-04138-0 |
| [3] |
林曦, 郝先谱, 赵振华, 等. 山羊鼻内腺瘤和腺癌的病理学研究[J]. 畜牧兽医学报, 1995, 26(5): 456-461. LIN X, HAO X P, ZHAO Z H, et al. Pathological studies on intranasal adenoma and adenocarcinoma in goats[J]. Acta Veterinaria et Zootechnica Sinica, 1995, 26(5): 456-461. DOI:10.3321/j.issn:0366-6964.1995.05.014 (in Chinese) |
| [4] |
王景, 周曼, 何亚鹏, 等. 一起山羊地方性鼻内肿瘤的调查与诊断[J]. 动物医学进展, 2006, 38(2): 129-132. WANG J, ZHOU M, HE Y P, et al. Diagnosis of enzootic nasal tumor in goats[J]. Progress in Veterinary Medicine, 2006, 38(2): 129-132. (in Chinese) |
| [5] |
冯迎春, 颜其贵. 从山羊鼻内腺瘤病例中分离出嗜麦芽窄食单胞菌的报告[J]. 畜牧与兽医, 2009, 41(12): 81-83. FENG Y C, YAN Q G. Report on the isolation of Stenotrophomonas maltophilia from cases of goat intranasal adenoma[J]. Animal Husbandry & Veterinary Medicine, 2009, 41(12): 81-83. (in Chinese) |
| [6] |
何亚鹏, 张琪, 王景, 等. 山羊地方性鼻内肿瘤病毒gag蛋白的原核表达、纯化及多克隆抗体的制备[J]. 中国兽医学报, 2017, 37(12): 2300-2303. HE Y P, ZHANG Q, WANG J, et al. Prokaryotic expression and purification of gag protein of enzootic nasal tumor virus of goats and preparation of its polyclonal antibody[J]. Chinese Journal of Veterinary Science, 2017, 37(12): 2300-2303. (in Chinese) |
| [7] |
江锦秀, 林裕胜, 江斌, 等. 福建山羊地方性鼻内肿瘤的分子流行病学调查[J]. 福建农业学报, 2017, 32(8): 837-841. JIANG J X, LIN Y S, JIANG B, et al. Molecular epidemiology of enzootic nasal tumor virus on goats in Fujian[J]. Fujian Journal of Agricultural Sciences, 2017, 32(8): 837-841. (in Chinese) |
| [8] |
YE C, HUANG Q Y, CHEN T T, et al. First detection and genotypic analysis of goat enzootic nasal tumor virus 2 in Chongqing, China[J]. Arch Virol, 2019, 164(6): 1647-1650. DOI:10.1007/s00705-019-04211-2 |
| [9] |
DE LAS HERAS M, ORTÍN A, COUSENS C, et al. Enzootic nasal adenocarcinoma of sheep and goats[J]. Curr Top Microbiol Immunol, 2003, 275(2): 201-223. |
| [10] |
HE Y P, ZHANG Q, WANG J, et al. Full-length genome sequence analysis of enzootic nasal tumor virus isolated from goats in China[J]. Virol J, 2017, 14(1): 141. DOI:10.1186/s12985-017-0795-4 |
| [11] |
WALSH S R, STINSON K J, MENZIES P I, et al. Development of an ante-mortem diagnostic test for enzootic nasal tumor virus and detection of neutralizing antibodies in host serum[J]. J Gen Virol, 2014, 95(8): 1843-1854. DOI:10.1099/vir.0.064956-0 |
| [12] |
DE CECCO B S, LORENZETT M P, HENKER L C, et al. Detection of enzootic nasal tumor virus (ENTV) in a sheep flock in southern Brazil[J]. Trop Anim Health Prod, 2019, 51(7): 2095-2098. DOI:10.1007/s11250-019-01897-z |
| [13] |
MAEDA N, INOSHIMA Y, DE LAS HERAS M, et al. Enzootic nasal tumor virus type 2 envelope of goats acts as a retroviral oncogene in cell transformation[J]. Virus Genes, 2021, 57(1): 50-59. DOI:10.1007/s11262-020-01808-7 |
| [14] |
江锦秀, 林裕胜, 张靖鹏, 等. 山羊地方性鼻内肿瘤病毒ENTV-2FJ株的分离纯化和全基因组序列分析[J]. 农业生物技术学报, 2020, 28(2): 313-324. JIANG J X, LIN Y S, ZHANG J P, et al. Isolation, purification and genome sequence analysis of enzootic nasal tumor virus of goats (Capra hircus) Strain ENTV-2FJ[J]. Journal of Agricultural Biotechnology, 2020, 28(2): 313-324. (in Chinese) |
| [15] |
GOTTHARDT D, PUTZ E M, GRUNDSCHOBER E, et al. STAT5 is a key regulator in NK cells and acts as a molecular switch from tumor surveillance to tumor promotion[J]. Cancer Discov, 2016, 6(4): 414-429. DOI:10.1158/2159-8290.CD-15-0732 |
| [16] |
WINGELHOFER B, NEUBAUER H A, VALENT P, et al. Implications of STAT3 and STAT5 signaling on gene regulation and chromatin remodeling in hematopoietic cancer[J]. Leukemia, 2018, 32(8): 1713-1726. DOI:10.1038/s41375-018-0117-x |
| [17] |
WANG X F, YANG J L, GUO G J, et al. Novel lncRNA-IUR suppresses Bcr-Abl-induced tumorigenesis through regulation of STAT5-CD71 pathway[J]. Mol Cancer, 2019, 18(1): 84. DOI:10.1186/s12943-019-1013-3 |
| [18] |
BRITSCHGI A, ANDRAOS R, BRINKHAUS H, et al. JAK2/STAT5 inhibition circumvents resistance to PI3K/mTOR blockade: a rationale for cotargeting these pathways in metastatic breast cancer[J]. Cancer Cell, 2012, 22(6): 796-811. DOI:10.1016/j.ccr.2012.10.023 |
| [19] |
HOHN O, MOSTAFA S, NORLEY S, et al. Development of an antigen-capture ELISA for the detection of the p27-CA protein of HERV-K(HML-2)[J]. J Virol Methods, 2016, 234: 186-192. DOI:10.1016/j.jviromet.2016.04.016 |
| [20] |
VERHOEVEN Y, TILBORGHS S, JACOBS J, et al. The potential and controversy of targeting STAT family members in cancer[J]. Semin Cancer Biol, 2020, 60: 41-56. DOI:10.1016/j.semcancer.2019.10.002 |
| [21] |
THOMAS S J, SNOWDEN J A, ZEIDLER M P, et al. The role of JAK/STAT signalling in the pathogenesis, prognosis and treatment of solid tumours[J]. Br J Cancer, 2015, 113(3): 365-371. DOI:10.1038/bjc.2015.233 |
| [22] |
TOH T B, LIM J J, HOOI L, et al. Targeting Jak/Stat pathway as a therapeutic strategy against SP/CD44+ tumorigenic cells in Akt/β-catenin-driven hepatocellular carcinoma[J]. J Hepatol, 2020, 72(1): 104-118. DOI:10.1016/j.jhep.2019.08.035 |
| [23] |
BEMPT M V, DEMEYER S, BROUX M, et al. Cooperative enhancer activation by TLX1 and STAT5 drives development of NUP214-ABL1/TLX1-positive T cell acute lymphoblastic leukemia[J]. Cancer Cell, 2018, 34(2): 271-285. DOI:10.1016/j.ccell.2018.07.007 |
| [24] |
BEDNARZ-MISA I, BROMKE M A, KRZYSTEK-KORPACKA M. Interleukin (IL)-7 signaling in the tumor microenvironment[M]//BIRBRAIR A. Tumor Microenvironment. Cham: Springer, 2021: 9-49.
|
| [25] |
VILLARINO A V, KANNO Y, O'SHEA J J. Mechanisms and consequences of Jak-STAT signaling in the immune system[J]. Nat Immunol, 2017, 18(4): 374-384. DOI:10.1038/ni.3691 |
(编辑 白永平)



