2. 北京优帝鸽业有限公司, 北京 101300
2. Beijing Youdi Pigeon Company, Beijing 101300, China
鸽毛滴虫(Trichomonas gallinae,T. gallinae)是一种单细胞生物[1],多数呈梨形,大小为7~11 μm[2],核为卵形,直径为2.5~3.0 μm[3]。其是一类独特的兼性厌氧性原虫,缺乏经典的线粒体氧化发酵位点,具有氢化酶体[4],在合适的体外培养条件下,以滋养体的形式存在,并通过前端的鞭毛摆动而进行运动[4]。鸽毛滴虫病是肉鸽养殖中一种常见的寄生虫病,主要感染口腔、咽、食管和嗉囊等消化道组织。鸽毛滴虫传播广泛并易引起继发感染,进而造成重大的经济损失。据报道,西欧和南欧地区白羽王鸽的毛滴虫感染率可达95%[5]。目前,生产上常使用药物治疗鸽毛滴虫病,容易引起耐药性及药物残留[6]。
1983年,Johnstone等[7]在研究绵羊网织红细胞体外成熟过程中首次发现了一种可被分泌到细胞外部的囊泡,随后将这种囊泡命名为“exosomes”,即外泌体[8]。外泌体与微囊泡、凋亡小体、高密度脂蛋白和低密度脂蛋白都属于细胞外囊泡,主要区别在于形态大小的不同[9]。微囊泡直径200~2 000 nm,凋亡小体直径500~2 000 nm,低密度脂蛋白21~27 nm,高密度脂蛋白7~13 nm,外泌体直径40~200 nm。其确切的形成机制存在分歧,但大多数学者认为,细胞膜内陷形成包含信息物质的内吞小泡,内吞小泡相互融合形成多泡体,多泡体与细胞质膜融合后向外释放外泌体[10]。相关研究均证明了外泌体可作为细胞间交流的一种新介质。外泌体主要包含核酸、蛋白质和脂质等物质[11-12]。核酸多是具有调控功能的小RNA,可稳定存在并被囊泡运输进入细胞,参与细胞的表观遗传调控[13-14]。外泌体中的一些蛋白质具有较高的细胞特异性,可作为某些疾病的生物标记物[15-16]。近几年,外泌体作为重要的生物标记物和信息传递介质,为人类癌症和HIV等疑难杂症的诊断和靶向治疗提供了新的契机[17-18]。
畜禽养殖过程中,寄生虫病严重影响畜禽健康,是养殖业中传播快且危害大的重要疾病之一,目前主要依赖药用植物提取物和化学合成药物进行预防和治疗。寄生虫与宿主之间的相互作用关系复杂,大多数寄生虫都能分泌外泌体(即虫源外泌体)[19-21]。虫源外泌体可作为寄生虫与宿主之间联系的纽带,一方面,寄生虫在多种机制刺激下产生外泌体,外泌体包裹着大量的虫源信息进入宿主体液及细胞内,进而影响宿主的免疫系统,抑制炎症反应,改善其寄生环境;另一方面,外泌体可直接携带有毒有害物质进入到宿主循环系统[22]。因此,推测鸽毛滴虫可产生外泌体,并在其寄生过程中发挥重要的作用。本研究使用超速离心法分离外泌体,通过透射电子显微镜、纳米颗粒追踪分析及Western blot方法鉴定外泌体,并对虫源外泌体进行蛋白质谱分析。此研究有助于从外泌体蛋白质组层面解析鸽毛滴虫的寄生机制,可作为鸽毛滴虫病诊疗的新切入点,促进肉鸽产业的健康发展。
1 材料与方法 1.1 虫株制备根据临床症状选择患有鸽毛滴虫病的白羽王鸽,用生理盐水润湿并经紫外线杀菌的医用棉签,蘸取病鸽口腔及咽部的病灶采集鸽毛滴虫。将采集到的鸽毛滴虫接种于10 mL的TF培养基中[23],包括10%胎牛血清和1%青链霉素双抗,pH为7.2,37 ℃恒温培养。原代培养的鸽毛滴虫使用差速离心法去除细胞或组织污染,经percoll密度梯度离心法去除杂菌污染[24]:将鸽毛滴虫培养液800 r·min-1离心3 min,将上清液转移至另一无菌离心管中,3 000 r·min-1离心6 min得到鸽毛滴虫沉淀,重悬于完全TF培养基中进行培养。24 h后,在无菌离心管中依次缓慢加入80%、60%和40%的percoll溶液各3 mL,鸽毛滴虫培养液3 mL加至最上层液面,2 500 r·min-1离心30 min后取第2和3层中间的乳白色带,重悬于10 mL完全TF培养基中进行培养,即可得到纯化后的鸽毛滴虫虫株。
1.2 虫株镜检鉴定1.2.1 光学显微镜观察 将鸽毛滴虫培养液在100倍光学显微镜下观察。然后制作鸽毛滴虫涂片,以甲醛固定,并用吉姆萨染色液(G1010,北京索莱宝科技有限公司)染色,冲洗晾干后, 置于400倍光学显微镜下, 观察虫体形态。
1.2.2 扫描电子显微镜观察 将对数生长期的虫株培养液3 000 r·min-1离心6 min,收集沉淀物;用37 ℃预热的PBS重悬,3 000 r·min-1离心6 min,重复两次;以2.5%戊二醛固定虫体,用PBS洗涤3次,每次10 min;分别用30%、50%、75%、90%、95%和100%的乙醇脱水,每次10 min;干燥12 h后,在扫描电子显微镜(SU-1510,Hitachi,日本)下,观察虫体形态。
1.3 DNA提取及测序1.3.1 DNA提取 取对数生长期的虫株悬液于1.5 mL离心管中,使用EasyPureⓇ Genomic DNA Kit (EE101-11,全式金生物技术有限公司),依据说明书提取基因组DNA,置4 ℃保存备用。
1.3.2 PCR扩增及电泳 ITS1/5.8S/ITS2基因是鸽毛滴虫的标志基因[25-26],根据其在NCBI GenBank中的序列(登录号:KP900042)设计引物,序列:F:5′-TGCTTCAGCTCAGCGGGTCTTCC-3′;R:5′-CGGTAGGTGAACCTGCCGTTGG-3′。PCR反应体系:2×Taq PCR MasterMix 10 μL,上、下游引物各0.5 μL,DNA模板1.5 μL,加灭菌水补至20 μL。反应条件:94 ℃预变性3 min;94 ℃ 30 s,58.7 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃延伸8 min。取PCR产物10 μL进行10 g·L-1琼脂糖凝胶电泳,切胶回收后送北京六合华大基因科技有限公司测序,测序结果在NCBI数据库中进行BLAST比对。
1.4 外泌体提取参照Twu和Johnson[27]的方法,使用含10%胎牛血清的TF完全培养基培养鸽毛滴虫,然后用PBS溶液离心洗涤3次以去除血清,获得的鸽毛滴虫再使用无血清培养基培养4 h,收集培养液用于提取外泌体。用0.22 μm的滤膜过滤培养液,滤液以31 000 r·min-1离心70 min(Beckman Optima LE-80K Ultracentrifuge,美国),沉淀物用2 mL预冷PBS重悬,再以31 000 r·min-1离心70 min,沉淀物用100~300 μL预冷PBS重悬,即可得到外泌体。
1.5 外泌体鉴定1.5.1 透射电子显微镜观察形态 将外泌体吸附到带电的碳涂覆的铜网上,用1%乙酸铀酰染色1~2 min,去除残留液体,自然干燥后,使用透射电子显微镜(H-7500,Hitachi,日本)观察。
1.5.2 纳米颗粒跟踪分析(nanoparticle tracking analysis, NTA)分析粒径 将2 μL的外泌体溶解在1 mL PBS中,测定外泌体粒径大小和粒径分布(ZetaView Particle Metrix,德国)。
1.5.3 Western blot检测标记蛋白 取20 μg总蛋白95 ℃变性10 min,4%~12% SDS-PAGE电泳分离,转膜(PVDF,0.22 μm)。用5%脱脂奶粉室温摇床封闭1 h,分别加入单克隆抗体CD63(ab217345,Abcam,英国)、CD9(A1703,ABclonal,武汉)、TSG101(ABP56454,Abbkine,美国)、HSP70(ab2787,Abcam,英国)和ALIX(ab225555,Abcam,英国)。所有一抗均按照1:1 500稀释,室温下摇床孵育1 h。随后TBST清洗,再分别加入山羊抗鼠IgG二抗(A9044,Sigma-Aldrich,英国)和山羊抗兔IgG二抗(A9169,Sigma-Aldrich,英国),二抗均按照1:5 000稀释,室温下摇床孵育1 h,TBST清洗,使用天能Western blot超敏化学发光显色液(180-501,Tanon,上海)显色后采集图像(Tanon-5200Multi,上海)。
1.6 外泌体蛋白质谱分析1.6.1 蛋白质提取及浓度测定 将400 μL蛋白裂解液加入到200 μL外泌体溶液中,在冰水上进行超声波破碎,每运行2 s,间隔10 s,重复6次;冰上放置20 min,8 000 r·min-1离心30 min,取上清转入新管,4 ℃保存备用。使用BCA蛋白定量检测试剂盒(PA115-01,天根生化科技有限公司),依据说明书进行蛋白定量。使用酶标仪(SpectraMAX M2/M2e,美国)测定562 nm处的吸光度。根据标准曲线计算出样品的蛋白浓度。
1.6.2 外泌体全蛋白分布情况观察 取10和20 μg外泌体蛋白95 ℃变性10 min,在120 V恒压下经4%~12% SDS-PAGE电泳分离90 min。用考马斯亮蓝在摇床上染色20 min,用脱色液脱色3次,每次30 min,再加入双蒸水终止脱色,观察外泌体全蛋白分布情况。
1.6.3 蛋白质谱分析 取200 μL外泌体蛋白溶液置于离心管中,加入5 μL 1 mol·L-1 Dithiothreitol溶液混匀,37 ℃孵育1 h;加入20 μL 1 mol·L-1 Iodoacetamide溶液,充分混匀,暗室室温反应1 h;37 ℃胰蛋白酶溶液水浴消化样品12 h。收集肽段并在真空离心机中干燥,重悬并以8 500 r·min-1离心5 min,样品待用。串联质谱使用Orbitrap Fusion(Thermo Fisher Scientific,美国)分析,富集柱型号为AcclaimTM PepMapTM 100 C18 75 μm×2 cm×3 μm,分析柱型号为AcclaimTM PepMapTM 100 C18 75 μm×25 cm×2 μm,流动相A为95%水+5%乙腈+ 0.1%甲酸,流动相B为85%乙腈+15%水+ 0.1%甲酸,富集柱流速为8 μL·min-1,分析柱流速为300 μL·min-1,进行Label-free蛋白质谱分析。
1.6.4 生物信息学分析 使用pFind(pFind version 3.1.6)软件进行蛋白质谱分析,与UniProt蛋白质数据库中Trichomonas vaginalis蛋白质组进行比对(https://www.uniprot.org/proteomes/UP000001542)。使用胰蛋白酶P消化,固定修饰为半胱氨酸碘乙酰胺化(carbamidomethyl),可变修饰为蛋氨酸氧化(oxidation),母离子最大容许误差为5 ppm,碎片离子最大容许误差为0.5 u,Max Missed Cleavages为2,过滤条件为FDR < 1%,筛选出可信的蛋白质。利用David在线分析软件(https://david.ncifcrf.gov/)完成GO功能注释和KEGG通路富集分析。采用R语言3.6.1的ggplot2软件包和GO plot软件包进行图形可视化。
2 结果 2.1 鸽毛滴虫的鉴定2.1.1 显微镜观察 将鸽毛滴虫培养物采用光学显微镜放大100倍观察,培养体系纯净,虫体呈梨形或卵圆形,游动速度较快(图 1A)。虫体经吉姆萨染色后,采用光学显微镜放大400倍观察,可清晰地观察到虫体形态(图 1B)。采用扫描电子显微镜放大5 000倍观察,可见虫体长5~10 μm、宽4~8 μm,有4根前鞭毛和1根后鞭毛,侧边有明显的波动膜(图 1C)。

|
A.采用光学显微镜观察的鸽毛滴虫(100×);B.采用光学显微镜观察的吉姆萨染色后的鸽毛滴虫(400×);C.采用扫描电子显微镜观察的鸽毛滴虫(5 000×),箭头所指处为波动膜结构 A. T. gallinae was observed by light microscope (100×); B. T. gallinae after gamsa staining was observed by light microscope (400×); C. Scanning electron microscope image of T. gallinae (5 000×), and the arrow pointed the wave membrane structure 图 1 鸽毛滴虫显微镜鉴定 Fig. 1 Microscopic identification of T. gallinae |
2.1.2 DNA提取及测序 经PCR扩增ITS1/5.8S/ITS2基因后,琼脂糖凝胶电泳的结果见图 2,由图可见,电泳片段条带明显,长度在250~500 bp。经测序,片段长度为343 bp,在NCBI数据库中进行BLAST比对,结果见表 1,扩增产物与鸽毛滴虫ITS1/5.8S/ITS2基因具有98.43%的相似性。

|
M. DNA相对分子质量标准;1~2.目的基因PCR产物;两个泳道上样量均为10 μL M. DNA marker; 1-2. PCR products of target gene; Loading quality of both lanes were 10 μL 图 2 ITS1/5.8S/ITS2基因扩增 Fig. 2 Amplification of ITS1/5.8S/ITS2 gene |
|
|
表 1 测序产物与ITS1/5.8S/ITS2基因BlAST结果 Table 1 BLAST results of sequencing products and ITS1/5.8 S/ITS2 gene |
通过超速离心法提取得到的沉淀物经透射电子显微镜负染观察,可见明显的茶托样结构(图 3A)。Western blot结果显示,CD63、CD9、TSG101、HSP70和ALIX外泌体标记蛋白的条带较明显(图 3B)。NTA结果显示,Median(50×)为125.1 nm,即外泌体的粒径集中于125.1 nm(图 3C),峰值粒径132.3 nm,占比99.3%(图 3D)。结果表明,鸽毛滴虫培养液经超速离心法提取后得到的沉淀物为外泌体。
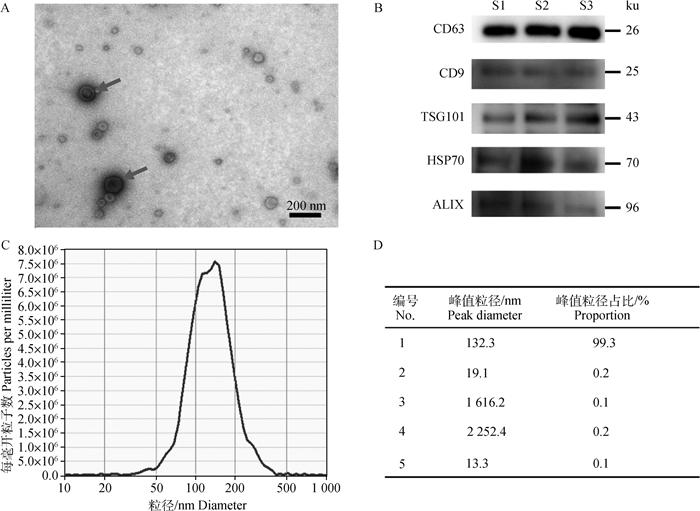
|
A.透射电子显微镜下的鸽毛滴虫外泌体,粒径100 nm左右;B. Western blot鉴定到的5种外泌体标记蛋白,S1~S3.鸽毛滴虫外泌体;C.纳米颗粒追踪分析的粒径分布;D.峰值粒径分布及占比 A. Exosomes derived from T. gallinae were observed by transmission electron microscopy. Particle size was about 100 nm; B. Five specific protein of exosomes targets were detected by Western blot. S1-S3. Exosomes derived from T. gallinae; C. Diameter distribution measured by NTA.; D. Peak diameter and its proportion were shown 图 3 鸽毛滴虫外泌体的鉴定 Fig. 3 Identification of exosomes derived from T. gallinae |
2.3.1 SDS-PAGE电泳 经BCA蛋白浓度测定,虫源外泌体的蛋白质浓度为0.3 μg·μL-1。如图 4所示,全蛋白分布在15~180 ku,其中,70 ku左右存在较明显的条带。
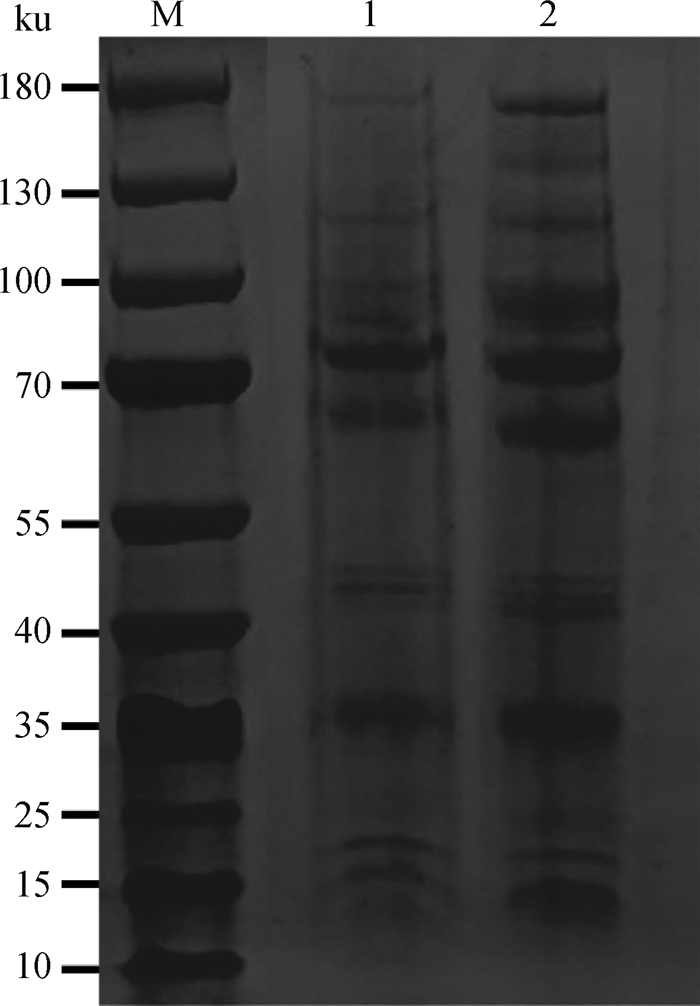
|
M.预染蛋白marker;1~2.外泌体全蛋白;1号泳道上样量为10 μg,2号泳道上样量为20 μg M. SDS-PAGE band profile of the PageRuler Prestained Protein Ladder; 1-2. Proteins of exosomes derived from T. gallinae; Loading quantity was 10 μg for lane 1 and 20 μg for lane 2 图 4 鸽毛滴虫外泌体全蛋白分布 Fig. 4 Distribution of total proteins of exosomes derived from T. gallinae |
2.3.2 蛋白质谱分析 通过与UniProt数据库中阴道毛滴虫的数据比对,可以得到171个蛋白,分布于49个蛋白家族。这些蛋白质包含烯醇酶-3、3-磷酸甘油醛脱氢酶(GAPDH)、磷酸烯醇丙酮酸羧激酶和磷酸甘油酸激酶等生化代谢酶,Ras蛋白家族、小GTP结合蛋白等ATP相关蛋白,热休克蛋白等应激反应相关蛋白及14-3-3蛋白、泛素蛋白等其他类型的蛋白质。其中,烯醇酶、GAPDH、磷酸甘油酸变位酶和延伸因子为表达量较高的蛋白质。GO功能注释显示,外泌体蛋白富集到细胞内和细胞质等细胞组分,发挥GTP连接和GTP酶活性,并参与小GTPase介导的信号转导与糖酵解等过程(图 5)。KEGG通路富集表明,外泌体蛋白质主要富集于代谢途径、糖酵解/糖异生和生物合成等通路(图 6)。
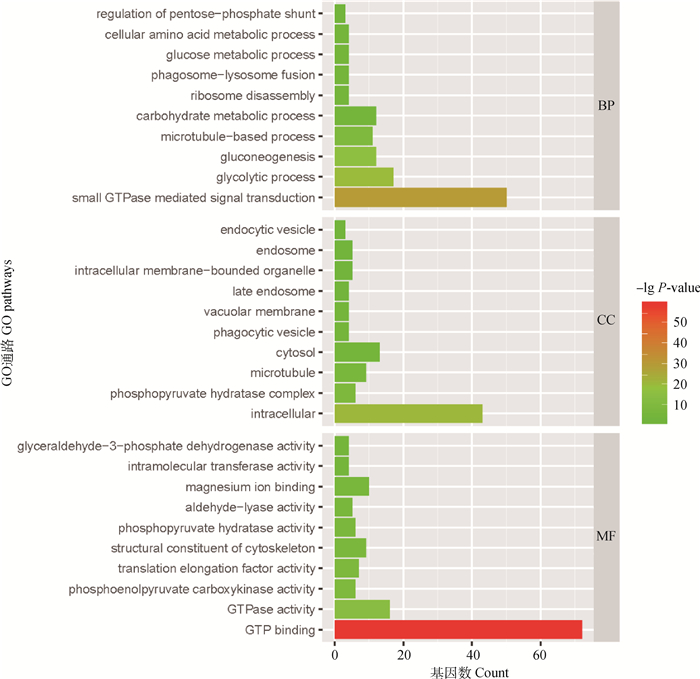
|
使用R语言的ggplot2软件包和GO plot软件包对鸽毛滴虫外泌体蛋白质进行GO功能注释,显著富集到生物过程(BP),细胞成分(CC)和分子功能(MF)中的通路 Packages ggplot2 and GO plot of R language were used to perform GO functional analysis on proteins of exosomes. Pathways significantly enriched in biological processes (BP), cellular components (CC) and molecular functions (MF) were shown 图 5 鸽毛滴虫外泌体蛋白质的GO功能注释 Fig. 5 GO functional analysis of proteins of exosomes derived from T. gallinae |
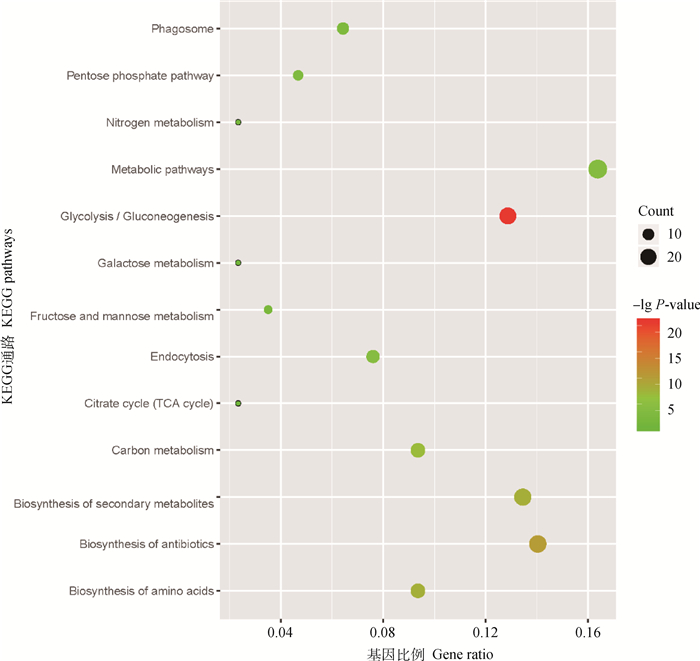
|
使用R语言的ggplot2软件包对鸽毛滴虫外泌体蛋白质进行KEGG通路富集分析,气泡的大小和颜色表示基因数目和显著程度 Package ggplot2 of R language was used to perform KEGG enrichment analysis on proteins of exosomes. Size and color of the bubble represented amount of genes enriched in the pathway and enrichment significance, respectively 图 6 鸽毛滴虫外泌体蛋白质的KEGG通路富集 Fig. 6 KEGG enrichment analysis of proteins of exosomes derived from T. gallinae |
鸽毛滴虫病是在肉鸽养殖中较为严重的传染性寄生虫病,目前的研究主要集中于该病的诊断、治疗及流行病学研究。本研究发现鸽毛滴虫可以分泌虫源外泌体,并通过质谱分析鉴定了虫源外泌体蛋白质的组成及功能。
从病鸽的病灶处分离并培养得到的虫株,经光学显微镜观察可见游动的毛滴虫,经扫描电子显微镜观察具有鞭毛和波动膜结构[2];随后通过基因序列比对,虫株与NCBI已报道的鸽毛滴虫ITS1/5.8S/ITS2基因的比对率高达98%,表明我们分离所得的物质为鸽毛滴虫[25]。超速离心法为分离提取外泌体的主要方法[9, 28],参照Twu等[27]的方法,将培养毛滴虫的TF完全培养基替换为无血清培养基,去除血清外泌体的干扰,再将收集到的虫株培养液进行超速离心。本研究将虫源外泌体负染后,经透射电子显微镜观察到的提取物具有茶托样结构,与前人报道结果[29-30]一致;Western blot鉴定到CD63、CD9、TSG101、HSP70和ALIX等多个外泌体的标记蛋白[9];NTA结果显示外泌体粒径集中于125.1 nm,符合外泌体粒径小于150 nm的要求[31]。通常形态观察、特异性标记蛋白检测及NTA分析3种方法同时应用于鉴定外泌体[28],因此本研究通过超速离心法分离得到了鸽毛滴虫外泌体。
外泌体作为细胞间交流的一种途径,可以将来自寄生虫的某些信息物质传递至靶细胞或其他寄生虫,蛋白质组成的差异赋予了外泌体不同的生物学特性。本研究通过蛋白质谱分析了鸽毛滴虫外泌体的蛋白质组成,其中,包括烯醇酶、GAPDH、14-3-3蛋白、泛素蛋白和延伸因子等,大多数蛋白质在柔嫩艾美耳球虫外泌体中也得到了鉴定[32],这些蛋白质在不同来源的外泌体中较为保守,推测鸽毛滴虫外泌体与其他虫源外泌体可能发挥着类似的作用。烯醇酶是寄生虫毒力因子纤溶酶原的受体分子,可促进寄生虫入侵宿主细胞[33],并调控宿主细胞的基因表达[34],可作为潜在药物靶标用于疟疾、弓形虫病、泰勒虫病及锥虫病的治疗[35-36]。14-3-3蛋白促进疟原虫感染宿主细胞[37],介导弓形虫和血吸虫的信号转导[38-39],并改变柔嫩艾美耳球虫的能量代谢[40]。泛素蛋白可调控亚洲带绦虫的细胞增殖、DNA修复、细胞凋亡、信号转导及抗原递呈等生物学过程[41]。延伸因子、GAPDH和热休克蛋白家族等蛋白质也可作为其他寄生虫病的免疫诊断和药物治疗靶点[42-44]。因此,从本研究鉴定到的蛋白质的功能分析,虫源外泌体可参与寄生虫的入侵,并调控宿主的基因表达和能量代谢,且外泌体中的某些蛋白质可以作为鸽毛滴虫病的分子靶标,为鸽毛滴虫病的诊断和治疗提供新的思路。GO功能注释表明,鸽毛滴虫外泌体的蛋白质与能量代谢、生物合成及信号转导等功能相关。KEGG富集通路分析显示,外泌体蛋白质可富集于抗生素的生物合成,表明鸽毛滴虫可能通过分泌外泌体对抗其他病原微生物,促进其寄生;同时还富集于内吞作用和吞噬体,进一步证明了外泌体具有信息传递的功能,在柔嫩艾美耳球虫和亚洲带绦虫等寄生虫的研究中也有类似的报道[32, 45]。虫源外泌体可表达并分泌重要的蛋白质,在细胞间发挥信息传递作用,这些蛋白质的具体功能亟待进一步研究。
4 结论本研究从病鸽的口腔和咽喉的病灶中分离并培养了鸽毛滴虫,通过超速离心法提取得到鸽毛滴虫外泌体,并对虫源外泌体进行了蛋白质谱分析。虫源外泌体的蛋白质可能在寄生虫的能量代谢、信号转导及生物合成等过程中发挥重要作用,表明外泌体在寄生虫与宿主的相互作用中扮演着关键的角色。该研究为鸽毛滴虫外泌体的研究奠定了基础,并为鸽毛滴虫病的诊疗提供了新的思路。
| [1] | CEPICKA I, HAMPL V, KULDA J. Critical taxonomic revision of parabasalids with description of one new genus and three new species[J]. Protist, 2010, 161(3): 400–433. DOI: 10.1016/j.protis.2009.11.005 |
| [2] | MEHLHORN H, AL-QURAISHY S, AZIZA A, et al. Fine structure of the bird parasites Trichomonas gallinae and Tetratrichomonas gallinarum from cultures[J]. Parasitol Res, 2009, 105(3): 751–756. DOI: 10.1007/s00436-009-1451-8 |
| [3] | CLARK S, DE-GUSSEM K, BARNES J. Flagellated protozoan infections in turkeys[J]. World Poultry, 2003, 19(4): 1–4. |
| [4] | MÜLLER M. The hydrogenosome[J]. J Gener Microbiol, 1993, 139(12): 2879–2889. DOI: 10.1099/00221287-139-12-2879 |
| [5] | MARX M, REINER G, WILLEMS H, et al. High prevalence of Trichomonas gallinae in wild columbids across western and southern Europe[J]. Parasit Vectors, 2017, 10(1): 242. |
| [6] | FRANSSEN F F J, LUMEIJ J T. In vitro nitroimidazole resistance of Trichomonas gallinae and successful therapy with an increased dosage of ronidazole in racing pigeons (Columba livia domestica)[J]. J Vet Pharmacol Ther, 1992, 15(4): 409–415. DOI: 10.1111/j.1365-2885.1992.tb01032.x |
| [7] | JOHNSTONE R M, ADAM M, PAN B T. The fate of the transferrin receptor during maturation of sheep reticulocytes in vitro[J]. Can J Biochem Cell Biol, 1983, 62(11): 1246–1254. |
| [8] | JOHNSTONE R M, MATHEW A, MASON A B, et al. Exosome formation during maturation of mammalian and avian reticulocytes:evidence that exosome release is a major route for externalization of obsolete membrane proteins[J]. J Cell Physiol, 1991, 147(1): 27–36. DOI: 10.1002/jcp.1041470105 |
| [9] | SHAO H L, IM H, CASTRO C M, et al. New technologies for analysis of extracellular vesicles[J]. Chem Rev, 2018, 118(4): 1917–1950. DOI: 10.1021/acs.chemrev.7b00534 |
| [10] | SZEMPRUCH A J, DENNISON L, KIEFT R, et al. Sending a message:extracellular vesicles of pathogenic protozoan parasites[J]. Nat Rev Microbiol, 2016, 14(11): 669–675. DOI: 10.1038/nrmicro.2016.110 |
| [11] | VALADI H, EKSTRÖM K, BOSSIOS A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007, 9(6): 654–659. DOI: 10.1038/ncb1596 |
| [12] | KRUGER S, ELMAGEED Z Y A, HAWKE D H, et al. Molecular characterization of exosome-like vesicles from breast cancer cells[J]. BMC Cancer, 2014, 14(1): 44. DOI: 10.1186/1471-2407-14-44 |
| [13] | WAHLGREN J, STATELLO L, SKOGBERG G, et al. Delivery of small interfering RNAs to cells via exosomes[J]. Methods Mol Biol, 2016, 1364: 105–125. |
| [14] |
林德麟, 陈婷, 黎梦, 等. 乳中miRNA的研究进展[J]. 畜牧兽医学报, 2016, 47(9): 1739–1748.
LIN D L, CHEN T, LI M, et al. Research progress of miRNA in milk[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(9): 1739–1748. (in Chinese) |
| [15] | CHEN I H, XUE L, HSU C C, et al. Phosphoproteins in extracellular vesicles as candidate markers for breast cancer[J]. Proc Natl Acad Sci U S A, 2017, 114(12): 3175–3180. DOI: 10.1073/pnas.1618088114 |
| [16] | KALRA H, ADDA C G, LIEM M, et al. Comparative proteomics evaluation of plasma exosome isolation techniques and assessment of the stability of exosomes in normal human blood plasma[J]. Proteomics, 2013, 13(22): 3354–3364. DOI: 10.1002/pmic.201300282 |
| [17] | BELL B M, KIRK I D, HILTBRUNNER S, et al. Designer exosomes as next-generation cancer immunotherapy[J]. Nanomed: Nanotechnol Biol Med, 2016, 12(1): 163–169. DOI: 10.1016/j.nano.2015.09.011 |
| [18] | KIM M S, HANEY M J, ZHAO Y L, et al. Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells[J]. Nanomed: Nanotechnol Biol Med, 2016, 12(3): 655–664. DOI: 10.1016/j.nano.2015.10.012 |
| [19] | COUPER K N, BARNES T, HAFALLA J C R, et al. Parasite-derived plasma microparticles contribute significantly to malaria infection-induced inflammation through potent macrophage stimulation[J]. PLoS Pathog, 2010, 6(1): e1000744. DOI: 10.1371/journal.ppat.1000744 |
| [20] | GEIGER A, HIRTZ C, BÉCUE T, et al. Exocytosis and protein secretion in Trypanosoma[J]. BMC Microbiol, 2010, 10: 20. DOI: 10.1186/1471-2180-10-20 |
| [21] | TWU O, DE MIGUEL N, LUSTIG G, et al. Trichomonas vaginalis exosomes deliver cargo to host cells and mediate host:parasite interactions[J]. PLoS Pathog, 2013, 9(7): e1003482. DOI: 10.1371/journal.ppat.1003482 |
| [22] |
倪爱心, 麻慧, 陈继兰. 寄生虫来源的外泌体研究进展[J]. 畜牧兽医学报, 2019, 50(5): 909–917.
NI A X, MA H, CHEN J L. Research progress of parasite-derived exosomes[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(5): 909–917. (in Chinese) |
| [23] | DIAMOND L S. The establishment of various trichomonads of animals and man in axenic cultures[J]. J Parasitol, 1957, 43(4): 488–490. |
| [24] |
孟莹.犬源毛滴虫的分离鉴定及其生物学特性研究[D].长春: 吉林大学, 2013: 18-19.
MENG Y. Identification and biological characteristics of a Trichomonad isolate from dog[D]. Changchun: Jilin University, 2013: 18-19. (in Chinese) |
| [25] | FENG S Y, CHANG H, LI F H, et al. Prevalence and molecular characterization of Trichomonas gallinae from domestic pigeons in Beijing, China[J]. Infect, Genet Evol, 2018, 65: 369–372. DOI: 10.1016/j.meegid.2018.08.021 |
| [26] | FELLEISEN R S J. Comparative sequence analysis of 5.8S rRNA genes and internal transcribed spacer (ITS) regions of trichomonadid protozoa[J]. Parasitology, 1997, 115(2): 111–119. DOI: 10.1017/S0031182097001212 |
| [27] | TWU O, JOHNSON P J. Parasite extracellular vesicles:mediators of intercellular communication[J]. PLoS Pathog, 2014, 10(8): e1004289. DOI: 10.1371/journal.ppat.1004289 |
| [28] |
王前, 郑磊.
细胞外囊泡—基础研究与临床应用[M]. 北京: 科学出版社, 2019: 37-66.
WANG Q, ZHENG L. Extracellular vesicles-basic research and clinical application[M]. Beijing: Science Press, 2019: 37-66. (in Chinese) |
| [29] | RAPOSO G, STOORVOGEL W. Extracellular vesicles: exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200(4): 373–383. DOI: 10.1083/jcb.201211138 |
| [30] |
张亮, 王帅帅, 陈忍霞, 等. 猪繁殖与呼吸综合征病毒感染的MARC-145细胞中外泌体的分离与鉴定[J]. 畜牧兽医学报, 2017, 48(7): 1300–1305.
ZHANG L, WANG S S, CHEN R X, et al. Separation and identification of exosomes from MARC-145 cells infected with porcine reproductive and respiratory syndrome virus[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(7): 1300–1305. (in Chinese) |
| [31] | GURUNATHAN S, KANG M H, JEYARAJ M, et al. Review of the isolation, characterization, biological function, and multifarious therapeutic approaches of exosomes[J]. Cells, 2019, 8(4): 307. DOI: 10.3390/cells8040307 |
| [32] |
李志行.柔嫩艾美耳球虫外泌体的分离与鉴定及泛素蛋白功能初步研究[D].上海: 上海师范大学, 2019: 27-29.
LI Z X. Isolation and Identification of Eimeria tenella exosomes and preliminary study on the function of ubiquitin[D]. Shanghai: Shanghai Normal University, 2019: 27-29. (in Chinese) |
| [33] | PAL BHOWMICK I, KUMAR N, SHARMA S, et al. Plasmodium falciparum enolase: stage-specific expression and sub-cellular localization[J]. Malar J, 2009, 8: 179. DOI: 10.1186/1475-2875-8-179 |
| [34] | RUAN J P, MOUVEAUX T, LIGHT S H, et al. The structure of bradyzoite-specific enolase from Toxoplasma gondii reveals insights into its dual cytoplasmic and nuclear functions[J]. Acta Crystallogr, 2015, D71: 417–426. |
| [35] | CAYIR E, ERDEMIR A, OZKAN E, et al. Cloning of intron-removed enolase gene and expression, purification, kinetic characterization of the enzyme from Theileria annulata[J]. Mol Biotechnol, 2014, 56(8): 689–696. DOI: 10.1007/s12033-014-9747-z |
| [36] | DE A. S., NAVARRO M V, GOMES DIAS S M, MELLO L V, et al. Structural flexibility in Trypanosoma brucei enolase revealed by X-ray crystallography and molecular dynamics[J]. FEBS J, 2007, 274(19): 5077–5089. DOI: 10.1111/j.1742-4658.2007.06027.x |
| [37] | JEANCLOS E M, LIN L, TREUIL M W, et al. The chaperone protein 14-3-3η interacts with the nicotinic acetylcholine receptor α4 subunit evidence for a dynamic role in subunit stabilization[J]. J Biol Chem, 2001, 276(30): 28281–28290. DOI: 10.1074/jbc.M011549200 |
| [38] |
都建, 沈继龙, 汪学龙, 等. 弓形虫信号转导蛋白14-3-3基因的克隆与表达[J]. 中国寄生虫学与寄生虫病杂志, 2003, 21(5): 279–281.
DU J, SHEN J L, WANG X L, et al. Cloning and expression of the signaling protein 14-3-3 of Toxoplasma gondii[J]. Chinese Journal of Parasitology and Parasitic Diseases, 2003, 21(5): 279–281. DOI: 10.3969/j.issn.1000-7423.2003.05.007 (in Chinese) |
| [39] |
刘庆中, 沈继龙. 日本血吸虫重组信号蛋白14-3-3疫苗免疫保护性的观察[J]. 中国寄生虫学与寄生虫病杂志, 2003, 21(5): 257–260.
LIU Q Z, SHEN J L. Protective immunity induced by recombinant signaling protein 14-3-3 vaccine of Schistosoma japonicum[J]. Chinese Journal of Parasitology and Parasitic Diseases, 2003, 21(5): 257–260. DOI: 10.3969/j.issn.1000-7423.2003.05.001 (in Chinese) |
| [40] | SILES-LUCAS M. The 14-3-3 protein:a key molecule in parasites as in other organisms[J]. Trends Parasitol, 2003, 19(12): 575–581. DOI: 10.1016/j.pt.2003.10.003 |
| [41] |
廖兴江, 戴佳琳, 周灵贵, 等. 亚洲牛带绦虫泛素缀合酶基因及其蛋白质结构与功能的生物信息学分析[J]. 中国人兽共患病学报, 2009, 25(3): 234–237.
LIAO X J, DAI J L, ZHOU L G, et al. Bioinformatics analysis of structure and characteristics of the gene and protein of ubiquitin-conjugated enzyme from Taenia asiatica[J]. Chinese Journal of Zoonoses, 2009, 25(3): 234–237. DOI: 10.3969/j.issn.1002-2694.2009.03.008 (in Chinese) |
| [42] |
王强, 李勉, 张龙现. 热休克蛋白与寄生虫感染的关系[J]. 中国畜牧兽医, 2009, 36(6): 133–136.
WANG Q, LI M, ZHANG L X. The relationship between heat shock proteins and parasite infection[J]. China Animal Husbandry & Veterinary Medicine, 2009, 36(6): 133–136. (in Chinese) |
| [43] | PEREZ-CASAL J, POTTER A A. Glyceradehyde-3-phosphate dehydrogenase as a suitable vaccine candidate for protection against bacterial and parasitic diseases[J]. Vaccine, 2016, 34(8): 1012–1017. DOI: 10.1016/j.vaccine.2015.11.072 |
| [44] |
李超群, 樊海宁, 张耀刚, 等. 细粒棘球绦虫延伸因子1生物信息学分析[J]. 中国公共卫生, 2017, 33(4): 607–610.
LI C Q, FAN H N, ZHANG Y G, et al. Property and structure of elongation factor 1 in Echinococcus granulous, a bioinformatics analysis[J]. Chinese Journal of Public Health, 2017, 33(4): 607–610. (in Chinese) |
| [45] |
梁盼红.亚洲带绦虫外泌体的分离鉴定及其对LoVo细胞的影响[D].北京: 中国农业科学院, 2019: 31-32.
LIANG P H. Isolation and identification of exosomes from Taenia asiatica and their effects on LoVo cells[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019: 31-32. (in Chinese) |



