2. 唐山市畜牧技术推广站, 唐山 063000;
3. 唐山市古冶区农业农村局, 古冶 063100;
4. 衡水市畜牧技术推广站, 衡水 053000
2. Tangshan Animal Husbandry Technology Promotion Station, Tangshan 063000, China;
3. Burreau of Agriculture and Rural Affairs of Guye District, Tangshan City, Guye 063100, China;
4. Hengshui Animal Husbandry Technology Promotion Station, Hengshui 053000, China
羊肉具有低脂肪、高蛋白、低胆固醇、绿色健康等优点,是我国居民特别是少数民族城乡居民不可或缺的肉类食品。目前,培育专门化的肉羊品种或利用杂种优势是提高羊产肉性能的主要途径。众所周知,培育专门化的肉羊品种,历时较长,而进行品种间杂交利用杂种优势提高羊产肉性能是当前最快且使用较多的方法[1]。澳洲白羊(AWF sheep)、杜泊羊(Dorper sheep)和夏洛莱羊(Charolais sheep)均是较好的肉用绵羊品种。澳洲白羊具有全年发情、生长快、成熟早、体型大、肉质好、抗逆性强等优良特点[2-3];杜泊羊具有食性广、胴体瘦肉率高、肉质好、适于肥羔生产等优点[4-5];夏洛莱羊具有早熟、生长发育快、泌乳力强、体重大、肥育性能好等诸多优点,而且它是当今世界上最优秀的大型肉用绵羊品种[6-7]。小尾寒羊是我国优良地方绵羊品种的典型代表,具有体格大、性成熟早、全年发情、产羔率高等优点,常作肉羊杂交生产的母本[4, 7-8]。
CLPG基因的全称为Callipyge,是近年来人们关注度较高的动物“双肌”性状候选基因[9-10],也是一个影响动物肌肉生长和肉质嫩度的功能基因[11-14],其变异对动物体重、体尺等生长性能均有显著影响,在绵羊、山羊和牛上均有相关报道[10-12, 15-17]。
近年来,有关通过引进肉羊品种与小尾寒羊的杂交报道较多,均取得了较好的杂交效果,但大部分都是利用单一优质肉羊品种与小尾寒羊杂交,仅从表型性状方面比较了杂交后代与纯繁后代的生产性能[2, 7, 18-21]。本研究拟以小尾寒羊为母本,分别以澳洲白羊、杜泊羊和夏洛莱羊为父本,进行二元杂交试验,同时对3个杂交组合F1代羊CLPG基因的遗传效应进行分析,旨在从表型和分子生物学方面筛查适应性强、产肉性能较好的肉用绵羊杂交组合,以促进当地肉羊产业的高效、快速发展。
1 材料与方法 1.1 二元杂交组合生长性能测定 1.1.1 试验地点及杂交组合试验在河北省唐山市古冶区晨昇牧业有限公司完成。以小尾寒羊为母本,分别以纯种澳洲白羊、杜泊羊和夏洛莱羊为父本,分3组进行杂交试验。1组为澳洲白羊和小尾寒羊杂交(简称AH组),2组为杜泊羊和小尾寒羊杂交(简称DH组),3组为夏洛莱羊和小尾寒羊杂交(简称XH组),父母代和杂交F1代羊均分别使用相同的饲养制度,所有F1代羊3月龄断奶。
3组肉羊F1代羊共计186只:澳寒F1代79只(♂:35只,♀:44只),杜寒F1代45只(♂:24只,♀:21只),夏寒F1代62只(♂:26只,♀:36只)。
1.1.2 生长性能测定用电子称、测杖等测定F1代羊的初生重、断奶重、6月龄体重以及3和6月龄的体长、体高、荐高、胸围、胸深、胸宽和腰角宽。
1.1.3 统计分析使用SPSS20.0对所测体重、体尺指标进行单因子方差分析,同时进行差异显著性检验,数值用“平均数±标准差”表示。
1.2 肉羊CLPG基因遗传效应研究 1.2.1 试验羊只从生长记录完整的F1代羊中随机选取44只,其中澳寒、杜寒和夏寒F1代分别为19、14和11只。
1.2.2 血样采集与处理从羊的颈静脉无菌采集5 mL血液,置于干燥真空采血管,等血清自然析出后,离心取血凝块用于基因组DNA的提取。
1.2.3 DNA提取基因组DNA提取参考文献[22],检测合格后的DNA-20 ℃冻存,待用。
1.2.4 引物设计、PCR扩增参考文献[3]和[17],从GenBank上查到绵羊CLPG基因包括SNP位点在内的DNA序列(AF401294.1),围绕此SNP用在线软件Primer 3设计扩增产物为287 bp的1对引物:上游序列为5′-ATCATCGTGTCCTGGTCTATTTTCG-3′,下游序列为5′-TAATGAAAGATTGAGGGGATGTTGG-3′。引物由上海生工生物工程技术服务有限公司合成。
PCR反应体系为20 μL:mix 10 μL,DNA 2 μL,上、下游引物各0.5 μL,双蒸水7 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸2 min,30个循环;72 ℃总延伸10 min。扩增产物经1.5%琼脂糖凝胶电泳检测,并在自动成像仪上拍照。
1.2.5 产物纯化回收和测序用琼脂糖凝胶DNA回收试剂盒将PCR产物回收,然后送至上海生工生物工程技术服务有限公司测序。
1.2.6 变异位点与生长性状的关联分析用SAS8.2(version)中的一般线性模型(GLM)自编程序对F1代羊CLPG基因变异位点与初生重、断奶重、6月龄体重以及3和6月龄体尺指标进行最小二乘分析。
2 结果 2.1 不同杂交组合F1代羊生长性能分析 2.1.1 体重3组F1代羊的初生重、断奶重和6月龄体重以及两阶段的平均日增重方差分析结果见表 1。
|
|
表 1 肉羊不同杂交组合F1代羊体重测定结果 Table 1 Body weight of hybrid progeny (F1) sheep in different hybrid combinations |
由表 1可知,在相同饲养条件下,3个组合F1代羊的各阶段体重指标均存在差异。初生重:公羊,XH最高,与DH呈显著性差异(P < 0.05);母羊,AH最高,与其余两组未达显著性差异(P>0.05)。断奶重:XH公羊和母羊均为最高,公羊与AH呈极显著性差异(P < 0.01);母羊与其余两组均呈极显著性差异(P < 0.01)。6月龄体重:XH公羊和母羊均为最高,公羊与AH呈极显著性差异(P < 0.01),与DH呈显著性差异(P < 0.05);母羊与其余两组均呈极显著性差异(P < 0.01)。初生至断奶时的平均日增重:XH公羊和母羊均为最高,公、母羊与AH均呈极显著性差异(P < 0.01)。断奶至6月龄时的平均日增重:DH公羊和母羊均为最高,其次是XH,DH公、母羊与其余两组均未达显著性差异(P>0.05)。综上,从体重指标分析结果来看,夏寒(XH)二元杂交组合较优。
2.1.2 体尺指标3组F1代羊在3和6月龄时体尺指标的方差分析结果见表 2和表 3。
|
|
表 2 肉羊不同杂交组合F1代羊3月龄体尺指标测定结果 Table 2 3-month-old body size indexes of hybrid progeny (F1) sheep in different hybrid combinations |
|
|
表 3 肉羊不同杂交组合F1代羊6月龄体尺指标测定结果 Table 3 6-month-old body size indexes of hybrid progeny (F1) sheep in different hybrid combinations |
由表 2可知,在相同饲养条件下,3个组合F1代羊3月龄断奶时各体尺指标存在差异。体长:公羊,DH最大,但与其余两组未达显著性差异(P>0.05);母羊,XH最大,与其余两组也未达显著性差异(P>0.05)。体高:XH公羊和母羊均为最大,且均与AH呈显著性差异(P < 0.05)。荐高:XH公羊和母羊均为最大,公、母羊与AH均呈极显著性差异(P < 0.01);母羊与DH呈显著性差异(P < 0.05)。胸围:XH公羊和母羊均为最大,公羊与AH呈极显著性差异(P < 0.01);母羊与其余两组均呈极显著性差异(P < 0.01)。胸深:XH公羊和母羊均为最大,公、母羊与AH均呈显著极性差异(P < 0.01);母羊与DH呈显著性差异(P < 0.05)。胸宽:公羊,DH最大,与AH呈显著性差异(P < 0.05);母羊,XH最大,与其余两组均未达显著性差异(P>0.05)。腰角宽:XH公羊和母羊均为最大,公羊与AH呈显著性差异(P < 0.05);母羊与其余两组均呈显著性差异(P < 0.05)。综上,从3月龄断奶时体尺指标结果来看,夏寒(XH)二元杂交组合较优。
由表 3可知,在相同饲养条件下,3个组合F1代羊6月龄各体尺指标存在差异。体长:公羊,AH最大,与其余两组未达显著性差异(P>0.05);母羊,XH最大,与其余两组也未达显著性差异(P>0.05)。体高:公羊,AH最大,与其余两组未达显著性差异(P>0.05);母羊,XH最大,与AH呈显著性差异(P < 0.05)。荐高:XH公羊和母羊均为最大,公羊与其余两组未达显著性差异(P>0.05);母羊与AH呈极显著性差异(P < 0.01),与DH呈显著性差异(P < 0.05)。胸围:XH公羊和母羊均为最大,公羊与AH呈显著性差异(P < 0.05);母羊与AH呈极显著性差异(P < 0.01)。胸深:XH公羊和母羊均为最大,公、母羊与AH均呈极显著性差异(P < 0.01);母羊与DH呈显著性差异(P < 0.05)。胸宽:XH公羊和母羊均为最大,公羊与AH呈显著性差异(P < 0.05);母羊与AH呈极显著性差异(P < 0.01)。腰角宽:XH公羊和母羊均为最大,公羊与AH呈显著性差异(P < 0.05);母羊与AH呈极显著性差异(P < 0.01)。综上,从6月龄体尺指标结果来看,夏寒(XH)二元杂交组合较优。
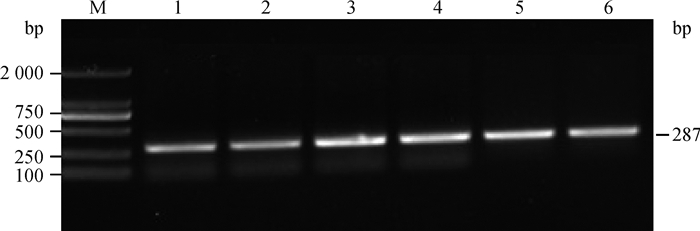
2.2 肉羊不同杂交组合CLPG基因遗传效应检测结果 2.2.1 CLPG基因PCR扩增结果使用设计的引物对44只F1代羊成功进行了PCR扩增,在250 bp上缘有一条明亮清晰的条带,该条带与预期PCR产物的大小(287 bp)基本一致(图 1)。
|
M. DNA相对分子质量标准;1~6. PCR产物 M. DL2000 marker;1-6. PCR products 图 1 CLPG基因PCR产物凝胶电泳图 Fig. 1 Agarose gel electrophoretogram of CLPG gene PCR products |
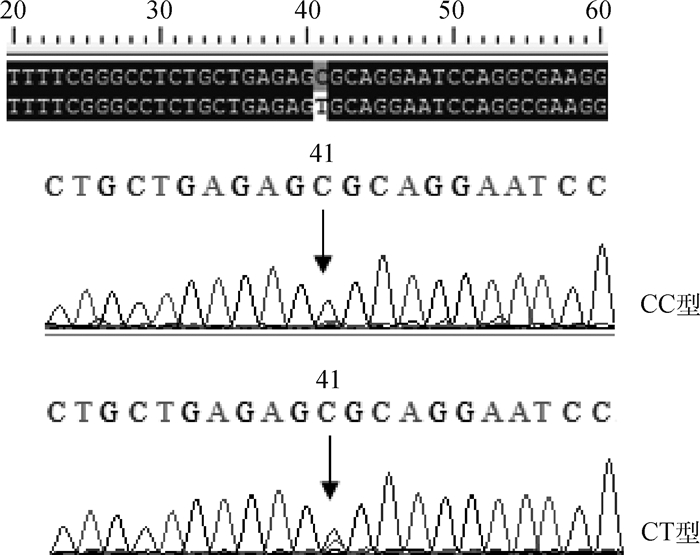
取1只F1代羊的PCR产物回收、测序,所得序列与GenBank数据库中绵羊CLPG基因的相应序列(AF401294.1)比对,其相似性高达99%,说明所得序列即为试验F1代羊CLPG基因的序列。然后将44只不同杂交组合F1代羊PCR产物均回收测序,所得序列用Bio-Edit7.0(v7.0.5.2)和DNAMAN(5.2.2.0)软件比对分析后,发现在该序列41 bp处存在一个错义突变(g.C>T)(图 2)。
|
图 2 不同杂交组合F1代羊CLPG基因序列比对结果 Fig. 2 Sequence alignment results of hybrid progeny (F1) sheep CLPG gene in different hybrid combinations |
3个组合F1代羊CLPG基因突变位点多态性分析结果见表 4。
|
|
表 4 F1代羊CLPG基因突变位点的多态性分析结果 Table 4 Polymorphism analysis results of mutation sites of CLPG gene in hybrid progeny (F1) sheep |
由表 4可知,3个F1代羊群体,均呈现出CC基因型为优势基因型,C为优势等位基因。χ2检测结果显示,3个群体均呈Hardy-Weinberg平衡状态(P>0.05)。
2.2.4 CLPG基因与生长性状的关联性分析CLPG基因变异位点不同基因型与F1代羊初生重、断奶重、6月龄体重以及3月龄和6月龄各体尺指标的最小二乘分析结果分别见表 5和表 6。
|
|
表 5 F1代羊不同基因型在体重上的最小二乘分析结果(最小二乘均数±标准误) Table 5 Least squares analysis of body weight of hybrid progeny(F1) sheep with different genotypes(LSM±SE) |
|
|
表 6 不同基因型F1代羊在3和6月龄体尺指标上的最小二乘分析结果(最小二乘均数±标准误) Table 6 Least squares analysis of body size indexes at 3- and 6-month-old of hybrid progeny (F1) sheep with different genotypes(LSM±SE) |
由表 5可知,澳寒、杜寒和夏寒F1代羊的初生重、断奶重和6月龄体重虽未达显著性差异,但具CT型个体的3个指标均高于具CC型个体,分别高出13.60%、5.28%和2.30%。
由表 6可知,3个组合F1代羊具CT型个体的3和6月龄的体长、体高等7个体尺指标均高于CC型个体,3月龄分别高出5.02%、3.60%、3.89%、3.67%、3.01%、4.93%和4.67%,6月龄分别高出4.55%、2.95%、2.48%、3.39%、2.52%、3.93%和3.60%。其中两个年龄段CT型个体的体长与CC型个体均呈显著性差异(P < 0.05)。
3 讨论澳洲白羊、杜泊羊和夏洛莱羊是当今世界上公认的肉用绵羊品种,小尾寒羊是原产于我国的一个地方优良绵羊品种。为了筛选出适宜于河北省唐山地区养殖的肉用绵羊最佳二元杂交组合,更好地指导生产实践,本研究进行了澳洲白羊、杜泊羊、夏洛莱羊分别与小尾寒羊的二元杂交试验,对澳寒、杜寒和夏寒3个杂交组合F1代羊的体重研究结果表明,在相同饲养条件下,初生重(除了夏寒♀略低于澳寒♀)、断奶重、6月龄体重以及从初生到断奶时的平均日增重,夏寒F1代羊均为最高,并与杜寒和澳寒F1代羊呈显著或极显著差异(P < 0.05,P < 0.01)。对于初生重,F1代公羊表现为夏寒>澳寒>杜寒,F1代母羊表现为澳寒>夏寒>杜寒,这一结果与潘晓荣等[23]报道的澳洲白羊、杜泊羊与小尾寒羊的杂交一代初生重的研究结果(澳寒F1>杜寒F1)基本一致。对于断奶重,F1代公羊表现为夏寒>杜寒>澳寒,F1代母羊表现为夏寒>澳寒>杜寒,但杜寒((20.05±4.56)kg)略低于澳寒((20.13±5.11)kg);对于6月龄体重和初生到断奶时的平均日增重,F1代羊无论公母,均表现为夏寒>杜寒>澳寒;对于断奶到6月龄时的平均日增重,则表现为杜寒>夏寒>澳寒,由此可以看出,夏寒F1代羊从初生到6月龄始终保持较快的生长速度,但相对而言,断奶后杜寒的生长速度更快一些。以上研究结果说明,夏寒F1代羊基础体重较高,出生后生长速度始终较快,而杜寒F1代羊在断奶后表现出相对较快的生长速度。从3月龄各体尺指标来看,除体长和胸宽,夏寒公羊略低于杜寒公羊,其它指标无论公母,均是夏寒优于杜寒和澳寒,基本排序为夏寒>杜寒>澳寒,其中荐高、胸围和胸深极显著高于澳寒(P < 0.01)。从6月龄各体尺指标来看,除夏寒公羊体长略低于澳寒和杜寒公羊,夏寒公羊体高略低于杜寒公羊,其余各指标均是夏寒优于杜寒和澳寒,胸围、胸深和腰角宽的排序为夏寒>杜寒>澳寒,部分指标极显著高于澳寒(P < 0.01)。因此,从体尺指标也体现出,夏寒F1代羊从初生到6月龄体型变化较快。体型大,则为后期快速育肥奠定了较好的身体框架结构。因此,综合以上体重、体尺等表型指标来看,夏洛莱羊和小尾寒羊的杂交优势更加明显,其F1代的产肉性能更高。
多个研究表明,CLPG基因突变能引起绵羊肌肉的发育[24-26],本研究对澳寒、杜寒和夏寒3个组合F1代羊CLPG基因的群体遗传效应分析得出,该基因第41 bp突变位点处(g.C>T),CC为优势基因型,C为优势等位基因,这一结果与张淑珍等[3]的研究结果相一致。张淑珍等[3]在澳洲白羊CLPG基因上也筛查到1个C→T的突变位点,此位点与本研究筛查到的突变位点完全吻合。澳洲白羊CLPG基因该突变位点也是CC为优势基因型,C为优势等位基因。通过CLPG基因与生长性状相关性的最小二乘分析表明,3个组合F1代羊,CT型个体的初生重、断奶重和6月龄体重均高于CC型个体,这一结果与张淑珍等[3]报道的CT型澳洲白母羊体重显著高于CC型的研究结果(P < 0.05)完全一致。另外,3和6月龄体长、体高等体尺指标,CT型的个体均高于CC型的个体,其中体长达显著性差异(P < 0.05)。以上研究结果提示,T等位基因可促进肉羊的生长发育。
4 结论本研究以小尾寒羊为母本,分别以3个引入品种澳洲白羊、杜泊羊和夏洛莱羊为父本,分3组进行了二元杂交试验。通过对3组肉羊杂交F1代羊的生长性能以及CLPG基因的遗传效应分析结果来看,夏洛莱羊与小尾寒羊杂交优势较为明显,T等位基因可促进肉用绵羊的生长发育,建议在河北省唐山地区,为了提高肉羊的产肉性能,组织肉羊生产时尽可能选择夏寒杂交组合且携带有T等位基因的个体。
| [1] |
李军, 金海. 2018年肉羊产业发展概况、未来趋势及对策建议[J]. 中国畜牧杂志, 2018, 55(3): 138–145.
LI J, JIN H. Development situation, future trends and countermeasures for mutton sheep industry in 2018[J]. Chinese Journal of Animal Science, 2018, 55(3): 138–145. (in Chinese) |
| [2] |
汤继顺, 朱德建, 陈胜, 等. 澳洲白绵羊与小尾寒羊杂交F1代生产性能分析[J]. 畜牧与兽医, 2016, 48(9): 58–61.
TANG J S, ZHU D J, CHEN S, et al. Analysis of production performance for F1 generation lamb from Australian White sheep crossing Small-tail Han sheep[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(9): 58–61. (in Chinese) |
| [3] |
张淑珍, 张莉, 赵福平, 等. 澳洲白绵羊美丽臀和肌肉生长抑制素基因基因型的检测[J]. 中国畜牧兽医, 2014, 41(10): 172–178.
ZHANG S Z, ZHANG L, ZHAO F P, et al. Detection of CLPG and MSTN genes genotypes on AWF sheep[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(10): 172–178. (in Chinese) |
| [4] |
赵有璋.
羊生产学[M]. 3版. 北京: 中国农业出版社, 2011.
ZHAO Y Z. Sheep production[M]. 3rd ed. Beijing: China Agriculture Press, 2011. (in Chinese) |
| [5] |
曹斌云, 赵敬贤, 张若楠. 杜泊肉绵羊良种培育及优良特性[J]. 畜牧兽医杂志, 2004, 23(1): 32–33.
CAO B Y, ZHAO J X, ZHANG R N. Breeding and excellent characteristics of Dorper sheep[J]. Journal of Animal Science and Veterinary Medicine, 2004, 23(1): 32–33. (in Chinese) |
| [6] |
国家畜禽遗传资源委员会.
中国畜禽遗传资源志-羊志[M]. 北京: 中国农业出版社, 2011.
National Committee of Livestock and Poultry Genetic Resources. Animal genetic resources in China[M]. Beijing: China Agriculture Press, 2011. (in Chinese) |
| [7] |
王军, 谌春湘, 骆志强, 等. 夏洛莱羊与小尾寒羊杂交改良效果分析[J]. 中国畜禽种业, 2017, 13(3): 69–71.
WANG J, SHEN C X, LUO Z Q, et al. Analysis of hybrid improvement effect between Charolais and Small Tail Han sheep[J]. The Chinese Livestock and Poultry Breeding, 2017, 13(3): 69–71. DOI: 10.3969/j.issn.1673-4556.2017.03.059 (in Chinese) |
| [8] |
曲祖乙, 卢秀芳. 小尾寒羊简介[J]. 中国草食动物, 2003, 23(2): 50–51.
QU Z Y, LU X F. Introduction of Small Tail Han sheep[J]. China Herbivore, 2003, 23(2): 50–51. (in Chinese) |
| [9] | COCKETT N E, JACKSON S P, SHAY T L, et al. Polar overdominance at the ovine callipyge locus[J]. Science, 1996, 273(5272): 236–238. DOI: 10.1126/science.273.5272.236 |
| [10] |
王海亮.山羊Callipyge基因单核苷酸多态研究[D].保定: 河北农业大学, 2007.
WANG H L.Study on SNP of goat callipyge gene[D].Baoding: Agricultural University of Hebei, 2007.(in Chinese) http://cdmd.cnki.com.cn/article/cdmd-11920-2007163419.htm |
| [11] |
胡师金, 张淑珍, 袁泽湖, 等. 绵羊CLPG和MSTN基因多态性及其与生长性状的关联分析[J]. 中国畜牧兽医, 2016, 43(5): 1285–1293.
HU S J, ZHANG S Z, YUAN Z H, et al. Polymorphism of CLPG and MSTN genes and their association analysis with growth traits in sheep[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(5): 1285–1293. (in Chinese) |
| [12] | CHEN F Y, NIU H, WANG J Q, et al. Polymorphism of DLK1 and CLPG gene and their association with phenotypic traits in Chinese cattle[J]. Mol Biol Rep, 2011, 38(1): 243–248. DOI: 10.1007/s11033-010-0101-7 |
| [13] | JAWASREH K I Z, Al-AMAREEN A H, AAD P Y. Growth performance and meat characteristics of the first filial Awassi Rambouillet callipyge ram lamb[J]. Vet World, 2019, 12(6): 783–788. DOI: 10.14202/vetworld.2019.783-788 |
| [14] | PENICK M, KIM H W, SETYABRATA D, et al. Callipyge genotypic effects on meat quality attributes and oxidation stability of ovine M.longissimus[J]. Small Rumin Res, 2017, 146: 5–12. DOI: 10.1016/j.smallrumres.2016.11.011 |
| [15] | YU H, WADDELL J N, KUANG S, et al. Identification of genes directly responding to DLK1 signaling in Callipyge sheep[J]. BMC Genomics, 2018, 9(1): 283. |
| [16] | SHAH A, AZIZ A, GHAFOOR A, et al. Molecular analysis of Callipyge gene mutation(C.267A>G) in Kajli, lohi and Thalli sheep breeds of Pakistan[J]. Russ J Genet, 2018, 54(7): 848–852. DOI: 10.1134/S1022795418070141 |
| [17] |
陈付英, 陈宏, 雷初朝, 等. 郏县红牛CLPG基因的SNP及对生长发育性状的影响[J]. 畜牧兽医学报, 2007, 38(12): 1290–1293.
CHEN F Y, CHEN H, LEI C C, et al. The SNP of CLPG gene in Jiaxian Red cattle and its effect on growth and development traits[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(12): 1290–1293. DOI: 10.3321/j.issn:0366-6964.2007.12.003 (in Chinese) |
| [18] |
母志海, 李洪军, 褚世玉. 夏洛莱羊与小尾寒羊杂交效果[J]. 吉林畜牧兽医, 2008, 29(12): 37–38.
MU Z H, LI H J, CHU S Y. Hybridization effect of Charolais sheep and small tail Han sheep[J]. Jilin Animal Husbandry and Veterinary Medicine, 2008, 29(12): 37–38. DOI: 10.3969/j.issn.1672-2078.2008.12.022 (in Chinese) |
| [19] |
王烈花, 林学仕. 杜泊羊与小尾寒羊杂交试验[J]. 畜牧兽医杂志, 2014, 33(5): 4–6, 8.
WANG L H, LIN X S. Crossing test of Doper sheep and small tail Han sheep[J]. Journal of Animal Science and Veterinary Medicine, 2014, 33(5): 4–6, 8. (in Chinese) |
| [20] |
初汉平. 杜泊羊和小尾寒羊杂一代羔羊与小尾寒羊羔羊生长性能、屠宰性能及肉品品质的比较[J]. 畜牧与兽医, 2012, 44(3): 46–48.
CHU H P. Comparison of growth performance, slaughter performance and meat quality of hybrid progeny lamb of Dorper sheep×small tail Han sheep and small tail Han sheep[J]. Animal Husbandry & Veterinary Medicine, 2012, 44(3): 46–48. (in Chinese) |
| [21] |
张夏刚, 刘晓妮, 项斌伟. 杜泊羊及其与小尾寒羊杂交一代生产性能比较[J]. 当代畜牧, 2011(6): 34–36.
ZHANG X G, LIU X N, XIANG B W. Comparison of production performance between Dorper sheep and its hybrid progeny with small tail Han sheep[J]. Contemporary Animal Husbandry, 2011(6): 34–36. (in Chinese) |
| [22] | SAMBROOK J, FRITSCH E F, MANIATIA T. Molecular cloning, a laboratory manual[M]. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989. |
| [23] |
潘晓荣, 陈广仁, 王晓平, 等. 澳洲白、杜泊羊与小尾寒羊、湖羊杂交试验研究[J]. 甘肃畜牧兽医, 2017, 47(10): 113–114, 119.
PAN X R, CHEN G R, WANG X P, et al. Study on hybridization of AWF sheep and Dorper sheep×small tail Han sheep and Hu sheep[J]. Gansu Animal Husbandry and Veterinary, 2017, 47(10): 113–114, 119. (in Chinese) |
| [24] | FREKING B A, MURPHY S K, WYLIE A A, et al. Identification of the single base change causing the callipyge muscle hypertrophy phenotype, the only known example of polar overdominance in mammals[J]. Genome Res, 2002, 12(10): 1496–1506. DOI: 10.1101/gr.571002 |
| [25] | SMIT M, SEGERS K, CARRASCOSA L G, et al. Mosaicism of Solid Gold supports the causality of a noncoding A-to-G transition in the determinism of the callipyge phenotype[J]. Genetics, 2003, 163(1): 453–456. |
| [26] | FREKING B A, KING D A, SHACKELFORD S D, et al. Effects and interactions of myostatin and callipyge mutations:Ⅰ.Growth and carcass traits[J]. J Anim Sci, 2018, 96(2): 454–461. DOI: 10.1093/jas/skx055 |



