2. 河北省兽医生物技术工程技术研究中心, 保定 071001
2. Hebei Engineering and Technology Research Center of Veterinary Biotechnology, Baoding 071001, China
脑心肌炎病毒(encephalomyocarditis virus,EMCV)能引发猪脑炎、心肌炎和母猪繁殖障碍,并能通过猪器官移植感染人,严重危害养猪健康与公共卫生安全。EMCV属微RNA病毒科(Picornaviridae)心病毒属(Cardiovirus)成员,其为单股正链RNA病毒,基因组全长约7.8 kb,含有一个大的开放阅读框架(ORF),编码相对分子质量约为2.6×103 ku的多聚蛋白[1]。自从1958年从患心肌炎的病猪中分离到EMCV以来[2],世界上一些养猪国家都曾有该病的发生、流行[3-4]以及EMCV感染[5]的报道,给养猪业造成了一定的经济损失。我国从病原学和血清学方面已经证实在不少养猪生产地区的规模化猪场存在EMCV的感染[6-7],对养猪生产潜在的危害受到关注。2009年,美国疾病控制中心(CDC)从南非急性发热病人中分离到EMCV,并从恢复期病人血清中检到抗体[8],其公共卫生意义也值得引起重视。
项目组成员自2005年以来,在EMCV抗原抗体检测方法的建立、流行病学调查、病原分离、基因组结构以及致病机制等研究方面已经取得了一定进展[9-13],但关于该病毒与宿主细胞相互作用的分子致病机制尚不清楚。基于此,本研究拟采用基因表达谱芯片技术,探索EMCV感染N2a细胞后基因表达谱变化,揭示EMCV感染的分子机制,为进一步阐明EMCV与宿主的相互作用提供线索。
1 材料与方法 1.1 细胞与毒株小鼠神经母细胞瘤细胞N2a购自中国医学科学院基础医学研究所细胞资源中心。本试验中采用的毒株EMCV BD2(GenBank登录号:KF709977)由本实验室分离并保存。
1.2 基因芯片Roche NimbleGen 12×135K小鼠基因表达谱芯片涵盖了44 170个基因,这些基因均来自于包括NCBI在内的权威数据库;每张芯片可以同时杂交12个样品。
1.3 方法 1.3.1 样本采集用EMCV感染N2a细胞,于37 ℃,5% CO2细胞培养箱中培养7 h,同时设立对照。加入TRIzol LS Reagent提取试验组与对照组总RNA。
1.3.2 芯片杂交利用T7-oligo(dT)引物合成双链cDNA,纯化后转录为cRNA,再反转录为cRNA,用Cy3-dCTP标记cRNA,42 ℃将标记好的探针与高密度基因组芯片进行杂交。
1.3.3 图像采集与数据分析使用芯片扫描仪扫描芯片的荧光强度,并将试验结果转化成数字型数据保存,使用软件对原始数据进行分析运算,寻找差异表达基因。
1.3.4 实时荧光定量PCR验证芯片数据采用SYBR GreenⅠ荧光染料,在RNA水平上对其中10个差异表达基因进行实时荧光定量PCR(Real-time FQ-PCR)验证。根据GenBank中收录的相应基因序列,设计了11对荧光定量PCR引物(见表 1)。
|
|
表 1 实时荧光定量PCR的检测引物 Table 1 Primers used for Real-time FQ-PCR |
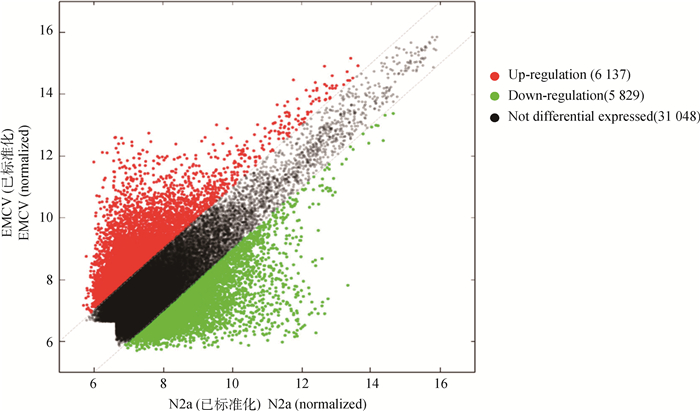
如图 1所示,图中红色点代表表达上调大于2倍的差异表达基因,即上调表达基因,共6 137个;绿色点代表表达下调小于-2倍的差异表达基因,即下调表达基因,共5 829个;黑色点表示无明显差异表达变化的基因。
|
图 1 基因差异表达分析散点图 Fig. 1 Scatter diagram of differential expressed genes of experimental group and control group |
使用标准富集分析方法对6 137个上调和5 829个下调差异表达基因的分子功能、生物学过程以及细胞组分进行标准富集分析。其中,与免疫、炎症反应相关的上调基因过表达,表明这些基因在EMCV感染过程中发挥着重要作用。在这些基因中,23个差异表达基因上调超过5倍,9个差异表达基因上调超过10倍。
2.2.2 KEGG通路分析为了深入了解EMCV感染N2a细胞7 h后与感染相关的不同生物学过程,使用KEGG数据库对上调组6 137个差异表达基因和下调组5 829个差异表达基因进行Pathway分析。在病毒感染宿主细胞7 h后,所涉及到的主要途径包括PI3K-Akt信号通路、MAPK信号通路、细胞因子间相互作用、趋化因子信号通路、T细胞受体信号通路、RIG-1样受体信号通路、细胞凋亡信号通路、TRP通道的炎症介质调节、泛素介导的蛋白水解通路。结果表明,在感染病毒7 h后,宿主启动不同策略来激活免疫、炎症反应以对抗感染。
2.3 差异表达基因的real-time FQ-PCR验证为了证实微阵列数据统计的显著性,本研究中选择7个上调基因(CD247、CDC37、CXCL10、IFNAR1、IL1β、IL6、NFKBIA)、3个下调基因(CXCL5、ISG15、TNF)进行real-time FQ-PCR检测,结果见表 2。结果显示:10个基因表达水平的变化情况与通过微阵列分析预测的变化一致。
|
|
表 2 通过real-time FQ-PCR验证微阵列结果 Table 2 Validation of microarray results by real-time FQ-PCR |
1969年,Klebe和Ruddle通过A株小鼠的自发性肿瘤建立N2a细胞,该细胞具有易转染且能够大量表达微管蛋白等特点,目前已被广泛应用于神经细胞分化及信号通路研究领域[14]。高通量cDNA微阵列技术是分析病原体与宿主细胞之间相互作用的有效工具,该技术可以有效识别宿主细胞被病原体感染后基因表达的变化情况。通过芯片杂交、数据分析可寻找海量差异表达基因,特异、敏感、省时、省工,同时也可大大减少利用实时荧光定量方法寻找差异表达基因时的漏检问题。李彬等[15]利用基因表达谱芯片检测PRRSV/Mhp共感染PAM后基因表达变化,感染后6和15 h分别有2 152与1 760个差异基因,包括炎症反应、免疫反应、细胞凋亡、防御反应、信号转导方面,涉及到的主要信号通路有趋化因子信号通路,细胞因子、TLR、RLR和NLR信号通路以及Jak-STAT信号通路。该项技术为进一步研究病原与宿主相互作用提供了新的线索。鉴于此,本研究应用基因芯片技术探索了EMCV感染N2a细胞的基因表达谱变化情况,对差异表达基因进行了聚类分析、GO分析以及KEGG Pathway功能分析,并经real-time FQ-PCR对微阵列数据的分析结果进行验证,揭示了感染后的致病机制及免疫机制,也为EMCV与其宿主细胞间相互作用的研究提供了理论依据。结果表明,在EMCV感染过程中,超过20 000个基因为显著差异表达,这些差异表达基因从属于多种功能类别和信号途径。已有的研究表明,促炎细胞因子的产生、炎症反应和免疫应答是影响EMCV致病作用的重要因素[16]。EMCV的致病性取决于病毒和宿主两方面因素,所有这些数据表明,宿主免疫系统的激活在EMCV发病机制和免疫机制中起重要作用。
在本研究中,使用cDNA微阵列分析与EMCV感染相关的炎症反应基因表达模式,发现参与炎症反应的大量基因(例如IL1β、IL6、IL10、CCL2、CCL4)在EMCV感染后上调至不同程度。此外,发现参与T细胞受体信号通路有34个基因,PI3K-Akt信号通路有87个基因,MAPK信号通路有66个基因,RIG-1样受体信号通路有21个基因,细胞凋亡信号通路有22个基因,趋化因子信号通路有52个基因,TRP通道的炎症介质调节有32个基因。与白细胞介素相关的基因(如IL1β、IL6、IL10、IL18等)差异表达量不一,但均有明显的上调。其中,IL-1作为强协同刺激因子,具有诸多生物学活性,包括促T细胞活化、促进增殖与分化,增强自然杀伤细胞的杀伤活性,诱导细胞毒性T淋巴细胞产生等。IL-1还可诱导活化上皮细胞,从而对中性粒细胞产生刺激,促进炎性介质释放。IL-10的主要生物活性为免疫抑制,IL-18主要作用是诱导细胞增殖、介导细胞的免疫反应。而IL-1β作为参与多种通路的促炎细胞因子,其在炎症反应中起关键作用。在目前的研究中,上调基因编码的大量分子与IL-1β相互作用,同时,KEGG通路分析表明IL-1β参与多种途径,包括细胞因子间相互作用,MAPK信号通路和TNF信号通路等。研究表明,IL-1β通过募集免疫细胞参与炎症反应,且与许多炎性疾病的病理生理学相关[17]。在本研究中,CXCL10上调超过5倍,研究表明,CXCL10在多种疾病中参与免疫调控反应,具有多种生物学功能,主要表现在介导Th1型炎症反应,加快反应进程,趋化T细胞,对Th2反应进程造成破坏[18]。与干扰素相关基因的表达均有明显的上调,研究发现干扰素调节因子IRF3、IFNAR1在7 h即有明显的上调表达,干扰素效应基因(如OAS、PKR、MxI等基因)转录上调。OAS是2′,5′-寡腺核苷酸合成酶(2′,5′-oligoadenylate synthetase, OAS),它能够在dsRNA和ATP的存在下合成2′,5′-寡腺核苷酸,这些小单位的核苷酸能够激活RNA内切酶从而引起细胞和病毒RNA的降解[19]。研究发现EMCV感染N2a细胞后,OAS在感染7 h表达上调,认为EMCV感染后诱导出高水平IFN-α,使OAS表达增加,从而发挥抗病毒作用,抑制EMCV在N2a中的复制增殖。因此,干扰素在宿主抗EMCV感染过程中发挥重要作用。
先天免疫是宿主防御病原体入侵机体的第一道防线。模式识别受体(PRR)是先天性免疫应答的表达传感器,为宿主提供识别和快速应对病原体感染的能力,然后触发一类信号级联,最终确保消除病原体所需的必需效应分子的产生。在目前的研究中,我们发现EMCV感染7 h后,细胞内MYD88、NFKBIA上调至不同水平。KEGG通路分析表明激活NF-κB可辅助诱导炎症和免疫反应。
4 结论首次应用基因芯片分析了EMCV感染N2a细胞的基因表达谱变化,利用获得的芯片数据对EMCV感染后的免疫反应、炎症反应及凋亡等途径的总体模式进行分析,探索了EMCV感染分子机制。EMCV感染N2a细胞后差异表达基因达21 143个,其中上调基因为6 137个,下调基因为5 829个。涉及的主要途径包括PI3K-Akt信号通路、MAPK信号通路、细胞因子间相互作用、趋化因子信号通路、TCR/RLR信号通路和细胞凋亡通路等,提示宿主启动不同策略来激活免疫炎症反应以对抗感染。
| [1] | PALMENBERG A C, KIRBY E M, JANDA M R, et al. The nucleotide and deduced amino acid sequences of theencephalomyocarditis viral polyprotein coding region[J]. Nucleic Acids Res, 1984, 12(6): 2969–2985. DOI: 10.1093/nar/12.6.2969 |
| [2] | MURNANE T G, CRAIGHEAD J E, MONDRAGON H, et al. A. Fatal disease of swine due toencephalomyocarditis virus[J]. Science, 1960, 131(3399): 498–499. DOI: 10.1126/science.131.3399.498 |
| [3] | AN D J, JEONG W, JEOUNG H Y, et al. Encephalomyocarditis in Korea:serological survey in pigs and phylogenetic analysis of two historical isolates[J]. Vet Microbiol, 2009, 137(1-2): 37–44. DOI: 10.1016/j.vetmic.2009.01.005 |
| [4] | BAKKALI KASSIMI L, MADEC F, GUY M, et al. Serological survey of encephalomyocarditis virus infection in pigs in France[J]. Vet Rec, 2006, 159(16): 511–514. DOI: 10.1136/vr.159.16.511 |
| [5] | SANGAR D V, ROWLANDS D J, BROWN F. Encephalomyocarditis virus antibodies in sera from apparently normal pigs[J]. Vet Rec, 1977, 100(12): 240–241. DOI: 10.1136/vr.100.12.240 |
| [6] |
盖新娜, 杨汉春, 郭鑫, 等. 猪脑心肌炎病毒的分离与鉴定[J]. 畜牧兽医学报, 2007, 38(1): 59–65.
GE X N, YANG H C, GUO X, et al. Isolation and characterization of porcine encephalomyocarditis virus[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(1): 59–65. DOI: 10.3321/j.issn:0366-6964.2007.01.011 (in Chinese) |
| [7] |
张家龙, 盖新娜, 马良, 等. 规模化猪场脑心肌炎病毒感染的血清学调查[J]. 中国兽医杂志, 2007, 43(1): 7–9.
ZHANG J L, GE X N, MA L, et al. Serological survey of EMCV infection in pigs on large-scale pig farms in China 2005-2006[J]. Chinese Journal of Veterinary Medicine, 2007, 43(1): 7–9. DOI: 10.3969/j.issn.0529-6005.2007.01.002 (in Chinese) |
| [8] | OBERSTE M S, GOTUZZO E, BLAIR P, et al. Human febrile illness caused by encephalomyocarditis virus infection, Peru[J]. Emerg Infect Dis, 2009, 15(4): 640–646. DOI: 10.3201/eid1504.081428 |
| [9] | YUAN W Z, SONG Q Y, ZHANG X Y, et al. Isolation and molecular analysis of porcine encephalomyocarditis virus strain BD2 from northern China[J]. Infect Genet Evol, 2014, 21: 303–307. DOI: 10.1016/j.meegid.2013.11.014 |
| [10] | YUAN W Z, ZHENG Y S, SUN M T, et al. Development of a TaqMan-based real-time reverse transcription polymerase chain reaction assay for the detection of encephalomyocarditis virus[J]. J Virol Methods, 2014, 207: 60–65. DOI: 10.1016/j.jviromet.2014.06.004 |
| [11] | YUAN W Z, WANG J C, SUN M T, et al. Rapid detection of encephalomyocarditis virus by one-step reverse transcription loop-mediated isothermal amplification method[J]. Virus Res, 2014, 189: 75–78. DOI: 10.1016/j.virusres.2014.04.015 |
| [12] |
邹云婧, 林密, 袁万哲, 等. 稳定表达脑心肌炎病毒先导蛋白N2a细胞系的建立与鉴定[J]. 病毒学报, 2017, 33(4): 524–529.
ZOU Y J, LIN M, YUAN W Z, et al. Establishment and identification of N2a cell line for stably expressing the leader protein of encephalomyocarditis virus[J]. Chinese Journal of Virology, 2017, 33(4): 524–529. (in Chinese) |
| [13] | YUAN W, HUA R, ZHANG X, et al. Porcineencephalomyocarditis virus strain BD2 isolated from northern China is highly virulent for BALB/c mice[J]. Acta Virol, 2015, 59(3): 300–304. DOI: 10.4149/av_2015_03_300 |
| [14] |
宋玉菲, 张晓洁, 邹文颖, 等. 低氧和(或)高糖对小鼠神经母细胞瘤细胞Neuro-2a活性的影响及自噬机制研究[J]. 中国临床神经科学, 2016, 24(5): 497–504.
SONG Y F, ZHANG X J, ZOU W Y, et al. Autophagy mechanism involved in cell death caused by hypoxia with/without high glucose[J]. Chinese Journal of Clinical Neurosciences, 2016, 24(5): 497–504. (in Chinese) |
| [15] | LI B, DU L P, XU X W, et al. Transcription analysis on response of porcine alveolar macrophages to co-infection of the highly pathogenic porcine reproductive and respiratory syndrome virus and Mycoplasma hyopneumoniae[J]. Virus Res, 2015, 196: 60–69. DOI: 10.1016/j.virusres.2014.11.006 |
| [16] | BAEUERLE P A, HENKEL T. Function and activation of NF-κB in the immune system[J]. Annu Rev Immunol, 1994, 12: 141–179. DOI: 10.1146/annurev.iy.12.040194.001041 |
| [17] | AREND W P, PALMER G, GABAY C. IL-1, IL-18, and IL-33 families of cytokines[J]. Immunol Rev, 2008, 223(1): 20–38. DOI: 10.1111/j.1600-065X.2008.00624.x |
| [18] |
许锦辉. 趋化因子CXCL10在恶性肿瘤发生、发展中的研究进展[J]. 重庆医学, 2016, 45(13): 1849–1851.
XU J H. Research progress on chemokine CXCL10 in carcinogenesis and development of malignant tumors[J]. Chongqing Medicine, 2016, 45(13): 1849–1851. DOI: 10.3969/j.issn.1671-8348.2016.13.045 (in Chinese) |
| [19] | VLOTIDES G, SÖRENSEN A S, KOPP F, et al. SOCS-1 and SOCS-3 inhibit IFN-α-induced expression of the antiviral proteins 2, 5-OAS and MxA[J]. Biochem Biophys Res Commun, 2004, 320(3): 1007–1014. DOI: 10.1016/j.bbrc.2004.06.051 |



