血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)是由两个独立的研究小组在2000年分别从人淋巴瘤cDNA文库[1]和人心力衰竭左室组织cDNA文库[2]中首先克隆出的血管紧张素转换酶(angiotensin-converting enzyme,ACE)的同源物。起初Donoghue等[1]首先观察了23块人体组织,仅在心、肾和睾丸组织中发现ACE2的表达,而其他组织器官及血液中未发现它的存在;随后Harmer等[3]利用反转录定量PCR(qRT-PCR)法,检测来自3例健康供体的72种不同组织的ACE2 mRNA,发现胃肠体系中,特别是十二指肠、回肠、空肠和结肠ACE2能高表达;近期的研究发现中性氨基酸转运载体B0AT1的功能和表达依靠肾素-血管紧张素系统(renin-angiotensin system,RAS)成员的共表达,即肾的TMEM27(collectrin)和小肠的ACE2[4-5],证实ACE2对肠道运输中性氨基酸起到协调作用;另有研究表明,ACE2同样能参与肠道葡萄糖的转运[6-7]。本研究前期试验已证实ACE2在仔猪空肠mRNA的表达量显著高于其他组织,且本实验室王珊珊等和权素玉等[8-9]研究也发现ACE2在断奶仔猪胃肠系统中广泛存在,其中空肠ACE2 mRNA的表达极显著。因此本研究拟以断奶仔猪为研究对象,采用免疫组化、Western blot和Real-time PCR、放射免疫、HPLC等方法明确ACE2在仔猪空肠中的分布表达,通过分析不同日龄仔猪空肠组织中B0AT1及SGLT-1和GLUT-2 mRNA的表达,检测血浆中游离氨基酸的种类和含量,分析ACE2与B0AT1、SGLT-1、GLUT-2以及血浆中氨基酸之间的关系,探讨ACE2对肠道物质转运的影响,为发掘ACE2的新功效提供理论依据。
1 材料与方法 1.1 实验材料 1.1.1 主要试剂和仪器Trizol试剂盒(日本TaKaRa公司);M-MLV反转录酶(美国Promega公司);BCA蛋白定量试剂盒(上海碧云天生物技术有限公司);PVDF膜(美国Millipore公司);兔抗单克隆抗体、山羊抗小鼠IgG抗体(南京生兴生物技术有限公司);SABC试剂盒、DAB显色试剂盒(武汉博士德生物工程有限公司);二氨基联苯胺(DAB)、琼脂糖(南京生兴生物工程研究所);邻苯二甲醛(O-phthalaldehyde,OPA,国药集团化学试剂有限公司);β-巯基乙醇(β-mercaptoethanol,日本Sigma);甲醇(methanol,德国默克公司,色谱级);乙腈(acetonitrile,美国天地公司,色谱级);四氢呋喃(tetrahydro furan,上海凌峰化学试剂有限公司,色谱级)等。
高速冷冻离心机(CT15RE,日本Hitachi);核酸蛋白测定仪(BioPhotometer D30,德国Eppendorf);手持式组织匀浆器(PT1200CL,瑞士Polytron);PCR仪(Tpersonral,美国Biometra);电泳仪及半干转移仪(Power pac300,美国BIO-RAD);扫描仪(Perfection V500 Photo,日本Epson);C18 (ODS)反相柱(4.6 mm×250 mm,美国Global Water);二极管阵列检测器(DAD,美国Agilent);高效液相色谱仪(Agilent-1200,美国Agilent);荧光监测器(FLD,美国Agilent);在线脱气机(HP-G1322A,美国Agilent);体卧式柱温箱(HT-220A,上海泉岛公司);全自动发光成像系统(Tanon-5200Multi,上海天能科技有限公司)等。
1.1.2 实验动物及样品采集挑选窝产期相近、胎次相似的新出生健康雌性仔猪饲养于江苏姜曲海种猪场。对仔猪分组分栏饲养,每组6头共两组,期间自由采食和饮水,一周龄饲喂开口料,当体重达15 kg左右转喂保育料。试验猪21 d一次性断奶,并在21、35日龄分别从两组随机挑选3头仔猪屠宰,颈部放血处死,采血分离血清,于-20 ℃保存备用。截取空肠中段组织并用0.9%氯化钠溶液漂洗,将其中一部分组织迅速放入液氮速冻,后移至-80 ℃保存;另一部分被截取为0.5 cm3左右的组织块并移入4%多聚甲醛固定液中浸泡24 h,再移入20%蔗糖溶液中浸泡3 h,最后移至-80 ℃保存。
1.2 方法 1.2.1 ACE2蛋白的细胞学定位将固定在4%多聚甲醛内48 h的空肠组织块制成5 μm厚的切片,按郭丽敏等[10]的方法采用SABC免疫组化法进行ACE2蛋白的细胞学定位。按照洗片,封闭(5% BSA 37 ℃孵育30 min),以1:100的比例,用PBS分别稀释一抗(兔抗单克隆抗体)和二抗(山羊抗小鼠IgG抗体),加SABC,DAB试剂避光显色,苏木素复染、脱水、透明、封固等程序进行。PBS代替一抗作阴性对照。用Olympus显微镜对切片进行观察、拍照,确定ACE2在仔猪空肠组织内的定位情况。
1.2.2 仔猪空肠组织中ACE2蛋白表达的Western blot分析称取100 mg仔猪空肠组织于1 mL裂解液中匀浆,离心取上清,按照试剂A:试剂B=50:1的比例配制BCA工作液,酶标仪测定A562 nm,根据标准曲线得出蛋白浓度;以120 V、90 min的条件SDS-PAGE电泳,以1.5 mA·cm-2、90 min的条件转印,将PVDF膜放至5%脱脂奶粉封闭液中封闭2 h,先后孵育一抗(4 ℃过夜)和二抗(室温2 h),抗体孵育按试剂盒说明书进行;避光条件下滴加AB显色液显色反应5 min并拍照,以GAPDH作内参,目的条带与其相比得到相对量。
1.2.3 仔猪空肠ACE2、SLC6A19、SGLT-1和GLUT-2的RT-qPCR检测 1.2.3.1 空肠组织总RNA的提取取约100 mg仔猪空肠组织,彻底匀浆,采用Trizol一步抽提法提取空肠组织的总RNA,以紫外比色法(A260 nm/A280 nm)测定总RNA的浓度和纯度。
1.2.3.2 反转录选择完整性好(1%琼脂糖凝胶电泳出现28S和18S条带,28S条带亮度是18S两倍)且A260 nm/A280 nm在1.8~2.0之间的RNA反转录成cDNA。反转录体系为25 μL,包括样品RNA 2 μL,20 μL RNA酶抑制剂,100 μL Μ-MLV反转录酶,5 μL 5×RT buffer,0.14 mmol·L-1 dNTP,4 μmol·L-1随机引物。反转录产物于-20 ℃保存备用。
1.2.3.3 目的基因引物设计根据GenBank上公布的猪ACE2、B0AT1编码基因、SGLT-1、GLUT-2及β-actin内参基因序列,用Primer Premier 5软件自行设计引物(见表 1),由北京鼎国昌盛生物技术有限责任公司合成。
|
|
表 1 目的基因及β-actin引物序列 Table 1 Prime sequences of targeted gene and β-actin |
以β-actin作为内参,对ACE2、SLC6A19、SGLT-1、GLUT-2基因进行实时荧光定量分析。实时荧光定量PCR采用SYBR Green染料,三步法检测目的基因的相对表达,反应条件为:95 ℃预变性3 min;95 ℃变性20 s,58~62 ℃退火30 s,72 ℃延伸30 s,共40个循环,利用相对定量△△Ct法进行数据统计。
1.2.4 HPLC法测定血清中游离氨基酸的含量 1.2.4.1 色谱条件色谱柱,C18反相柱(4.6 mm×250 mm,美国Global Water);流动相A,0.01 mol·L-1磷酸盐缓冲液(pH=6.85);流动相B,甲醇(色谱级,99%);流动相C,乙腈(色谱级,99%);流速,0.8 mL·min-1;紫外检测波长,340 nm;进样量,40 μL;梯度洗脱见表 2。
|
|
表 2 HPLC分离程序 Table 2 HPLC separation procedure |
称取25 mg邻苯二甲醛溶于1 mL甲醇,以0.4 mol·L-1硼酸缓冲(pH=9.5,NaOH溶液调制)定容至10 mL,混匀并置于暗处,隔天补充10 μL ME,每周需重新配制。
1.2.4.3 样品的处理按张树坤等[11]方法,将待测血清4 ℃解冻后,按血清:乙腈=1:2的体积比例添加乙腈,充分混匀后于4 ℃静置30 min,继续4 ℃,12 000 r·min-1,离心30 min,取上清液备用。
1.2.4.4 进样前衍生取20 μL样品与40 μL OPA衍生试剂混匀,室温反应2 min,加10 μL 0.1 mol·L-1硼酸缓冲(pH=4)终止反应,取40 μL反应液用于液相色谱分析。
1.2.4.5 数据统计与分析数据采用SPSS 16.0统计软件进行统计分析,差异显著性检验采用单因子方差分析(One way ANOVA,LSD)。所有数值以“
ACE2基因PCR扩增结果如图 1所示,RT-PCR扩增产物经琼脂糖凝胶电泳后在仔猪空肠等组织中有ACE2基因的表达,250 bp条带处能观察到不同组织的PCR扩增条带,其中,空肠后段和中段的表达最显著。
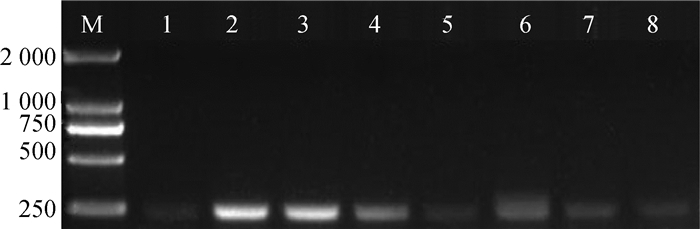
|
M. DL2000 DNA相对分子质量标准;1.垂体;2.空肠后段;3.空肠中段;4.空肠前段;5.下丘脑;6.胸腺;7.脾;8.肺 M. DL2000 DNA marker; 1. Pituitarium; 2. Posterior segment of jejunum; 3. Middle segment of jejunum; 4. Anterior segment of jejunum; 5. Hypothalamus; 6. Thymus; 7. Spleen; 8. Lung 图 1 不同组织ACE2基因PCR扩增结果 Fig. 1 Results of PCR amplification of ACE2 gene in different tissues |
免疫组织化学结果如图 2所示, ACE2蛋白主要分布在小肠皱襞和绒毛处,呈棕黄色。在空肠上皮细胞的刷状缘、浆膜层和肌层均有ACE2的显著表达,在肠绒毛中多定位于上皮细胞顶端。
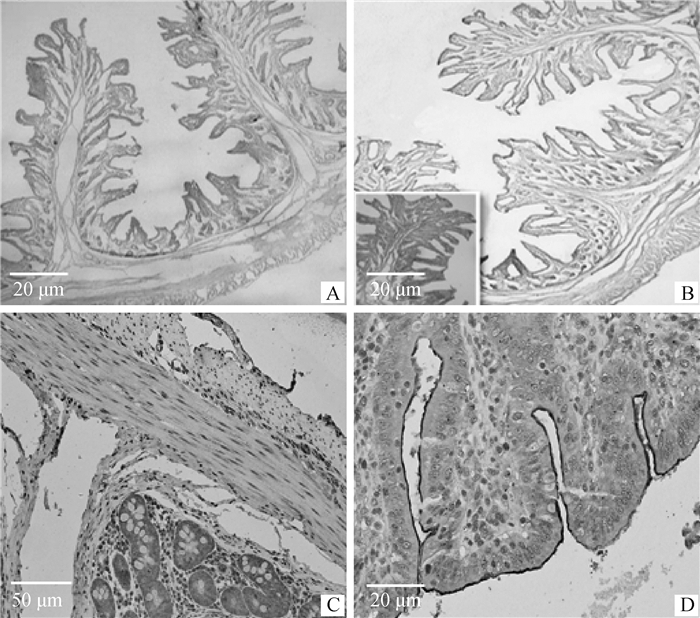
|
A.阴性对照,PBS代替一抗;B.正常处理组;C.肠腺;D.肠绒毛 A. Negative control, PBS instead of primary antibody; B. Normal treatment group; C. Enteraden; D. Intestinal villus 图 2 ACE2在仔猪空肠中的定位(40×) Fig. 2 Location of ACE2 in the jejunum of piglets(40×) |
Western blot结果如图 3所示,以GAPDH为内参蛋白,在仔猪发育的不同时期,空肠组织中ACE2蛋白表达量存在显著变化,并且随着仔猪日龄的增加,蛋白表达量显著升高(0.29±0.00 vs 0.65±0.00,P<0.05)。
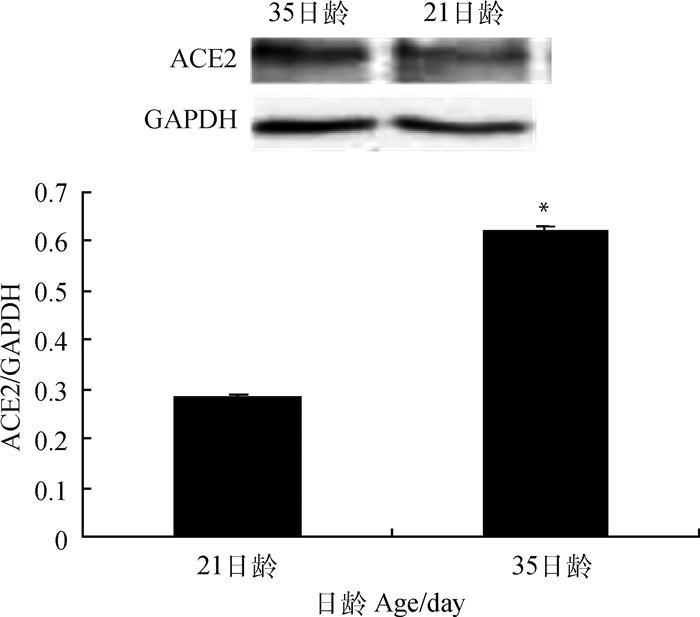
|
*表示与21日龄时相比差异显著(P < 0.05) * mean significant difference compared with that of 21 days of age (P < 0.05) 图 3 ACE2在不同日龄仔猪空肠组织中蛋白水平变化 Fig. 3 ACE2 protein level changes in jejunal tissues of piglets at different ages |
结果如图 4所示,随着断奶仔猪日龄的增加,ACE2和SGLT-1 mRNA的表达水平也随之增加,且ACE2增加显著(P < 0.05), 而GLUT-2 mRNA的表达随着仔猪日龄的增加无明显变化。
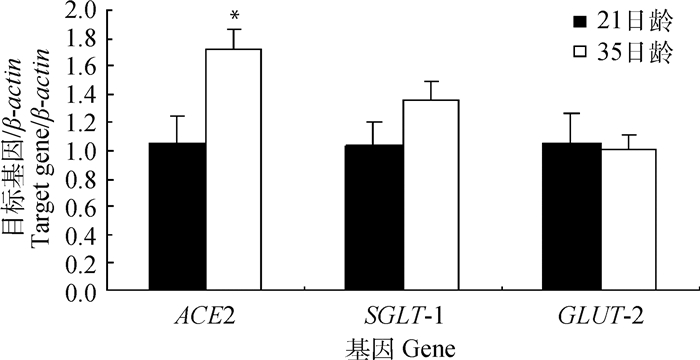
|
*表示与21日龄时相比差异显著(P < 0.05) * mean significant difference compared with that of 21 days of age (P < 0.05) 图 4 不同日龄空肠ACE2、SGLT-1和GLUT-2基因mRNA差异比较 Fig. 4 Comparison of mRNA differences between ACE2, SGLT-1 and GLUT-2 genes in jejunum of different ages |
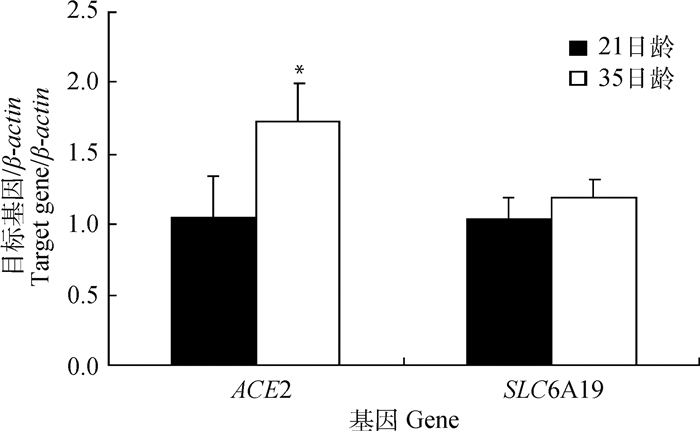
结果如图 5所示,ACE2及中性氨基酸转运载体B0AT1的基因SLC6A19 mRNA在断奶仔猪空肠中均有表达,且随着仔猪日龄的增加,ACE2和SLC6A19的基因表达均呈上升趋势,其中35日龄仔猪空肠组织中ACE2的mRNA与21日龄的相比显著升高(P < 0.05)。SLC6A19的变化趋势与ACE2一致。
|
*表示与21日龄时相比差异显著(P < 0.05) * mean significant difference compared with that of 21 days of age (P < 0.05) 图 5 仔猪空肠组织中ACE2、SLC6A19 mRNA的表达差异比较 Fig. 5 Comparison of ACE2 and SLC6A19 mRNA expressions in jejunal tissues of piglets |
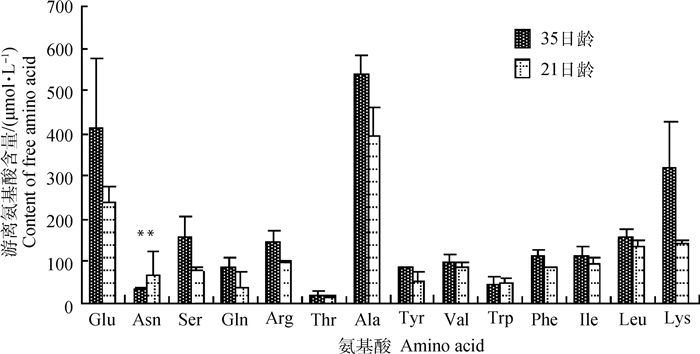
结果如图 6所示,不同日龄仔猪血清中均可检测出14种游离氨基酸,包含8种必需氨基酸(Thr、Arg、Val、Phe、Ile、Leu、Lys、Trp)和6种非必需氨基酸(Glu、Asn、Ser、Gln、Tyr、Ala)。14种游离氨基酸中除Glu、Arg、Lys三种氨基酸外其余的11种均为中性氨基酸;除了Asn、Trp以外其余的Thr、Val、Phe、Ile、Leu等9种中性氨基酸的含量均随着仔猪日龄的增加而增加。21日龄时Arg、Val、Phe、Ile、Leu、Lys等11种氨基酸含量均低于35日龄时。
|
**表示与21日龄时相比差异极显著(P < 0.01) ** mean very significant difference compared with that of 21 days of age (P < 0.01) 图 6 不同日龄仔猪血清中游离氨基酸含量的变化 Fig. 6 Changes of free amino acids in serum of piglets of different age |
ACE2作为RAS的新成员[2]于2000年被发现,是一种重要的含锌金属蛋白酶和RAS的负向调控因子,在维持机体正常功能和抗疾病损伤过程中充当重要角色[12],同时还参与肠道物质转运[13]。当前ACE2在人医临床领域的研究较丰富,而在动物上的研究,特别是对仔猪的研究较少。
2012年,Hashimoto等[14]研究发现ACE2与B0AT1在小肠中的定位一致,表明ACE2参与B0AT1的表达,二者在肠道氨基酸转运、消化吸收等方面建立起紧密的联系。后又通过将ACE2突变小鼠肠道中的微生物群移植到无菌野生型小鼠中,发现无菌野生型小鼠因硫酸葡聚糖钠(dextran sodium sulphate, DSS)刺激而引发的结肠炎显著恶化,为了证明ACE2突变小鼠的结肠炎是由于色氨酸摄取受损所致,又以Gly-Trp二肽的形式提供色氨酸,以绕过单一氨基酸转运蛋白B0AT1的缺失,恢复血清色氨酸的水平,结果显示降低了ACE2突变小鼠结肠炎的易感性,这表明ACE2的缺失的确会破坏局部氨基酸的稳态,改变肠道炎症的易感性。在ACE2突变小鼠回肠腔上皮细胞中,还发现多种抗菌肽的表达明显降低,B0AT1不能正常表达,导致其mTOR通路活性降低,当恢复对色氨酸的摄取后,ACE2突变小鼠小肠mTOR通路活性增加,肠腔内抗菌肽的表达随之上调,表明色氨酸也会诱导肠腔上皮细胞抗菌肽的表达,改善肠道微生态。通过上述研究证实,ACE2与肠道物质转运、肠道微生态平衡以及肠道炎症存在密切联系。
由于断奶仔猪绝大部分组织处于生长发育阶段,胃肠系统发育不完善引起的采食量下降、生长受阻、腹泻等症状严重影响了仔猪的健康生长[15-16]。本研究以断奶仔猪为对象,探讨ACE2在仔猪肠道发育及其与肠道物质转运的相互关系,发掘ACE2在断奶仔猪中的积极作用。通过免疫组化研究发现ACE2蛋白主要分布在小肠皱襞和绒毛处,显著表达于空肠上皮细胞的刷状缘、浆膜层和肌层,这与郭丽敏等[10]的发现一致。Real-time PCR结果显示,在仔猪空肠组织中均有ACE2、B0AT1编码基因及SGLT-1、GLUT-2 mRNA的表达,并且随着仔猪日龄的增加,ACE2、SLC6A19和SGLT-1的基因表达均呈上升趋势,其中35日龄仔猪空肠组织中ACE2 mRNA与21日龄的相比显著升高。Western blot结果显示,ACE2蛋白在断奶仔猪空肠中也有表达,且随着仔猪日龄的增加表达量显著增高,与基因表达变化一致。HPLC结果显示,在不同日龄的仔猪血清中均可检测出14种游离氨基酸,并且随着仔猪日龄的增加,肠道中性氨基酸的含量也在上升。肠道ACE2、氨基酸转运载体的mRNA表达与血液中氨基酸含量趋势一致,与Hashimoto等[14]研究结果一致,即ACE2与B0AT1的共表达,两者在肠道氨基酸转运上有密切关系。
机体肠上皮细胞膜上的不同膜转运系统发挥对物质的跨膜转运功能,表达于小肠上皮细胞刷状缘的氨基酸转运载体家族吸收肠腔内蛋白质的酶解产物至肠上皮细胞细胞质内发挥作用[17]。目前认为,B0系统是肠上皮细胞中非常重要的氨基酸转运系统,它具有强大、专性的氨基酸转运能力, 尤其是中性氨基酸, 如色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苯丙氨酸、脯氨酸[17]。B0AT1作为经典的中性氨基酸转运载体,在肠道中广泛分布,关系着氨基酸的转运吸收[18],其表达和功能也被证明依赖于RAS成员的共表达[19],即肾中的TMEM27(collectrin)和小肠中的ACE2,在一定程度上可以代表胃肠道对氨基酸的吸收转运能力[17]。Kowalczuk等[20]研究也发现,为优化中性氨基酸的转运,肠黏膜中性氨基酸转运载体活性的提高可通过ACE2的高表达来完成;Perlot和Penninger[21]研究发现在敲除了ACE2基因的小鼠中,B0AT1在小肠中不能完全表达,但在肾中可以,这说明在肠腔上皮细胞表面表达B0AT1需要ACE2,于是又对在小肠中不能表达B0AT1的ACE2基因缺失小鼠进行试验,结果显示小鼠血清中必需氨基酸色氨酸的水平显著降低,后来的研究证实ACE2对肠道运输中性氨基酸起到协调作用,色氨酸的吸收可经由ACE2/B0AT1的转运途径实现[4-5]。
机体肠上皮细胞膜上的不同膜转运系统发挥对物质的跨膜转运功能,SGLT-1、GLUT-2作为葡萄糖转运载体,在葡萄糖转运吸收方面发挥着重要作用。首先由位于刷状缘的SGLT-1与Na+和葡萄糖耦联,形成Na+载体-葡萄糖复合物,顺Na+浓度梯度进入细胞,Na+-K+-ATPase泵出Na+,以维持细胞内外Na+的浓度平衡;葡萄糖在肠黏膜细胞内不断地聚集,位于基底膜的协助扩散转运载体GLUT-2,顺葡萄糖浓度梯度协助转运其进入组织间隙液[22]。2007年,Wong等[23]通过小鼠模型研究证实了RAS相关组分在肠上皮细胞中有所表达,并证实了该系统与葡萄糖转运吸收之间存在着某种联系;Bernardi等[24]通过研究ACE2缺失小鼠对标准或高脂饮食的代谢反应,证实ACE2参与葡萄糖的转运,且ACE2的缺乏对葡萄糖稳态产生影响。本研究结果随着断奶仔猪日龄的增加,ACE2和SGLT-1 mRNA的表达水平也随之增加,而GLUT-2 mRNA的表达随着仔猪日龄的增加无明显变化。
越来越多的研究表明氨基酸在预防和治疗肠道炎症中发挥重要作用[25],肠道氨基酸的摄取对肠道的先天性免疫十分重要,已有报道氨基酸可能与肠腔上皮细胞的增殖和凋亡紧密相关[26],并具有抗炎和抗氧化的功能,主要通过多种转运蛋白的参与转运吸收[27-28],其中位于小肠的Na+依赖性转运蛋白B0AT1是中性氨基酸吸收的主要蛋白,并且能与ACE2稳定结合[29-30]。ACE2的表达还能调控葡萄糖稳态和预防高脂膳食引起的肥胖及糖尿病的发展[31],这提示ACE2可能具备调控肠道营养物质的能力,对维持肠道稳态具有积极的作用[32]。本研究结果提示仔猪肠道中ACE2与SLC6A19、SGLT-1、GLUT-2有一定关系,这些结果为ACE2在猪方面的进一步研究提供重要理论依据。
4 结论仔猪空肠中有ACE2存在,且随着仔猪日龄的增加其表达量显著升高;ACE2与肠道氨基酸等物质的转运有密切关系,这为挖掘ACE2的新功能提供了理论依据。
| [1] | DONOGHUE M, HSIEH F, BARONAS E, et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin Ⅰ to angiotensin 1-9[J]. Circ Res, 2000, 87(5): E1–E9. |
| [2] | TIPNIS S R, HOOPER N M, HYDE R, et al. A human homolog of angiotensin-converting enzyme cloning and functional expression as a captopril-insensitive carboxypeptidase[J]. J Biol Chem, 2000, 275(43): 33238–33243. DOI: 10.1074/jbc.M002615200 |
| [3] | HARMER D, GILBERT M, BORMAN R, et al. Quantitative mRNA expression profiling of ACE2, a novel homologue of angiotensin converting enzyme[J]. FEBS Lett, 2002, 532(1-2): 107–110. DOI: 10.1016/S0014-5793(02)03640-2 |
| [4] | DANILCZYK U, SARAO R, REMY C, et al. Essential role for collectrin in renal amino acid transport[J]. Nature, 2006, 444(7122): 1088–1091. DOI: 10.1038/nature05475 |
| [5] | CAMARGO S M R, SINGER D, MAKRIDES V, et al. Tissue-specific amino acid transporter partners ACE2 and collectrin differentially interact with hartnup mutations[J]. Gastroenterology, 2009, 136(3): 872–882. DOI: 10.1053/j.gastro.2008.10.055 |
| [6] | BINDOM S M, HANS C P, XIA H J, et al. Angiotensin Ⅰ-converting enzyme type 2 (ACE2) gene therapy improves glycemic control in diabetic mice[J]. Diabetes, 2010, 59(10): 2540–2548. DOI: 10.2337/db09-0782 |
| [7] | PUTNAM K, SHOEMAKER R, YIANNIKOURIS F, et al. The renin-angiotensin system:a target of and contributor to dyslipidemias, altered glucose homeostasis, and hypertension of the metabolic syndrome[J]. Amer J Physiol-Heart Circul Physiol, 2012, 302(6): H1219–H1230. DOI: 10.1152/ajpheart.00796.2011 |
| [8] |
王珊珊, 黄瑜, 张树坤, 等. 血管紧张素转化酶2(ACE2)的基因克隆及在仔猪体内的表达分布[J]. 中国兽医学报, 2013, 33(10): 1579–1583.
WANG S S, HUANG Y, ZHANG S K, et al. Expression and distribution of angiotensin-converting enzyme 2 (ACE2) in tissue of piglets[J]. Chinese Journal of Veterinary Science, 2013, 33(10): 1579–1583. (in Chinese) |
| [9] |
权素玉, 王睿杰, 孙俊杰, 等. 血管紧张素转化酶2和中性氨基酸转运载体B0AT1在不同日龄猪肠道中的表达差异[J]. 畜牧与兽医, 2015, 47(4): 36–39.
QUAN S Y, WANG R J, SUN J J, et al. Different expression of angiotensin converting enzyme 2 and the neutral amino acid transporter B0AT1 in the intestinal tissues of different growth stage pigs[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(4): 36–39. (in Chinese) |
| [10] |
郭丽敏, 张雪莲, 杨金奎. 血管紧张素转换酶2在大鼠胰腺组织中的表达[J]. 基础医学与临床, 2007, 27(5): 490–494.
GUO L M, ZHANG X L, YANG J K. Expression of angiotensin-converting enzyme 2 in rat pancreas[J]. Basic & Clinical Medicine, 2007, 27(5): 490–494. DOI: 10.3969/j.issn.1001-6325.2007.05.003 (in Chinese) |
| [11] |
张树坤, 姜雪元, 谢正露, 等. 高精料饲喂产生脂多糖对奶山羊血浆游离氨基酸分配的影响及其机制[J]. 畜牧兽医学报, 2013, 44(3): 413–418.
ZHANG S K, JIANG X Y, XIE Z L, et al. Effect and mechanism of lipopolysaccharide on distribution of plasma free amino acid in dairy goats fed high concentrate feed[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(3): 413–418. (in Chinese) |
| [12] | LI W H, MOORE M J, VASILIEVA N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus[J]. Nature, 2003, 426(6965): 450–454. DOI: 10.1038/nature02145 |
| [13] | SINGER D, CAMARGO S M. Collectrin and ACE2 in renal and intestinal amino acid transport[J]. Channels, 2011, 5(5): 410–423. DOI: 10.4161/chan.5.5.16470 |
| [14] | HASHIMOTO T, PERLOT T, REHMAN A, et al. ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation[J]. Nature, 2012, 487(7408): 477–481. DOI: 10.1038/nature11228 |
| [15] |
车炼强, 张克英, 丁雪梅, 等. 免疫应激对仔猪肠道发育及胰高血糖素样肽-2分泌的影响[J]. 畜牧兽医学报, 2009, 40(5): 676–682.
CHE L Q, ZHANG K Y, DING X M, et al. Effect of immune challenge on gut development and GLP-2 secretion of piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(5): 676–682. DOI: 10.3321/j.issn:0366-6964.2009.05.012 (in Chinese) |
| [16] |
姜发亭. 断奶仔猪腹泻原因分析及防控措施[J]. 中国畜牧兽医文摘, 2013, 29(1): 140.
JIANG F T. Cause analysis and prevention and control measures of diarrhea in Weaned Piglets[J]. Chinese Animal Husbandry and Veterinary Digest, 2013, 29(1): 140. (in Chinese) |
| [17] |
黄骞.肠上皮细胞谷氨酰胺载体B0AT1/ASCT2的克隆表达及严重创伤后的功能调控研究[D].上海: 第二军医大学, 2007.
HUANG Q. The cloning and functional characterization of glutamine transporter B0AT1/ASCT2 in intestinal epithelial cell and the functional regulation after severe trauma[D]. Shanghai: The Second Military Medical University, 2007. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-90024-2007217695.htm |
| [18] | JANDO J, CAMARGO S M, HERZOG B, et al. Expression and regulation of the neutral amino acid transporter B0AT1 in rat small intestine[J]. PLoS One, 2017, 12(9): e0184845. DOI: 10.1371/journal.pone.0184845 |
| [19] | FAIRWEATHER S J, BRÖER A, SUBRAMANIAN N, et al. Molecular basis for the interaction of the mammalian amino acid transporters B0AT1 and B0AT3 with their ancillary protein collectrin[J]. J Biol Chem, 2015, 290(40): 24308–24325. DOI: 10.1074/jbc.M115.648519 |
| [20] | KOWALCZUK S, BRÖER A, TIETZE N, et al. A protein complex in the brush-border membrane explains a Hartnup disorder allele[J]. FASEB J, 2008, 22(8): 2880–2887. DOI: 10.1096/fj.08-107300 |
| [21] | PERLOT T, PENNINGER J M. ACE2-From the renin-angiotensin system to gut microbiota and Malnutrition[J]. Microb Infect, 2013, 15(13): 866–873. DOI: 10.1016/j.micinf.2013.08.003 |
| [22] |
王修启, 谭会泽, 束刚, 等. 鸡肠道SGLT1和GLUT2 mRNA表达的组织特异性研究[J]. 畜牧兽医学报, 2006, 37(1): 12–17.
WANG X Q, TAN H Z, SHU G, et al. Study on tissue-specific expression of SGLT1 and GLUT2 mRNA in chicken intestine[J]. Acta Veterinaria et Zootechnica Sinica, 2006, 37(1): 12–17. DOI: 10.3321/j.issn:0366-6964.2006.01.003 (in Chinese) |
| [23] | WONG T P, DEBNAM E S, LEUNG P S, et al. Involvement of an enterocyte renin-angiotensin system in the local control of SGLT1-dependent glucose uptake across the rat small intestinal brush border membrane[J]. J Physiol, 2007, 584(2): 613. DOI: 10.1113/jphysiol.2007.138578 |
| [24] | BERNARDI S, TIKELLIS C, CANDIDO R, et al. ACE2 deficiency shifts energy metabolism towards glucose utilization[J]. Metabolism, 2015, 64(3): 406–415. DOI: 10.1016/j.metabol.2014.11.004 |
| [25] | KIHARA M, SATO K, HASHIMOTO T, et al. Expression of endothelial nitric oxide synthase is suppressed in the renal vasculature of angiotensinogen-gene knockout mice[J]. Cell Tissue Res, 2006, 323(2): 313–320. DOI: 10.1007/s00441-005-0058-3 |
| [26] | HE F, WU C L, LI P, et al. Functions and signaling pathways of amino acids in intestinal inflammation[J]. BioMed Res Int, 2018, 2018: 9171905. |
| [27] | VICKERS C, HALES P, KAUSHIK V, et al. Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase[J]. J Biol Chem, 2002, 277(17): 14838–14843. DOI: 10.1074/jbc.M200581200 |
| [28] | MA K, HU Y J, SMITH D E. Influence of fed-fasted state on intestinal PEPT1 expression and in vivo pharmacokinetics of glycylsarcosine in wild-type and Pept1 knockout mice[J]. Pharm Res, 2012, 29(2): 535–545. DOI: 10.1007/s11095-011-0580-9 |
| [29] | VUILLE-DIT-BILLE R N, CAMARGO S M, EMMENEGGER L, et al. Human intestine luminal ACE2 and amino acid transporter expression increased by ACE-inhibitors[J]. Amino acids, 2015, 47(4): 693–705. DOI: 10.1007/s00726-014-1889-6 |
| [30] | SHIMIZU M. Multifunctions of dietary polyphenols in the regulation of intestinal inflammation[J]. J Food Drug Anal, 2017, 25(1): 93–99. DOI: 10.1016/j.jfda.2016.12.003 |
| [31] | CHHABRA K H, XIA H J, PEDERSEN K B, et al. Pancreatic angiotensin-converting enzyme 2 improves glycemia in angiotensin Ⅱ-infused mice[J]. Amer J Physiol Endocrinol Metab, 2013, 304(8): E874–E884. DOI: 10.1152/ajpendo.00490.2012 |
| [32] | KASSIRI Z, ZHONG J C, GUO D, et al. Loss of angiotensin-converting enzyme 2 accelerates maladaptive left ventricular remodeling in response to myocardial infarction[J]. Circ Heart Fail, 2009, 2(5): 446–455. DOI: 10.1161/CIRCHEARTFAILURE.108.840124 |



